Wat is de dichtheid van cellen?
Reader Mode
de dichtheid van biologisch materiaal is verantwoordelijk voor het neerzetten van cellen op de bodem van onze laboratoriumbuizen en multi-well platen en dient als basis voor het routinematig centrifugeren dat deel uitmaakt van het dagelijks leven van zoveel biologen. Dezelfde verschillen in dichtheid tussen cellen en hun waterige buitenkant zijn ook de basis van het contrast dat we waarnemen in fasemicroscopiebeelden. Deze verschillen zijn ook belangrijk buiten de labsetting. Bijvoorbeeld, plankton hebben te kampen met dit dichtheidsverschil om te blijven op een diepte in de oceaan waar zonlicht overvloedig is in plaats van te zinken naar de zwartgeblakerde dieptes. Gezien het feit dat de meeste biologen en biochemici dagelijks gebruik maken van scheiding op basis van dichtheid lijkt het verrassend hoe zelden dichtheden zoals die verzameld in Tabel 1 daadwerkelijk worden besproken.
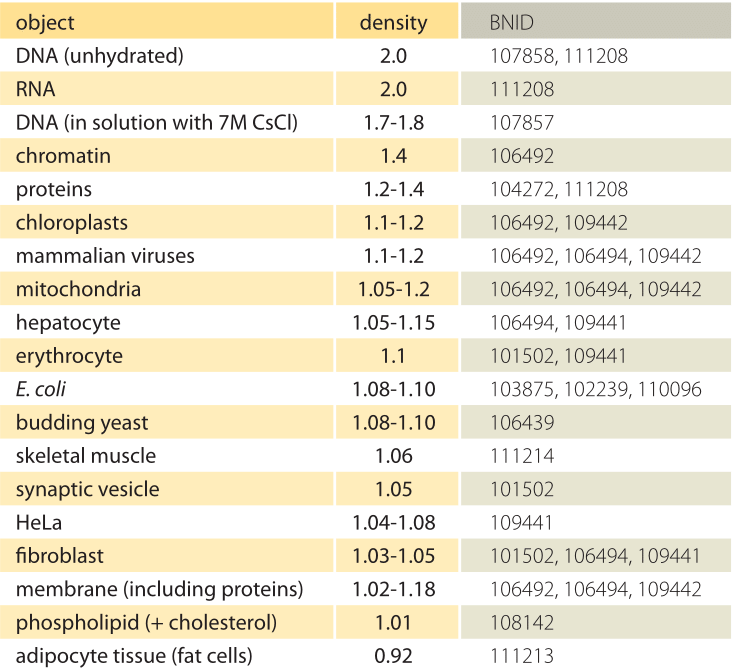
Tabel 1: dichtheid van biologische objecten ten opzichte van water. Dit komt bijna overeen met de hoeveelheid g/ml of 1000 kg/m3. Waarden worden gesorteerd in aflopende volgorde. Tenzij anders vermeld, werden de waarden gemeten in sucrose-of ficoll-oplossing.
Wat is de onderliggende basis voor de verschillende dichtheden van verschillende organellen en celtypen? Deze verschillen kunnen voor een groot deel worden toegeschreven aan de verhouding tussen watergehalte en drooggewicht. De proteã nen hebben een dichtheid van ≈1.3-1.4 (BNID 104272, 101502) ten opzichte van water (of bijna gelijkwaardig in eenheden van g/ml of 1000 kg/m3). Gegeven de benchmarkwaarde van 1 voor de dichtheid van water, een spectrum van tussenwaarden voor de celdichtheid tussen 1 en 1.3 worden verkregen op basis van de relatieve overvloed van eiwitten en water. Lipiden zijn aan de lage kant naast water met een dichtheid van ongeveer 1 (BNID 108142). Aan het andere uiterste kunnen zetmeelkorrels met een dichtheid van ≈1,5 (BNID 103206) en nucleotiden bij ≈1,7 de totale massabalans in de tegenovergestelde richting verschuiven.
Het kennen van de dichtheid is vaak gebaseerd op de plaats waar een bepaald biologisch bestanddeel bezinkt wanneer het wordt gesponnen in een centrifuge met een gradiënt van concentraties die vaak worden geproduceerd door sucrose of, in het geval van DNA, cesiumchloride. De dichtheid weerspiegelt de massa gedeeld door het volume, maar voor geladen verbindingen in oplossing wordt de dichtheid ook beïnvloed door schelpen van het zogenaamde gebonden water. De dichtheid wordt in dit geval een effectieve dichtheid, verminderd door het gebonden water, en dus enigszins afhankelijk van de zoutconcentratie (BNID 107858).
de sedimentatiesnelheid, zoals die in een centrifuge plaatsvindt, wordt gekwantificeerd in eenheden van Svedberg, die de oorsprong is van de namen 70S, 23S enz. voor het ribosoom en zijn rRNA subeenheden. Een 23S rRNA sediment met een snelheid van 23 × 10-12 m / s Onder normale zwaartekracht. In een ultracentrifuge die een versnelling van één miljoen g produceert, zal de snelheid proportioneel toenemen tot 23 × 10-6 m/s of ongeveer 1 mm / min. Het tarief van sedimentatie hangt van de dichtheid, grootte en vorm van de molecule af. Voor vergelijkbare vormen en dichtheden schaalt de sedimentatiesnelheid als de vierkantswortel van de molecuulmassa. Voor dergelijke gevallen gaat de molecuulmassa als het kwadraat van de sedimentatiesnelheid, zodanig dat de 23S en 16S subeenheden van het ribosoom een molecuulmassa hebben met een verhouding van ongeveer (23/16)2 of ongeveer 2 die nauw in lijn is met metingen van 0.9 en 0.5 MDa (BNID 110972, 110967). In de kliniek wordt de sedimentatiesnelheid van erytrocyten (rode bloedcellen) routinematig gebruikt om ontstekingen te meten. Tarieven veel hoger dan 10 mm / uur wijzen meestal op de aanwezigheid van de pro-sedimentatiefactor fibrinogeen dat een algemene indicator is van een inflammatoire aandoening.
Het is algemeen bekend dat water de meest voorkomende moleculaire fractie van cellen is, maar hoe overvloedig precies? Als we weefsels van meercellige organismen onderzoeken, is het vinden van het watergehalte een eenvoudige taak om de massa van het weefsel voor en na het drogen te meten. Maar hoe kan men dergelijke metingen voor cellen uitvoeren? Als we voor en na het drogen een massa cellen wegen, hoe meten we dan alleen de cellen zonder water eromheen? Zelfs na centrifugeren blijft er water achter in de celpellet, wat leidt tot onduidelijkheid over de droge massa zelf.
opnieuw komt radio-isotopische labeling te hulp (Cayley et al 1991). Eerst wordt geëtiketteerd water (met tritium, 3H) gemeten in een celpellet. Dit geeft de som van water binnen en buiten de cellen aan. Dan, meet een andere oplosbare verbinding die wordt geëtiketteerd maar die de cel, zoals 14C-inuline of 3H-pin niet kan ingaan, het volume van water buiten de cellen in een gecentrifugeerde pellet (bijvoorbeeld, in E. coli ongeveer 25-35% van het pelletvolume (BNID)). Het verschil geeft het watergehalte in cellen aan. Dergelijke methoden leiden tot typische waarden variërend van ≈60-65 massaprocent voor ontluikende gist en rode bloedcellen tot ≈70% voor E. coli en de amoebe D. discoideum en tot ≈80% voor rattenspier-en varkenshartweefsels (BNID 105938, 103689). Aangezien de bijdrage van de droge stof wordt gedomineerd door bestanddelen van dichtheid ≈1,3 (d.w.z. eiwitten), leidt dit tot de karakteristieke totale dichtheid van ≈1,1 (BNID 103875, 106439, 101502). Uit deze karakteristieke fracties kan het drooggewicht per volume worden afgeleid op ongeveer 300-500 mg / ml (BNID 108131, 108135, 108136), maar bij langzame groei kunnen de waarden hoger zijn. Lage dichtheden zijn gebruikelijk in droge zaden en onderwaterplanten die drijvende delen hebben met een dichtheid van minder dan het omringende water, waardoor ze kunnen drijven. Een lagere dichtheid dan die van water kan worden bereikt door gas zoals in kelp en sommige bacteriën of door het gebruik van opgeloste stoffen met een moleculair gewicht (MW) lager dan de omringende media (bijvoorbeeld het vervangen van natrium door mw≈23 door ammonium met MW≈18) Zoals in de kleine kreeftachtigen, Antarctische roeipootkreeftjes.
mensen bestaan voor ongeveer 60% uit water (40% in cellen, 15% in interstitiële vloeistof en 5% in bloedplasma, BNID 110743) en de meesten van ons hebben de sterke effecten ervaren van dehydratie na het vergeten om zelfs maar een paar glazen te drinken. Toch kunnen sommige cellen verrassend robuust zijn voor een afname van hun watergehalte. Bijvoorbeeld het tarief van glucosemetabolisme in de cellen van de lever van de rat werd niet beà nvloed door 25% verlies van intracellular water. Een dergelijke afname kan worden bereikt door osmose-het veranderen van de toniciteit (opgeloste concentratie) van de extracellulaire vloeistof. Een extreem voorbeeld is dat van de opmerkelijke pekelgarnalen. Leven in omgevingen waar de buitenkant zoutconcentratie kan fluctueren en zijn zeer hoog, werd aangetoond dat cysten die kunnen worden uitgedroogd tot slechts 2% water zonder onomkeerbare schade en bij hydratatie niveaus van hoger dan 37% (slechts ongeveer de helft van de volledig gehydrateerde toestand) hun fysiologie gedraagt zich als normaal. Deze robuustheid in het licht van waterverlies kan worden gerelateerd aan een onderscheid soms gemaakt tussen twee vormen van water in de cel interieur. Normaal ” bulkwater “dat meer vervangbaar is en” gebonden water ” dat wordt geassocieerd met de cellulaire componenten en dient als een oplosmiddel dat essentieel is voor een goede werking.





