een belangrijk onderdeel van het begrijpen hoe deze systemen werken om celdeling te controleren was de ontdekking dat p53 zowel kanker als aging beïnvloedt. Tyner et al. (2002) bedacht agenetische strategie in muizen om de gevolgen van de afwezigheid van p53 of asmaller dan normale p53-proteã ne te vergelijken. De twomutant transgene muizenlijnen hadden ofwel een volledige schrapping van het p53-gen (p53 -) of een afgeknotte vorm van p53 (p53m, mutant)die niet de eerste zes exons van het p53-gen (Figuur 2).
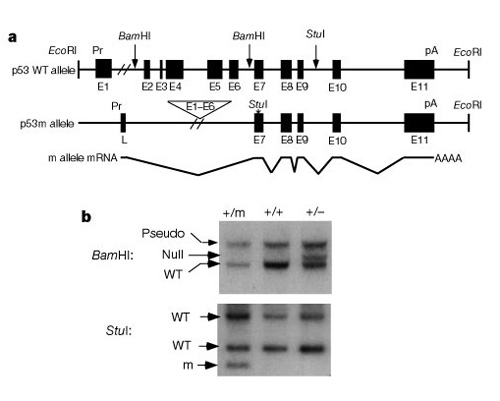
in de eerste helft van het onderzoek werden drie groepen muizen vergeleken:groep 1, p53+/p53-(verwijdering van één kopie van p53); groep 2, p53+/p53m(partiële deletie mutant); en groep 3, p53+ / p53+(wild type, normaal). Tabel 1 toont deze drie groepen en hun experimentele resultaten gerelateerd aan de kanker en verouderingsfenotypen. Interessant is dat geen van de muizen in groep 2, met de afgeknotte p53 eiwit, ontwikkelde levensbedreigende tumoren, terwijl 45% van groep 3 (wild type) en meer dan 80% van groep 1 ontwikkelde leven-bedreigende tumoren. De muizen van groep 2 hadden ook een middenlevensduur tussen de zeer korte levensduur van groep 1 en de langere levensduur van muizen van groep 3wild type. De conclusie uit deze gegevens is dat de partiële p53-mutatie de incidentie van kanker verminderde en tegelijkertijd een tekort in de levensduur leek te veroorzaken, niet een verlengde levensduur.
| Tabel 1. Experimental results from genetic mousestudies with p53 mutants | |||
| Genotype | Cancer phenotype | Agingphenotype | |
| Group 1 | p53+/p53- (complete deletion) | 80%had tumors | Muchshorter life span |
| Group 2 | p53+/p53m (partial mutant) | None | Shorterlife span |
| Group 3 | p53+/p53+ (wild type) | 45%had tumors | Normallife span |
| aangepast van Tyner etal. 2002 | |||
De auteurs merkten ook op dat de muizen van groep 2 fenotypen ontwikkelden die kenmerkend zijn voor oude muizen, zoals langzame haargroei en gebochelde stekels als gevolg van veranderingen in het skelet, eerder dan de wild-type muizen deden (figuur 3).

In de tweede helft van het onderzoek vroegen Tyner en collega ‘ s of de p53-Mutant anders werkte in aanwezigheid van normale p53. Ze kweekten een extra transgene muislijn met p53 – /p53m mutantalleles en vonden dat deze muizen niet de sterke tumorbescherming en displayeda veel minder levensduur effect hadden. Dus de mutant p53 moest op de een of andere manier werken inconcert met normale p53 om een effect te hebben. Als algemene observatie meldden de onderzoekers dat cellen uit de p53 + / p53m heterozygote ongeveer drie keer zo hard bleken te zijn om te transformeren als wild-type cellen. Dus, hoewel deze cellen resistent waren tegen kanker, deze p53+/ p53mbackground veroorzaakte ook eerdere veroudering. De activiteit van p53 in dezeheterozygoten bleek namelijk beduidend hoger te zijn dan zijn activiteit in het wild. type.It leek dat een dergelijke verandering, hoewel apriori, goed zou zijn tegen zowel kanker en senescentie, maar dat bleek niet het geval te zijn.
Later, Mooreet al. aangetoond dat in culturedcellen met dezelfde mutatie veroorzaakt afgekapt p53 eiwit, dit afgekapt proteïne in de kern en colokaliseerd met de normale p53. Zij bestudeerden ook de halveringstijd van de p53 proteã ne binnen cellen en vonden dat de heterozygoten met één exemplaar van de mutant p53 ongeveer drievoudige verhoging van stabiliteit van de normale proteã ne p53 had, vergeleken met de stabiliteit in het wilde type alleen, betekenend was de stabiliteit van de proteã ne boven normaal verbeterd. Deze resultaten in gekweekte cellen uitgebreid en bevestigd de studie geleid door Tyner et al. bij muizen. Voorts was dit de eerste reactieweg van de celdeling ontdekt om via p53 te werken en duidelijk zowel kankergezindheid als het verouderen te moduleren.
in de RB-route, die het verlaten van de celdivisiecyclus kan signaleren, veroorzaken gebeurtenissen zoals DNA-schade of onvoldoende replicatie die leidt tot korte telomeren aan chromosoomeinden een verminderde CDK-signalering. Dit, inturn, verhoogt de activiteit van het eiwitkinase van Rb en verhoogt bijgevolg de activiteit van de transcriptiefactor E2F. Wat is de Betekenis van E2F? Deze transscriptiefactor bindt aan de promotors van RNA-polymerasesubeenheden en andere eiwitten die nodig zijn voor de S-fase om te beginnen ,en het helpt om celldivision te starten (Campisi 2003; Weinberg 1995). Aldus schijnt het dat zowel p53 als Rb wegen op de zelfde controlemechanismen van de celcyclus beïnvloeden.
