korte beschrijving van twee typen geprogrammeerde celdood: apoptose en autofagie
apoptose, of type I geprogrammeerde celdood, is de meest bestudeerde vorm van celdood. Zijn morfologische kenmerken kunnen onder lichte microscopie worden geà dentificeerd, en omvatten celkrimp, het verdichten van chromatin, het blebbing van het cytoplasmic membraan, en, tenslotte, de vorming van apoptotic organismen (figuur 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
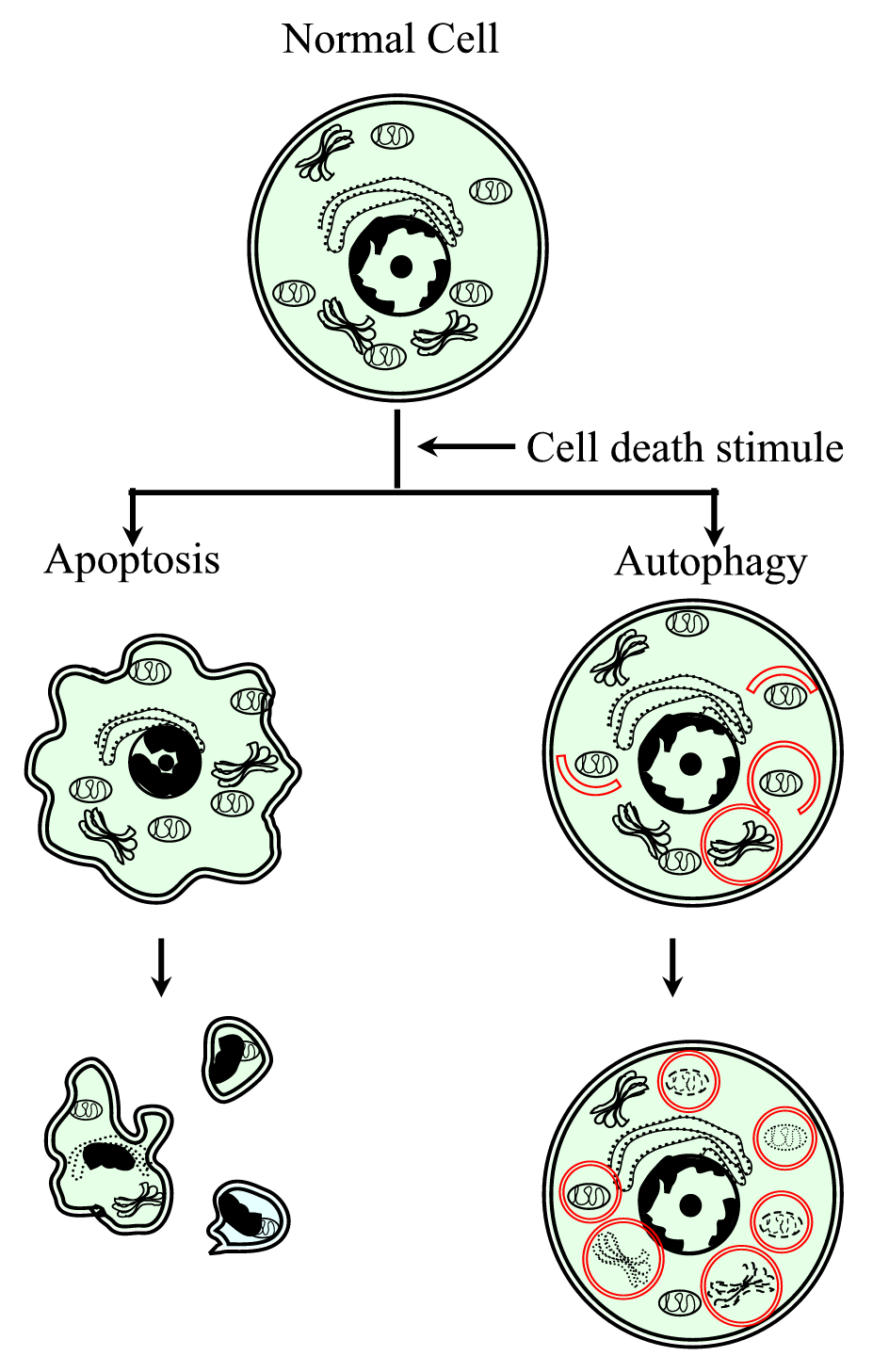
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi= “http://www.w3.org/2001/XMLSchema-instanceschematische weergave van het geprogrammeerde celdoodproces type I (apoptose) en type II (autofagie). Apoptosis wordt gekenmerkt door een cellulaire samentrekking, chromatine verdichting, membraneuze blebs, en de vorming van apoptotische lichamen. Autophagy wordt gekenmerkt door de aanwezigheid van een groot aantal autophagosomes met cytoplasmic inhoud. Beide types van celdood produceren geen ontstekingsreactie aangezien het cytoplasmic membraan wordt behouden tot het cellulaire puin door Buurt of door gespecialiseerde degenen wordt geëlimineerd.
Caspasen zijn cysteïnyl-aspartaat-specifieke proteasen die in inactieve vorm gesynthetiseerd worden als zymogenen die pro-caspasen worden genoemd (Figuur 2). Het is deze inactieve vorm die de gecontroleerde uitvoering van het celdoodproces toestaat. Caspasen werden voor het eerst geïdentificeerd in de nematode Ceanorhabditis elegans, maar homologe vormen zijn aanwezig in zoogdieren .
De kenmerken van apoptose, zoals DNA-fragmentatie en gecomprimeerd chromatine, zijn het gevolg van caspase-activiteit. Tijdens apoptosis, is DNA gefragmenteerd in nucleosome grootte (200 bp). De factor verantwoordelijk voor de fragmentatie van DNA tijdens apoptose is een specifieke DNase (CAD, caspase-geactiveerde DNase) die door actieve caspase-3 wordt geactiveerd . De actieve caspase-3, op zijn beurt, is betrokken bij morfologische celveranderingen tijdens apoptosis, waar het rho-geassocieerd kinase-1 (rots-1) splijt om het te activeren en dit, tenslotte, beà nvloedt de cytoskeletal regeling veroorzakend de apoptotische krimpmorfologie .

Figuur 2.
xmlns: xlink= “http://www.w3.org/1999/xlink ” xmlns:mml= “http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceCaspasen die betrokken zijn bij het apoptotisch proces worden in een inactieve vorm gesynthetiseerd als zymogenen, worden gevormd door een pro-domein, een grote subeenheid en een kleine subeenheid. De zymogenen worden geactiveerd en vormen tetramers.
apoptotische celdood wordt sterk gereguleerd door leden van de B-cellymfoom 2 (Bcl-2) familie . Bcl-2-familieleden zijn geclassificeerd als anti-apoptotische en pro-apoptotische eiwitten volgens hun Bcl-2-homologie (BH) en domeinorganisatie (Figuur 3). De aanwezigheid van domeinen BH1, BH2, BH3 en BH4 komt overeen met de groep die apoptosis remt. De pro-apoptotische groep, in tegenstelling, is verdeeld in twee groepen: die met domeinen BH1, BH2 en BH3, en die met alleen de BH3 domeinen (gedefinieerd als BH3 alleen; zie de recensie in ). Deze familie van proteã nen voert zijn functies op intracellular niveau binnen mitochondria, een zeer belangrijk element in apoptosis uit.

Figuur 3.
xmlns: xlink= “http://www.w3.org/1999/xlink ” xmlns: mml=”http://www.w3.org/1998/Math/MathML ” xmlns:xsi= “http://www.w3.org/2001/XMLSchema-instanceB-cellymfoom 2 (Bcl-2) familie eiwitten. A) algemene schematisering van de structuur van Bcl-2 proteã nen. B) de anti-apoptotische leden – zij bezitten alle vier BH domeinen. C) de pro-apoptotische leden die op hun beurt zijn verdeeld in twee groepen: multidomain en BH3 alleen.
apoptose kan worden geïnitieerd door twee goed beschreven routes: de extrinsieke en intrinsieke routes (Figuur 4). De extrinsieke activering wordt geleid door de participatie van doodsligands (zoals de factor – TNF – superfamilie van tumornecrose, en TNF-verwante apoptose-veroorzaakte ligands, of spoor) met hun verwante receptoren van de celoppervlaktedood (zoals TNF receptor 1, Fas, SLEEPRECEPTOR 1, of SLEEPRECEPTOR 2) (herzien binnen ). Zodra het ligand zijn receptor herkent en bindt, wordt een reeks intracellulaire complexen gevormd om de caspasen van de oorzaak te activeren (zoals -8 en -10), die dan de caspasen van de beul activeren (zoals -3, -6 en -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. De ligand-receptorinteractie veroorzaakt de assemblage van het dood-veroorzakende signalerende complex (schijf) om de activering van caspase-8 te bevorderen, die beurtelings aan uitvoerder caspase -3, -6, of -7 kan activeren, die aan de morfologische veranderingen van apoptose leiden. De intrinsieke route wordt geleid door de mitochondriale permeabilisatie van het buitenmembraan, die de afgifte van pro-apoptotische elementen toestaat aangezien cytochroom-C. cytochroom-C de apoptosis protease-activerende factor 1 (Apaf-1) induceert om de activering van caspase-9 te bevorderen om apoptosoom te assembleren. Apoptosome kan aan uitvoerder caspases activeren.
de intrinsieke apoptotische route kan daarentegen worden geactiveerd door verschillende stimuli, waaronder DNA-schade, groeifactor verhongering en oxidatieve stress . Tijdens blootstelling van cellen aan deze stimuli, worden mitochondria beà nvloed, aangezien verscheidene leden van de familie Bcl-2 worden geactiveerd en mitochondria buitenmembraan permeabilization (MOMP) bevorderen. Het doordrongen externe mitochondriamembraan staat de versie van cytochroom c (cyt c) toe, die met de Proteã ne Apaf-1 wordt geassocieerd. De Unie van cyt C en Apaf-1 bindt dan aan initiator caspase-9 om het complex te vormen dat apoptosome vormt, dat de capaciteit heeft om initiator caspases te activeren die hun functies door specifieke cellulaire substraten te splitsen uitvoeren.het tweede proces van celdood, autofagie, is een genetisch geprogrammeerd en evolutionair geconserveerd proces dat de afbraak van verouderde organellen en eiwitten veroorzaakt. Het wordt geactiveerd door dergelijke extracellulaire stimuli zoals voedende honger, hypoxie, op hoge temperatuur, en veranderde intracellular voorwaarden, met inbegrip van de accumulatie van beschadigde of overbodige organellen (herzien binnen ).
In eukaryotische organismen zijn drie soorten autofagie beschreven: microautofagie, macroautofagie (vaak simpelweg autofagie genoemd) en door Chaperon gemedieerde autofagie (Figuur 5). Microautophagy impliceert het overspoelen van cytoplasmic componenten direct op het niveau van lysosome door middel van een invaginationproces, terwijl macroautophagy de vorming van dubbel-membraanblaasjes impliceert die cellulaire componenten bevatten, die met lysosomes smelten om autophagolysosome te vormen. Het is binnen autophagolysosoom dat de intra-vesiculaire componenten worden afgebroken en, indien mogelijk, door de cel worden gerecycleerd (herzien in ). Chaperone-bemiddelde autophagy, tenslotte, impliceert de deelname van chaperones in het erkennen van de proteã nen die voor verwijdering door lysosomes worden aangewezen .

Figuur 5.
xmlns: xlink= “http://www.w3.org/1999/xlink”xmlns:mml=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceschematische representaties van de verschillende mechanismen van autofagie. Macroautophagy – autophagy-impliceert de vorming van een dubbel-membraanblaasje, dat cytoplasmic inhoud overspoelt die aan lysosome zal worden geleid worden gedegradeerd. Microautophagy wordt gekenmerkt door het directe overspoelen van cytoplasmic componenten door lysosome. Dit proces impliceert het remodelleren van het membraan van organelle door een lysosomal membraan invagination te vormen. Tijdens chaperone-bemiddelde autophagy, worden de te degraderen proteã nen gericht voor Hsp70, die op zijn beurt de doelvracht aan lysosome vervoeren.
autofagie wordt geleid door Atg(autofagie-gerelateerde) genen, die nodig zijn om het signaalcomplex te activeren dat de vorming van autofagosomen activeert . Atggenes werden ontdekt in gist, maar velen hebben orthologen in hogere eukaryoten (Figuur 6). De autophagosome vorming impliceert de participatie van cytoplasmic proteã ne LC3 (Atg8), die lipidatie door phosphatidylethanolamine ondergaat, en dan aan het ontluikende autophagosome membraan wordt aangeworven (Figuur 7). De accumulatie van lipided LC3 proteã ne (als LC3-II wordt bekend) wordt gebruikt als marker van autophagy .

Figuur 6.
xmlns: xlink= “http://www.w3.org/1999/xlink ” xmlns: mml=”http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. LC3 eiwit wordt lipidated door de fosfatidylethanolamine.
Autofagische celdood, of type II geprogrammeerde celdood, wordt gekenmerkt door een massale overspoeling van het cytoplasma door autofagische blaasjes. Deze intense autophagic activiteit verschilt wezenlijk van autophagy die onophoudelijk op basale niveaus voorkomt. De ultrastructurele studies in Drosophila hebben de accumulatie van autophagic vacuoles in de meeste larvale weefsels geopenbaard. Dit type van geprogrammeerde celdood begint met de degradatie van cytoplasmic organellen door autophagy, hoewel de cytoskeletal elementen tot de late stadia van het proces (herzien binnen) worden behouden.
