leerdoelstellingen
- Beschrijf de fundamentele structuur van een aminozuur
- Beschrijf de chemische structuren van eiwitten
- vat de unieke kenmerken van eiwitten
aan het begin van dit hoofdstuk werd een beroemd experiment beschreven waarin wetenschappers aminozuren synthetiseerden onder omstandigheden die de op aarde aanwezige aminozuren simuleerden lang voor de evolutie van het leven zoals we het kennen.. Deze samenstellingen zijn in staat om in wezen om het even welk aantal samen te binden, leverend molecules van in wezen om het even welke grootte die een brede waaier van fysische en chemische eigenschappen bezitten en talrijke functies uitvoeren essentieel aan alle organismen. De moleculen afgeleid van aminozuren kunnen functioneren als structurele componenten van cellen en subcellulaire entiteiten, als bronnen van voedingsstoffen, als atoom – en energie-opslagreservoirs, en als functionele species zoals hormonen, enzymen, receptoren, en transportmoleculen.
aminozuren en peptidebindingen

figuur 1.
een aminozuur is een organisch molecuul waarin een waterstofatoom, een carboxylgroep (–COOH) en een aminogroep (–NH2) allemaal gebonden zijn aan hetzelfde koolstofatoom, de zogenaamde α-koolstof. De vierde groep gebonden aan de α-koolstof varieert tussen de verschillende aminozuren en wordt een residu of een zijketen genoemd, vertegenwoordigd in structuurformules door de letter R. een residu is een monomeer dat resulteert wanneer twee of meer aminozuren watermoleculen combineren en verwijderen. De primaire structuur van een eiwit, een peptide keten, wordt gemaakt van aminozuurresiduen. De unieke kenmerken van de functionele groepen en R-groepen staan deze componenten van de aminozuren toe om waterstof, Ionische, en disulfidebanden, samen met polaire/niet-polaire interactie te vormen die nodig zijn om secundaire, tertiaire, en quaternaire eiwitstructuren te vormen. Deze groepen bestaan voornamelijk uit koolstof, waterstof, zuurstof, stikstof en zwavel, in de vorm van koolwaterstoffen, zuren, amiden, alcoholen en aminen. In Figuur 1 worden enkele voorbeelden gegeven die deze mogelijkheden illustreren.
aminozuren kunnen chemisch aan elkaar binden door reactie van de carboxylzuurgroep van een molecuul met de aminegroep van een andere. Deze reactie vormt een peptide binding en een watermolecuul en is een ander voorbeeld van dehydratatiesynthese (Figuur 2). De Molecules die door chemisch vrij bescheiden aantallen aminozuren (ongeveer 50 of minder) te verbinden worden gevormd worden genoemd peptides, en prefixen worden vaak gebruikt om deze aantallen te specificeren: dipeptides (twee aminozuren), tripeptides (drie aminozuren), enz. Meer in het algemeen wordt het Geschatte aantal aminozuren aangeduid: oligopeptiden worden gevormd door zich aan ongeveer 20 aminozuren aan te sluiten, terwijl polypeptiden worden samengesteld uit maximaal ongeveer 50 aminozuren. Wanneer het aantal samen verbonden aminozuren zeer groot wordt, of wanneer veelvoudige polypeptiden als bouwsubeenheden worden gebruikt, worden de macromoleculen die resulteren genoemd proteã nen. De continu variabele lengte (het aantal monomeren) van deze biopolymeren, samen met de verscheidenheid van mogelijke R-groepen op elk aminozuur, staat voor een bijna onbeperkte diversiteit in de soorten proteã nen toe die kunnen worden gevormd.

Figuur 2. De vorming van de peptideband is een dehydratatiesynthesereactie. De carboxylgroep van het eerste aminozuur (alanine) is verbonden met de aminogroep van het inkomende tweede aminozuur (alanine). Daarbij komt een molecuul water vrij.
denk er eens over na
- hoeveel aminozuren zitten er in polypeptiden?
eiwitstructuur
De grootte (lengte) en de specifieke aminozuurvolgorde van een eiwit zijn belangrijke determinanten van zijn vorm, en de vorm van een eiwit is cruciaal voor zijn functie. Bijvoorbeeld, in het proces van biologische stikstof fixatie (zie biogeochemische cycli), bodem micro-organismen collectief bekend als rhizobia symbiotisch interactie met wortels van peulvruchten planten zoals sojabonen, pinda ‘ s, of bonen om een nieuwe structuur genaamd een knobbeltje op de plantenwortels te vormen. De plant produceert dan een drager eiwit genaamd leghemoglobine, een eiwit dat stikstof of zuurstof vervoert. Leghemoglobine bindt met een zeer hoge affiniteit aan zijn substraatzuurstof op een specifiek gebied van het eiwit waar de vorm en de aminozuurvolgorde geschikt zijn (de actieve plaats). Als de vorm of het chemische milieu van de actieve plaats wordt veranderd, zelfs lichtjes, kan het substraat niet kunnen zo sterk binden, of het kan helemaal niet binden. Aldus, voor de proteã ne om volledig actief te zijn, moet het de aangewezen vorm voor zijn functie hebben.
eiwitstructuur wordt ingedeeld in vier niveaus: Primair, Secundair, Tertiair en quaternair. De primaire structuur is eenvoudig de opeenvolging van aminozuren die omhoog de polypeptideketen maken. Figuur 3 toont de primaire structuur van een eiwit.
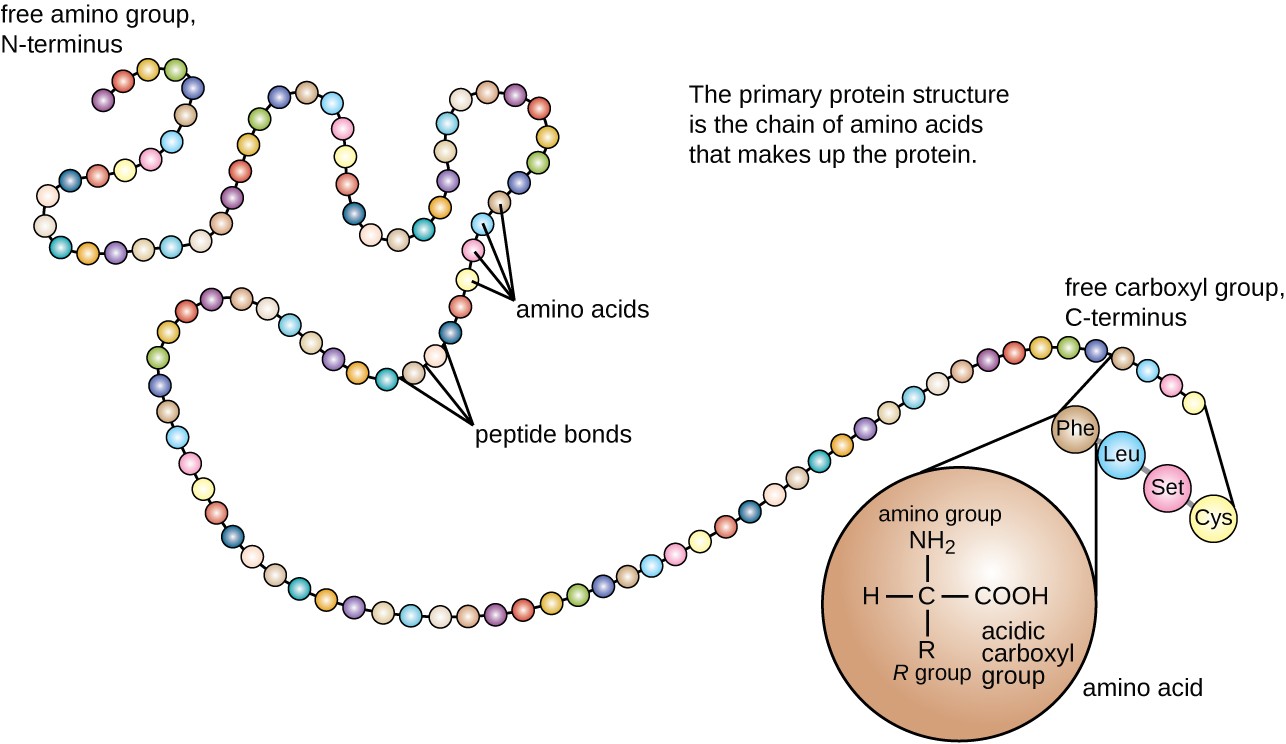
Figuur 3. Klik om een grotere afbeelding te bekijken. De primaire structuur van een eiwit is de opeenvolging van aminozuren. (credit: modification of work by National Human Genome Research Institute)
de keten van aminozuren die de primaire structuur van een eiwit definieert is niet stijf, maar in plaats daarvan flexibel vanwege de aard van de bindingen die de aminozuren bij elkaar houden. Wanneer de keten lang genoeg is, kan waterstofbinding optreden tussen functionele amine-en carbonylgroepen binnen de peptide-backbone (met uitzondering van de R-zijgroep), waardoor de polypeptideketen gelokaliseerd wordt gevouwen in helices en platen. Deze vormen vormen de secundaire structuur van een eiwit. De meest voorkomende secundaire structuren zijn de α-helix en β-geplooide plaat. In de structuur van de α-helix wordt de helix gehouden door waterstofbindingen tussen het zuurstofatoom in een carbonylgroep van één aminozuur en het waterstofatoom van de aminogroep dat slechts vier aminozuureenheden verder langs de keten is. In het β-geplooide blad, worden de plooien gevormd door gelijkaardige waterstofbanden tussen ononderbroken opeenvolgingen van carbonyl en aminogroepen die verder op de backbone van de polypeptideketen worden gescheiden (Figuur 4).

Figuur 4. De secundaire structuur van een eiwit kan een α-helix of een β-geplooide plaat zijn, of beide.
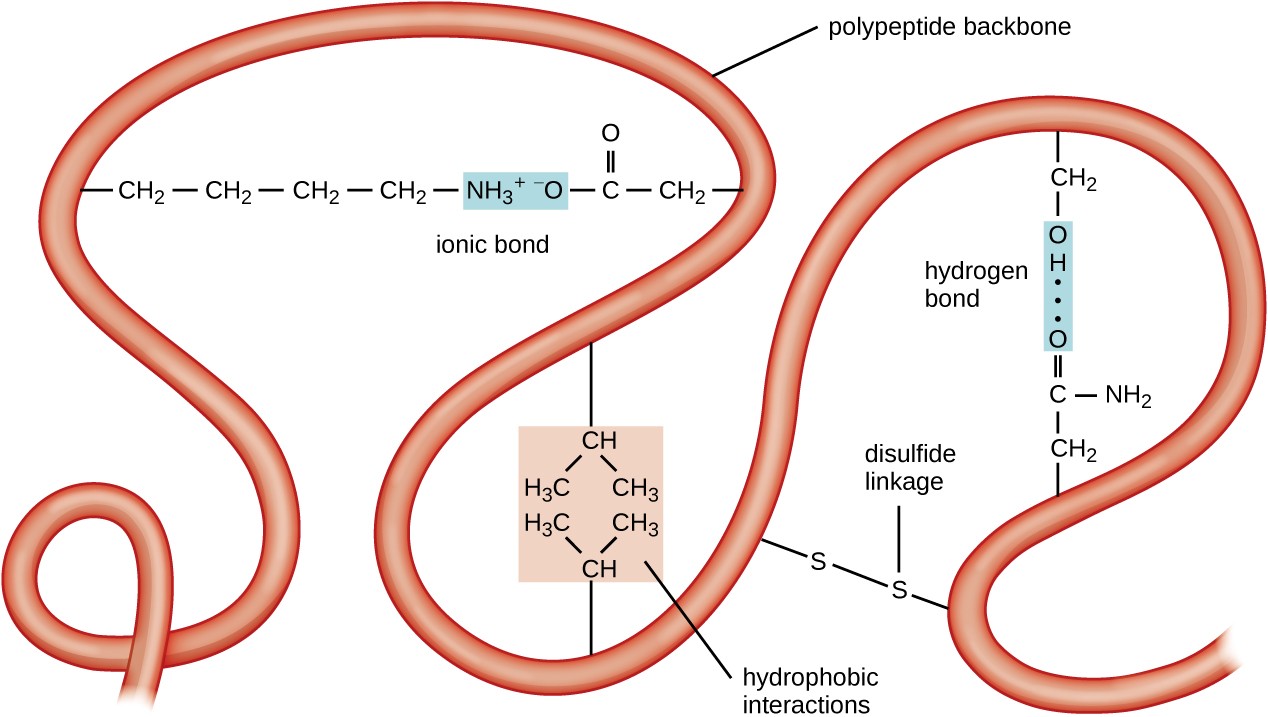
Figuur 5. Klik om een grotere afbeelding te bekijken. De tertiaire structuur van proteã nen wordt bepaald door een verscheidenheid van aantrekkelijke krachten, met inbegrip van hydrophobic interactie, Ionische het binden, waterstof het binden, en disulfideverbanden.
het volgende niveau van eiwitorganisatie is de tertiaire structuur, de grootschalige driedimensionale vorm van een enkele polypeptideketen. Tertiaire structuur wordt bepaald door interacties tussen aminozuurresiduen die ver uit elkaar liggen in de keten. Een verscheidenheid van interactie leidt tot eiwit tertiaire structuur, zoals disulfidebruggen, die banden tussen de functionele groepen sulfhydryl (–SH) op aminozuur zijgroepen zijn; waterstofbanden; Ionische banden; en hydrophobic interactie tussen niet-polaire zijketens. Al deze interacties, zwak en sterk, combineren om de uiteindelijke driedimensionale vorm van het eiwit en zijn functie te bepalen (Figuur 5).
het proces waarbij een polypeptideketen een grote driedimensionale vorm aanneemt, wordt eiwitvouwen genoemd. Gevouwen proteã nen die volledig functioneel in hun normale biologische rol zijn wordt gezegd om een inheemse structuur te bezitten. Wanneer een eiwit zijn driedimensionale vorm verliest, kan het niet langer functioneel zijn. Deze ontvouwde eiwitten worden gedenatureerd. Denaturatie impliceert het verlies van de secundaire structuur en de tertiaire structuur (en, indien aanwezig, de quaternaire structuur) zonder het verlies van de primaire structuur.
sommige eiwitten zijn samenstellingen van verschillende afzonderlijke polypeptiden, ook wel eiwitsubeenheden genoemd. Deze proteã NEN functioneren adequaat slechts wanneer alle subeenheden aanwezig zijn en gepast worden gevormd. De interactie die deze subeenheden samen houden vormt de quaternaire structuur van de proteã ne. De totale quaternaire structuur wordt gestabiliseerd door relatief zwakke interacties. Hemoglobine, bijvoorbeeld, heeft een quaternaire structuur van vier bolvormige eiwit subeenheden: twee α en twee β polypeptiden, elk met een op ijzer gebaseerde heem (Figuur 6).

Figuur 6. Een hemoglobinemolecuul heeft twee α-en twee β-polypeptiden samen met vier heemgroepen.
een andere belangrijke klasse van eiwitten is de geconjugeerde eiwitten die een niet-proteïne gedeelte hebben. Als het geconjugeerde eiwit een koolhydraat heeft, wordt het een glycoproteïne genoemd. Als het een lipide in bijlage heeft, wordt het een lipoproteïne genoemd. Deze eiwitten zijn belangrijke componenten van membranen. Figuur 7 vat de vier niveaus van eiwitstructuur samen.

Figuur 7. De eiwitstructuur heeft vier niveaus van organisatie. (credit: modification of work by National Human Genome Research Institute)
denk er eens over
- Wat kan er gebeuren als de primaire, secundaire, tertiaire of quaternaire structuur van een eiwit wordt gewijzigd?
primaire structuur, disfunctionele eiwitten en cystische fibrose

Figuur 8. Klik om een grotere afbeelding te bekijken. Het normale CFTR-eiwit is een kanaaleiwit dat zout (natriumchloride) helpt in en uit cellen te bewegen.
eiwitten geassocieerd met biologische membranen worden geclassificeerd als extrinsiek of intrinsiek. Extrinsieke proteã nen, ook genoemd perifere proteã nen, worden losjes geassocieerd met één kant van het membraan. De intrinsieke proteã nen, of Integrale proteã nen, zijn ingebed in het membraan en functioneren vaak als deel van vervoerssystemen als transmembrane proteã nen. Cystische fibrose (CF) is een menselijke genetische aandoening die wordt veroorzaakt door een verandering in het transmembraaneiwit. Het beïnvloedt meestal de longen, maar kan ook invloed hebben op de alvleesklier, lever, nieren, en darm. CF wordt veroorzaakt door een verlies van het aminozuur fenylalanine in een cystic fibrosis transmembrane protein (CFTR). Het verlies van één aminozuur verandert de primaire structuur van een eiwit dat normaal gesproken helpt zout en water in en uit cellen te transporteren (Figuur 8).
de verandering in de primaire structuur voorkomt dat het eiwit goed functioneert, waardoor het lichaam ongewoon dik slijm produceert dat de longen verstopt en leidt tot de ophoping van kleverig slijm. Het slijm belemmert de alvleesklier en voorkomt dat natuurlijke enzymen het lichaam helpen voedsel af te breken en vitale voedingsstoffen op te nemen.
in de longen van personen met cystische fibrose zorgt het veranderde slijm voor een omgeving waar bacteriën kunnen gedijen. Deze kolonisatie leidt tot de vorming van biofilms in de kleine luchtwegen van de longen. De meest voorkomende pathogenen in de longen van patiënten met cystische fibrose zijn Pseudomonas aeruginosa (figuur 9a) en Burkholderia cepacia. Pseudomonas onderscheidt zich binnen de biofilm in de longen en vormt grote kolonies, genaamd” mucoïde ” Pseudomonas. De kolonies hebben een unieke pigmentatie die blijkt uit laboratoriumtesten (figuur 9b) en geeft artsen de eerste aanwijzing dat de patiënt CF heeft (zulke kolonies zijn zeldzaam bij gezonde individuen).

figuur 9. (a) een scanning elektronenmicrograaf toont de opportunistische bacterie Pseudomonas aeruginosa. b) Pigmentproducerende P. aeruginosa op cetrimide agar toont het groene pigment genaamd pyocyanine. (credit a: modification of work by the Centers for Disease Control and Prevention)
sleutelbegrippen en samenvatting
- aminozuren zijn kleine moleculen die essentieel zijn voor alle leven. Elk heeft een α-koolstof waaraan een waterstofatoom, carboxylgroep en aminegroep zijn gebonden. De vierde gebonden groep, vertegenwoordigd door R, varieert in chemische samenstelling, grootte, polariteit, en last tussen verschillende aminozuren, die variatie in eigenschappen verstrekken.
- peptiden zijn polymeren die worden gevormd door de koppeling van aminozuren via dehydratatiesynthese. De banden tussen de verbonden aminozuren worden genoemd peptide banden. Het aantal aminozuren dat met elkaar verbonden is kan variëren van een paar tot veel.
- eiwitten zijn polymeren die worden gevormd door de koppeling van een zeer groot aantal aminozuren. Zij vervullen vele belangrijke functies in een cel, die als voedingsstoffen en enzymen dienen; opslagmoleculen voor koolstof, stikstof en energie; en structurele componenten.
- de structuur van een eiwit is een kritische determinant van zijn functie en wordt beschreven door een gegradueerde classificatie: Primair, Secundair, Tertiair en quaternair. De inheemse structuur van een eiwit kan door denaturatie worden verstoord, resulterend in verlies van zijn hogere orde structuur en zijn biologische functie.
- sommige eiwitten worden gevormd door verschillende afzonderlijke eiwitsubeenheden, de interactie van deze subeenheden die de quaternaire structuur van het eiwitcomplex vormen.
- geconjugeerde eiwitten hebben een niet-polypeptidegedeelte dat een koolhydraten (die een glycoproteïne vormen) of een lipidefractie (die een lipoproteïne vormen) kan zijn. Deze eiwitten zijn belangrijke componenten van membranen.
Multiple Choice
welke van de volgende groepen varieert tussen verschillende aminozuren?
- waterstofatoom
- carboxylgroep
- R groep
- aminogroep
de aminozuren aanwezig in eiwitten verschillen in welke van de volgende?
- grootte
- vorm
- zijgroepen
- alle bovenstaande
welke van de volgende obligaties zijn niet betrokken bij de tertiaire structuur?
- peptidebindingen
- ionenbindingen
- hydrofobe interacties
- waterstofbindingen
vul de blanco in
de sequentie van aminozuren in een eiwit wordt zijn __________.
denaturatie impliceert het verlies van de __________ en __________ structuren zonder het verlies van de __________ structuur.
True / False
een verandering in één aminozuur in een eiwitsequentie resulteert altijd in functieverlies.
denk na
- een eiwit voldoende verhitten kan het denatureren. Gezien de definitie van denaturatie, wat zegt deze verklaring over de sterke punten van peptide banden in vergelijking met waterstofbanden?
- het getoonde beeld vertegenwoordigt een tetrapeptide.

- hoeveel peptidebindingen zitten er in dit molecuul?
- Identificeer de zijgroepen van de vier aminozuren waaruit dit peptide bestaat.
