elektronegativiteit en Bindingspolariteit
hoewel we covalente binding gedefinieerd hebben als elektronendeling, worden de elektronen in een covalente binding niet altijd even gedeeld door de twee gebonden atomen. Tenzij de binding twee atomen van hetzelfde element verbindt, zal er altijd één atoom zijn dat de elektronen in de binding sterker aantrekt dan het andere atoom, zoals getoond in Figuur 4.3 “polaire versus niet-polaire covalente bindingen”. Wanneer een dergelijke onbalans optreedt, is er een resulterende opbouw van een negatieve lading (genoemd een gedeeltelijke negatieve lading en aangeduid δ−) aan de ene kant van de band en een positieve lading (aangeduid δ+) aan de andere kant van de band. Een covalente binding die een ongelijke verdeling van elektronen heeft, zoals in Deel (b) van figuur 4.3 “polaire versus niet-polaire covalente bindingen”, wordt een polaire covalente bondA covalente binding genoemd met een onevenwichtige elektronenverdeling over de binding.. Een covalente binding die een gelijke verdeling van elektronen heeft (Deel (A) van Figuur 4.3 “polaire versus niet-polaire covalente bindingen”) wordt een niet-polaire covalente bondA covalente binding genoemd met een evenwichtige elektronenverdeling over de binding..
figuur 4.3 polaire versus niet-polaire covalente bindingen
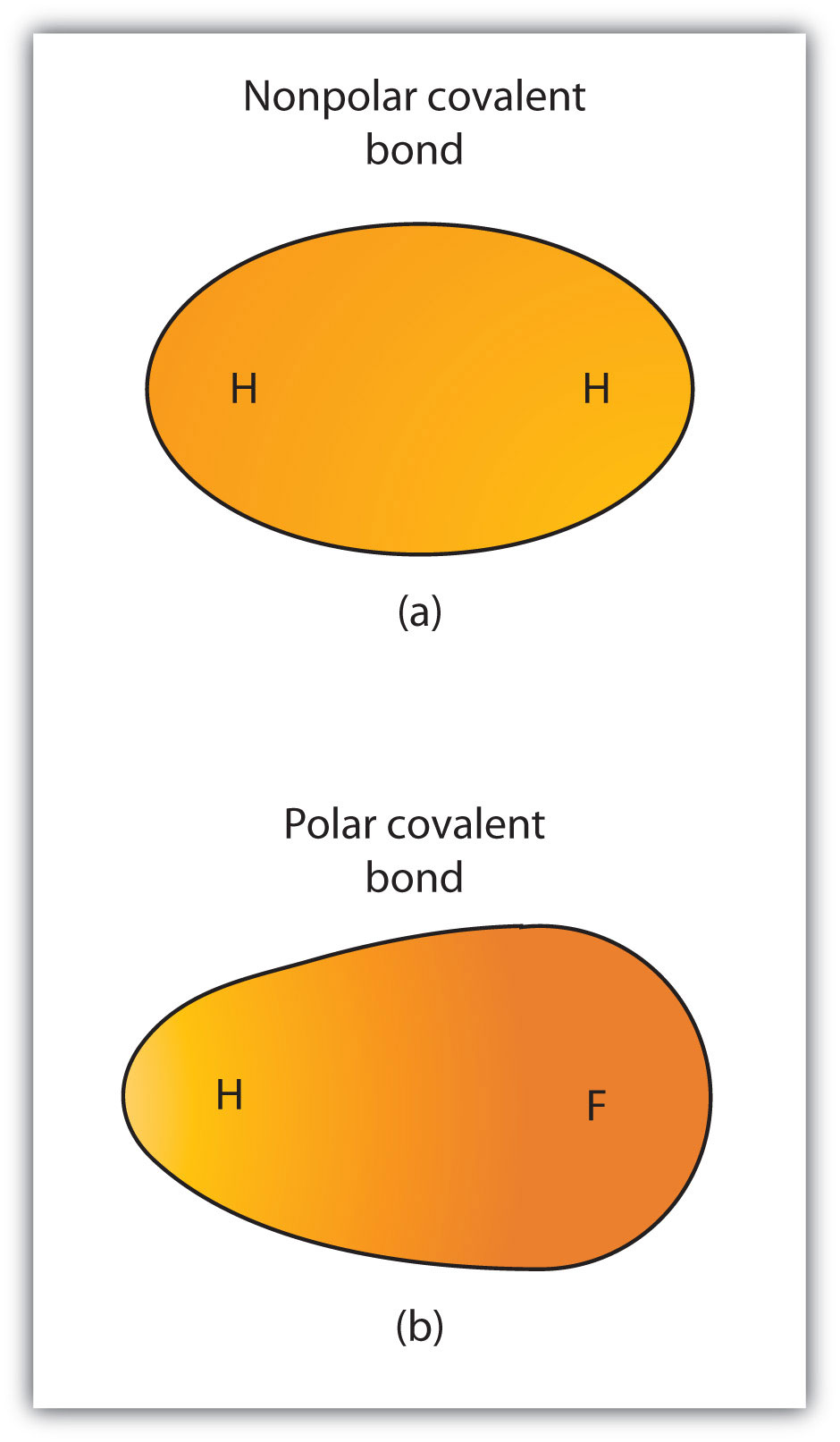
(a) de elektronen in de covalente bindingen worden gelijkelijk gedeeld door beide waterstofatomen. Dit is een niet-polaire covalente binding. (b) het fluor-atoom trekt de elektronen in de binding meer aan dan het waterstofatoom, wat leidt tot een onbalans in de elektronenverdeling. Dit is een polaire covalente binding.
elke covalente binding tussen atomen van verschillende elementen is een polaire binding, maar de mate van polariteit varieert sterk. Sommige bindingen tussen verschillende elementen zijn slechts minimaal polair, terwijl andere sterk polair zijn. Ionenbindingen kunnen worden beschouwd als de ultieme polariteit, waarbij elektronen worden overgedragen in plaats van gedeeld. Om de relatieve polariteit van een covalente binding te beoordelen, gebruiken chemici elektronegativitya relatieve maat van hoe sterk een atoom elektronen aantrekt wanneer het een covalente binding vormt. dat is een relatieve maat voor hoe sterk een atoom elektronen aantrekt wanneer het een covalente binding vormt. Er zijn verschillende numerieke schalen voor het beoordelen van elektronegativiteit. Figuur 4.4 “Electronegativities of Various Elements” toont een van de meest populaire—De Pauling schaal. De polariteit van een covalente binding kan worden beoordeeld door het verschil in de elektronegativiteit van de twee atomen die de binding maken te bepalen. Hoe groter het verschil in elektronegativiteit, hoe groter de onbalans van het delen van elektronen in de binding. Hoewel er geen harde en snelle regels zijn, is de algemene regel dat als het verschil in elektronegativiteit kleiner is dan ongeveer 0,4, de binding als niet-polair wordt beschouwd; als het verschil groter is dan 0,4, wordt de binding als polair beschouwd. Als het verschil in elektronegativiteit groot genoeg is (over het algemeen groter dan ongeveer 1,8), wordt de resulterende verbinding eerder als ionisch dan als covalent beschouwd. Een elektronegativiteitsverschil van nul wijst natuurlijk op een niet-polaire covalente binding.
Figuur 4.4 elektronegativiteit van verschillende elementen
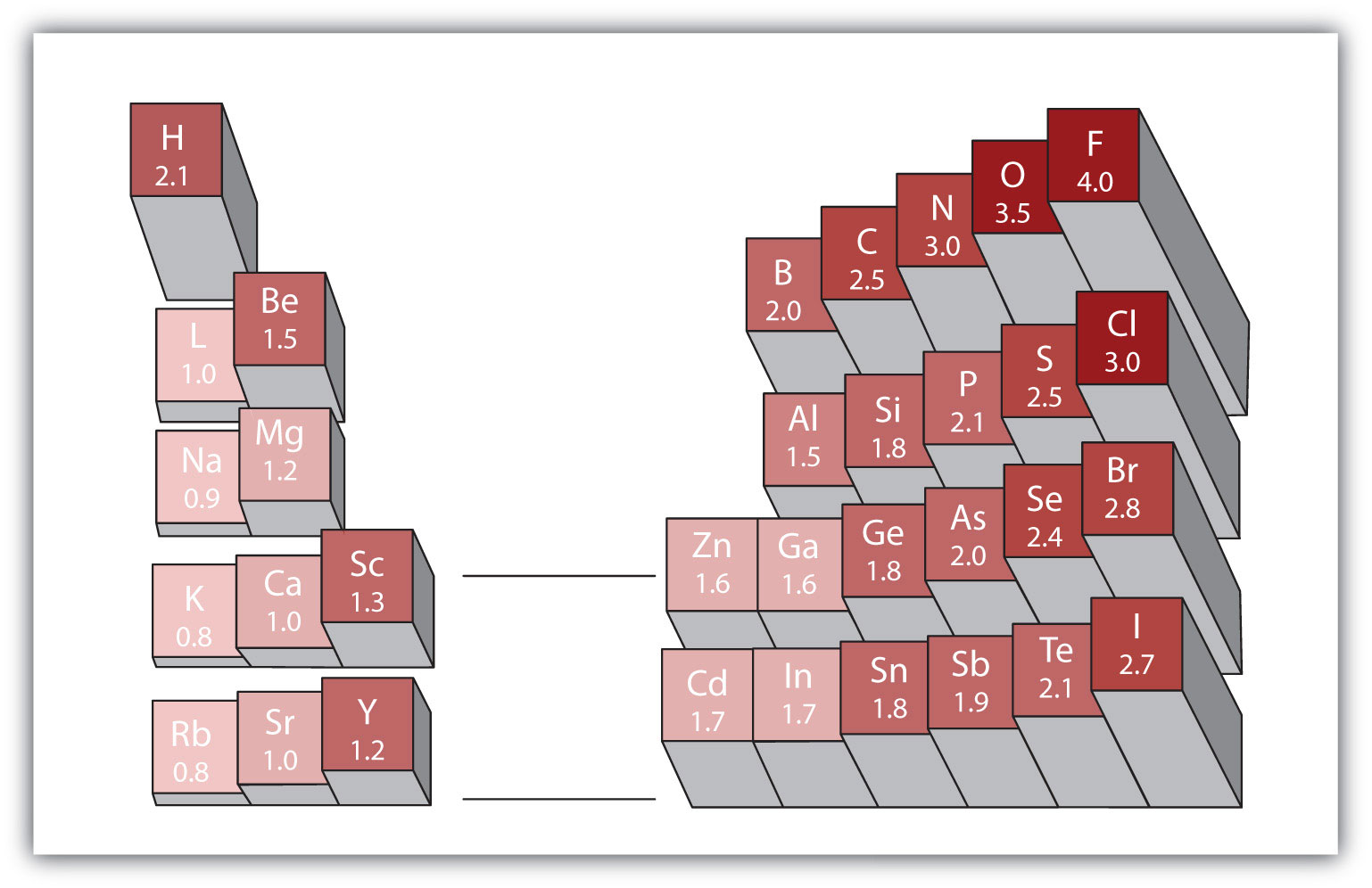
een populaire schaal voor elektronegativiteit heeft de waarde voor fluoratomen ingesteld op 4.0, de hoogste waarde.Linus Pauling (1901-94) is waarschijnlijk de meest invloedrijke chemicus van de 20e eeuw, Linus Pauling (1901-94) is de enige persoon die twee individuele (dat wil zeggen niet gedeelde) Nobelprijzen heeft gewonnen. In de jaren 1930 gebruikte Pauling nieuwe wiskundige theorieën om enkele fundamentele principes van de chemische binding uit te drukken. Zijn boek The Nature of the Chemical Bond uit 1939 is een van de belangrijkste boeken ooit gepubliceerd in de chemie.in 1935 richtte Paulings interesse zich op biologische moleculen en in 1954 kreeg hij de Nobelprijs voor de Scheikunde voor zijn werk over eiwitstructuur. (Hij was zeer dicht bij het ontdekken van de dubbele helix structuur van DNA toen James Watson en James Crick hun eigen ontdekking van de structuur in 1953 aankondigden. In 1962 kreeg hij de Nobelprijs voor de Vrede voor zijn inspanningen om het testen van kernwapens te verbieden.in zijn latere jaren raakte Pauling ervan overtuigd dat grote doses vitamine C ziekten, waaronder verkoudheid, zouden voorkomen. Het meeste klinische onderzoek kon geen verband aantonen, maar Pauling bleef dagelijks grote doses innemen. Hij stierf in 1994, na een leven lang een wetenschappelijke erfenis te hebben opgebouwd die weinigen ooit zullen evenaren.

Linus Pauling was een van de meest invloedrijke chemici van de 20e eeuw.
Voorbeeld 6
beschrijf het elektronegativiteitsverschil tussen elk paar atomen en de resulterende polariteit (of bindingstype).
- C en H
- h en H
- Na en Cl
- o en H
oplossing
- koolstof heeft een elektronegativiteit van 2,5, terwijl de waarde voor waterstof 2,1 is. Het verschil is 0,3, wat vrij klein is. De C-H-binding wordt daarom als niet-polair beschouwd.
- beide waterstofatomen hebben dezelfde elektronegativiteitswaarde—2.1. Het verschil is nul, dus de binding is niet-polair.
- de elektronegativiteit van natrium is 0,9, terwijl de elektronegativiteit van chloor 3,0 is. Het verschil is 2,1, wat vrij hoog is, en zo vormen natrium en chloor een ionische verbinding.
- met 2,1 voor waterstof en 3,5 voor zuurstof is het elektronegativiteitsverschil 1,4. We zouden een zeer polaire binding verwachten, maar niet zo polair dat de O-H binding als ionisch wordt beschouwd.
oefening voor het opbouwen van vaardigheden
-
c en O
-
K en Br
-
n en N
-
Cs en F
beschrijf het elektronegativiteitsverschil tussen elk paar atomen en de resulterende polariteit (of bindingstype).
wanneer de bindingen van een molecuul polair, kan de molecule als geheel een ongelijke verdeling van last tonen, afhankelijk van hoe de individuele banden worden georiënteerd. Bijvoorbeeld, de oriëntatie van de twee O–H bindingen in een watermolecuul (figuur 4.5 “fysische eigenschappen en polariteit”) is gebogen: het ene uiteinde van de molecule heeft een gedeeltelijke positieve lading, en het andere uiteinde heeft een gedeeltelijke negatieve lading. Kortom, het molecuul zelf is polair. De polariteit van water heeft een enorme invloed op zijn fysische en chemische eigenschappen. (Bijvoorbeeld, het kookpunt van water is hoog voor zo ‘ n klein molecuul en is te wijten aan het feit dat polaire moleculen elkaar sterk aantrekken. Terwijl de twee c = O-bindingen in kooldioxide polair zijn, liggen ze tegenover elkaar en neutraliseren zo elkaars effecten. Aldus, zijn de koolstofdioxidemolecules niet-Polar globaal. Dit gebrek aan polariteit beïnvloedt sommige eigenschappen van kooldioxide. (Bijvoorbeeld, kooldioxide wordt een gas bij -77°C, bijna 200° lager dan de temperatuur waarbij water kookt.)
figuur 4.5 fysische eigenschappen en polariteit

de fysische eigenschappen van water en kooldioxide worden beïnvloed door hun polariteit.
Concept Review oefeningen
-
Wat is de naam voor de afstand tussen twee atomen in een covalente binding?
-
wat geeft de elektronegativiteit van een atoom aan?
-
welk type binding wordt gevormd tussen twee atomen als het verschil in elektronegativiteit klein is? Medium? Groot?
antwoorden
-
bindingslengte
-
elektronegativiteit is een kwalitatieve maat voor de mate waarin een atoom elektronen aantrekt in een covalente binding.
-
niet-polair; polair; Ionische
Key Takeaways
- covalente bindingen tussen verschillende atomen hebben verschillende bindingen.
- covalente bindingen kunnen polair of niet-polair zijn, afhankelijk van het elektronegativiteitverschil tussen de betrokken atomen.
oefeningen
-
welke is langer—een C–H-obligatie of een C-O-obligatie? (Zie tabel 4.2 “geschatte Obligatielengtes van enkele afzonderlijke obligaties”.)
-
welke is korter – een N-H-obligatie of een c-H-obligatie? (Zie tabel 4.2 “geschatte Obligatielengtes van enkele afzonderlijke obligaties”.)
-
een nanometer is 10-9 m. gebruikmakend van de gegevens in Tabel 4.2 “approximate Bond Lengths of Some Single Bonds” en Tabel 4.3 “Comparison of Bond Lengths for Single and Multiple Bindingen”, bepaal de lengte van elke binding in nanometers.
- een C–O binding
- een C=O binding
- een H–N band
- een C≡N band
-
Een angstrom (Å) is gedefinieerd als het 10-10 m. Met behulp van Tabel 4.2 “Geschatte Bond Lengtes van Enkele Obligaties” en Tabel 4.3 “Vergelijking van de Bond Lengtes voor Enkele en Meerdere Obligaties”, het bepalen van de lengte van elke bond in angström.
- Een C-C-obligatie
- a C = C-obligatie
- een n≡n-obligatie
- een H-O-obligatie
-
zie oefening 3. Waarom is de nanometereenheid nuttig als eenheid voor het uitdrukken van bindingslengtes?
-
zie Oefening 4. Waarom is de angstrom-eenheid nuttig als eenheid voor het uitdrukken van bindingslengtes?
-
bepaal aan de hand van figuur 4.4 “elektronegativiteit van verschillende elementen” welk atoom in elk paar de hogere elektronegativiteit heeft.
- H of C
- O of Br
- Na of Rb
- I of Cl
-
bepaal aan de hand van figuur 4.4 “elektronegativiteit van verschillende elementen” welk atoom in elk paar de lagere elektronegativiteit heeft.
- Mg of O
- S of F
- Al of Ga
- O of i
-
worden de elektronen gelijkelijk of ongelijk verdeeld over elke covalente binding? Indien ongelijk, naar welk atoom worden de elektronen sterker getrokken?
- Een C-O-binding
- een F-F-binding
- Een S-N-binding
- een I-Cl-binding
-
worden de elektronen gelijkelijk of ongelijk verdeeld over elke covalente binding? Indien ongelijk, naar welk atoom worden de elektronen sterker getrokken?
- Een C-C-obligatie
- een s-Cl-obligatie
- Een O-H-obligatie
- een H–H–obligatie
antwoorden
-
Een C-O-obligatie is langer.
-
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
De werkelijke bindingslengtes zijn zeer klein, zodat de nanometereenheid de expressie van de lengte gemakkelijker kan begrijpen.
-
- C
- O
- Na
- Cl
- ongelijk naar de O
- gelijkelijk
- ongelijk naar de N
- ongelijk naar de Cl
/ol>
