het gebruik van consistente terminologie binnen en tussen studies is van cruciaal belang om een efficiënt proefproces mogelijk te maken. CDISC standaarden zoals CDASH, SDTM, SEND En ADaM standaardiseren de te gebruiken structuren bij het verzamelen en indienen van gegevens, maar hoe zit het met de data waarden zelf?
Deze post geeft een overzicht van de gestandaardiseerde gecontroleerde terminologie van CDISC en hoe deze gebruikt moet worden om gegevens te verzamelen en in te dienen op een manier die proeven versnelt en cross-study analyse mogelijk maakt.
als u meer wilt lezen over CDISC-standaarden kunt u onze blogs lezen alles wat u moet weten over SDTM en inleiding tot CDISC-standaarden.
CDISC partner met NCI om gestandaardiseerde terminologie te definiëren
CDISC werkt samen met het National Cancer Institute (NCI) om consistentie in de terminologie in klinische studies te helpen brengen. Door middel van deze samenwerking is een standaard set van terminologie gedefinieerd en wordt elk kwartaal bijgewerkt, waardoor semantische consistentie tussen de studies. Met behulp van deze terminologie zal dezelfde informatie op dezelfde manier worden weergegeven in alle studies.
laten we een eenvoudig voorbeeld nemen-geslacht:
- moet Mannelijk worden weergegeven door “Mannelijk”,” Mannelijk”,” M “of”1”?
- Hoe moet iemand die interseksueel is worden opgenomen?
In dagen die verstreken zijn, kan deze informatie voor elk onderzoek op verschillende manieren zijn verzameld. De Terminologiestandaard van het CDISC NCI definieert nu dat de enige toegestane opties “F”, “M”, “U” en “ongedifferentieerd” zijn, en dat een persoon die interseksueel is moet worden geregistreerd als “ongedifferentieerd”. Je kunt zien hoe dit zeer eenvoudige voorbeeld het al veel gemakkelijker maakt om de onderliggende gegevens te begrijpen en gemakkelijk te segmenteren voor verschillende populaties in studies.
![]() Note
Note
FDA ‘ s data standards catalog verplicht nu om de gestandaardiseerde NCI terminologie te gebruiken voor alle nieuwe studies. Dit maakt het leven van een recensent veel gemakkelijker, omdat ze weten hoe ze de gegevens moeten interpreteren.

hoe wordt CDISC NCI terminologie gedefinieerd?
de tabel hieronder laat zien hoe de standaardterminologie van het geslacht wordt gedefinieerd.
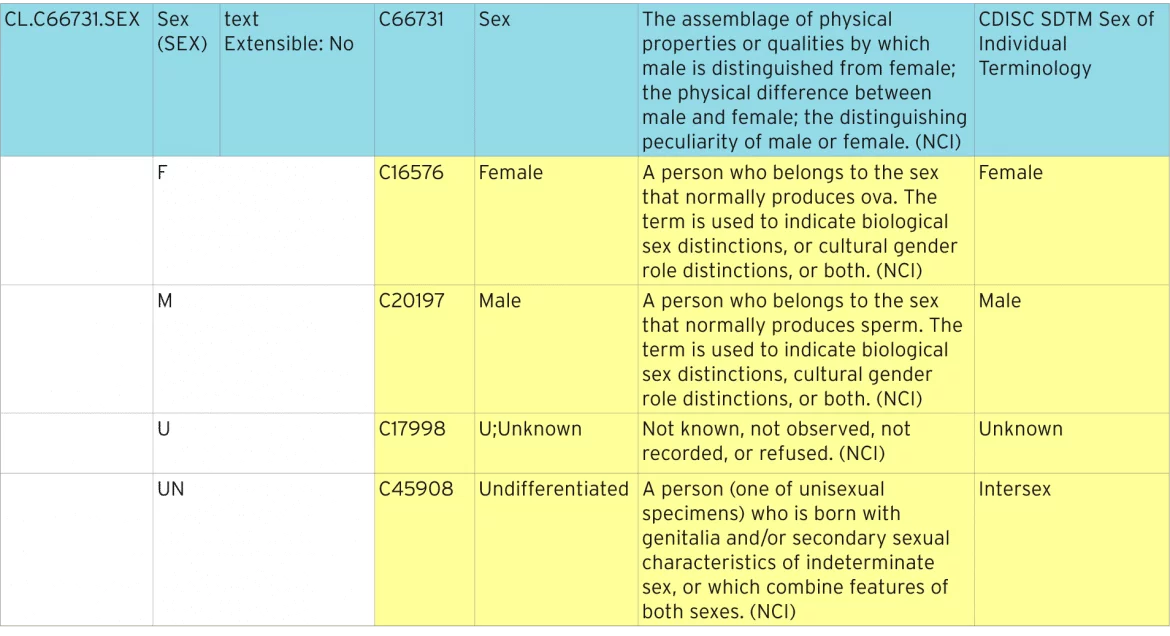
Identificatie van gestandaardiseerde terminologie
De blauwe lijn vertegenwoordigt de codelijst die alle afzonderlijke codes bevat. De codelijst heeft een standaard ” C-code “van”C66731”. Elk van de afzonderlijke codes heeft zijn eigen C-code, bijvoorbeeld “C16576”. Deze C-codes worden gebruikt in ODM en Define-XML metadata om codelijsten te identificeren als NCI-standaardterminologie.
uitbreidbaarheid
deze codelist wordt gedefinieerd als niet-uitbreidbaar, wat betekent dat waar de codelist ook wordt gebruikt, deze geen termen mag bevatten die hier niet zijn vermeld. Codelijsten die uitbreidbaar zijn, kunnen extra termen toevoegen. Deze aanvullende voorwaarden moeten worden beschreven in Define-XML als uitgebreide voorwaarden en kunnen niet worden gedupliceerd of Synoniemen van bestaande voorwaarden.
Indieningswaarde, synoniemen en voorkeursterm
De indieningswaarde moet bij een regelgever worden ingediend. De waarde die daadwerkelijk wordt weergegeven op een formulier kan anders zijn, en misschien een van de Synoniemen of de voorkeursterm.
beschikbaar in vele kleuren
de NCI Terminologienormen zijn beschikbaar in een aantal formaten om aan verschillende behoeften te voldoen, waaronder Excel, ODM, HTML en RDF. Het voorbeeld hierboven is ontleend aan de Excel-versie.
gegroepeerd in subsets voor cdas, SDTM, ADaM en meer
Voor het gemak is de NCI-terminologie gegroepeerd in een aantal subsets.
- SDTM terminologie bevat termen voor gebruik in een SDTM-gebaseerde indiening
- cdash terminologie bevat termen voor gebruik in cdash-gebaseerde gegevensverzameling
- ADaM terminologie bevat termen voor gebruik in ADaM datasets
- SEND terminologie bevat termen voor gebruik in een SEND-gebaseerde indiening
- Protocolterminologie bevat termen voor gebruik met het Protocol Representation Model (PRM) en Clinical Trial Registry XML (CTR-XML)
met behulp van CDISC NCI terminologie in een studie
bij het definiëren van metadata voor indiening in define-XML, worden codelijsten gebruikt om vaste lijsten te definiëren van waarden voor bepaalde variabelen. Volgens de huidige FDA regelgeving, moeten deze codelijsten voldoen aan de gestandaardiseerde CDISC NCI terminologie, waar dergelijke terminologie bestaat. Ze zijn gekoppeld aan de gestandaardiseerde terminologie door aliassen toe te voegen aan de C-codes, bijvoorbeeld:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
bij het definiëren van metagegevens over gegevensverzameling in ODM is het niet vereist om de gestandaardiseerde terminologie te gebruiken, maar als u dit doet, hoeft u termen niet in kaart te brengen van uw verzamelde gegevens naar uw ingediende gegevens. Dit vereenvoudigt uw end-to-end studieproces aanzienlijk en verhoogt de consistentie tussen de studies.
beheer van updates
beheer van terminologieupdates kan een aanzienlijke hoeveelheid werk zijn, vooral omdat de normen zo regelmatig worden bijgewerkt. Hoe weet u welke studies of organisatorische normen kunnen worden beïnvloed door nieuwe terminologie? Hoe maak je dan de vereiste updates op een efficiënte, betrouwbare manier?
de makkelijkste manier om dit te beheren is door gebruik te maken van een CDISC-bewuste metadata repository die je in staat stelt om organisatorische standaarden te definiëren die gebaseerd zijn op de gestandaardiseerde terminologie, en je studies op te bouwen van die standaarden. Als de repository begrijpt de relaties tussen alle normen en uw studies, het kan het proces van het bijwerken naar nieuwe versies van de CDISC NCI terminologie normen te vereenvoudigen.
