Introduction
cytotoxische cellen zijn integraal in de strijd tegen virale geïnfecteerde en kankercellen. Deze cellen doden door drie verschillende wegen, de versie van lytische korrels, FAS receptor-ligand weg, of de TRAIL–TRAIL receptor weg. In het kader van deze paper zullen we ons richten op degranulatie. Wanneer een cytotoxische cel een doelcel ontmoet, hecht het strak aan het die de immune synapse vormen. De lytische korrels worden dan gepolariseerd naar de immunologische synaps en vrijgegeven van de cytotoxische cel gericht naar het doel (1). Deze korrels bevatten diverse cytotoxische mediatoren zoals perforine en granzymes. Vrijgegeven perforin kan voorbijgaande poriën binnen het membraan van de doelcel vormen die granzymes toestaan om de doelcel in te gaan. De ingang wordt waarschijnlijk ook bemiddeld door perforin oligomers die onvolledige poriën vormen (bogen) (2), en men heeft ook voorgesteld dat granzymes en perforin in de doelcellen door de endosomal weg (3, 4) kunnen worden opgenomen. De gegevens achter deze voorgestelde mechanismen zijn onlangs uitvoerig besproken (5). Wanneer granzymes doelcellen ingaan wordt de weg caspase geactiveerd resulterend in apoptosis (6, 7). Het membraan van deze cytotoxische granules bevat lysosomaal-geassocieerd membraanglycoproteïne-1 (LAMP1), ook bekend als CD107a (8). Het luminale deel van rat CD107a wordt tijdelijk blootgesteld aan de extracellulaire kant van het celmembraan na degranulatie voordat het opnieuw wordt geïnternaliseerd. CD107a-kleuring geeft daarom aan dat er een degranulatie heeft plaatsgevonden (9). Terwijl de rol voor CD107a nog wordt bepaald, heeft siRNA-studies tegen CD107a aangetoond dat het essentieel is voor perforinehandel binnen de blaasjes, aangezien de levering van perforine aan lytische korrels wordt geremd in afwezigheid van CD107a (10). CD107a blijkt ook een rol te spelen bij het beschermen van cytotoxische cellen tegen de dood door binding aan perforine en het voorkomen van insertie in het celmembraan (11).
Er zijn twee belangrijke typen cytotoxische lymfocyten, natural killer cells (NK) en CD8 T-cellen. Beide celtypes doden door de versie van lytische korrels, de FAS receptor/FAS ligandweg en de TRAIL/TRAIL receptorweg, maar de stimulus die nodig is om deze twee celgroepen te activeren is verschillend. De cellen van T herkennen antigeen dat door MHC-klasse I molecules door hun activerende t-celreceptor (TCR) wordt voorgesteld, terwijl de cellen van NK doelcelantigenen hoewel diverse remmende en activerende receptoren erkennen. Remmende receptoren zijn belangrijk om te voorkomen dat NK-cellen gezonde cellen doden, terwijl het activeren van receptoren NK-celcytotoxiciteit induceert.
vóór de identificatie van CD107a als marker voor degranulatie in NK-cellen (12) was de output voor het meten van het cytotoxische vermogen de afsterving van de doelcellen. De opsporing van CD107a door cytometry stroom stond onderzoekers toe om de specifieke effectorcellen met cytotoxische capaciteit te identificeren. Sinds zijn ontdekking, is een brede waaier van publicaties van gegevens van muis en menselijke studies voltooid die het voordeel tonen om een anti-CD107a antilichaam te gebruiken. De rat is een waardevol immunologisch diermodel voor het bestuderen van ziekten zoals leukemie en graft vs. gastheerziekte (13), maar functionele uitlezingen zijn belemmerd door het gebrek aan Hoogte-de antilichamen van de kwaliteits specifieke anti-rat CD107a voor cytometry stroom. Dit document beschrijft de verwezenlijking van een antilichaam tegen rat CD107a en karakterisering van de degranulatiereactie in rat NK en CD8+ T cellen.
materialen en methoden
Dieren
Armeense inteelt hamsters (Cytogen Research and Development Inc., MA, USA) werden ondergebracht in de afdeling vergelijkende Geneeskunde van het Rikshospitalet, het Universitair Ziekenhuis van Oslo, in overeenstemming met de institutionele richtlijnen. De rattenstammen PVG-RT1U, PVG-RT7b, PVG-RT1N en PVG-R23 werden door elkaar gebruikt en gedurende meer dan 20 generaties onderhouden en gehuisvest in overeenstemming met de richtlijnen van de Experimental Animal Board Onder het Ministerie van Landbouw van Noorwegen en de Europese Conventie voor de bescherming van gewervelde dieren die voor experimentele en andere wetenschappelijke doeleinden worden gebruikt. Ratten werden gebruikt op de leeftijd van 8-12 weken. De proefdierfaciliteiten worden onderworpen aan een routine gezondheidsmonitoring programma en getest op infectieuze organismen volgens een wijziging van de Federation of European Laboratory Animal Science Association aanbevelingen. Dierproeven werden gereguleerd door middel van laboratoriumvoorschriften, die zijn neergelegd in de Animal Welfare act, waarin Noorwegen de EU laboratorium richting en de Europese laboratorium conventie volgt.
Abs en reagentia
antilichamen tegen Nkp46, NKR-P1A 3.2.3-PB, of unconjugated (binding only NKR-P1A, but not NKR-P1B, in the PVG strain), CD8 (OX8-biotine), CD2 (OX34, unconjugated), TCR (R73-Alexa647), mouse IGD B allototype (TIB96-unconjugated, used as mouse IgG isotype), en CD45.2 (His41-FITC, used as mouse IgG isotype) werden gemaakt in ons laboratorium en geconjugeerd volgens standaard protocollen. Antilichamen tegen CD3 (IF4, ongeconjugeerd) en het isotype muis IgM (MM-30, ongeconjugeerd) en Armeense hamster IgG isotype controle (HTK88-FITC) werden aangeschaft bij Biolegend (San Diego, CA, USA). Commerciële anti-CD107a antilichamen werden gekocht bij AbCam (Cambridge, UK) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor), en Lifespan (Seattle, WA, USA) (LS-C8580-unconjugated). LS-C8580 werd geconjugeerd met Alexa488 NHS ester (Sigma-Aldrich, St.Louis, MO, USA) voor gebruik in functionele tests. Anti-FLAG antilichaam (M2, unconjugated) en anti-muis IgG (goat polyclonal-FITC) werden gekocht bij Sigma-Aldrich (St.Louis, MO, USA). IL-2 werd verkregen uit een dialyseerde celkweek supernatant van een Chinese hamster ovarium (CHO) cellijn stabiel getransfecteerd met een rat IL-2 expressie construct. Peridinine chlorofyl-een eiwit (PerCP) geconjugeerde streptavidin, FITC hamster IgG polyclonal isotype control, FITC mouse IgG1 isotype control (MOPC-FITC), en GolgiStop werden gekocht van BD biosciences (Franklin Lakes, NJ, USA). Geit anti-Armeense hamster (polyclonal-FITC) werd gekocht van Jackson Immunoresearch (West Grove, PA, USA). Supernatanten van hybridomas OX41, CD172a (SIRPa), R73 (anti-rat TCRaß), OX19 (anti-CD5), OX12 (anti-Igk keten) en OX33 (anti-CD45RA) werden in eigen huis gemaakt. Controlehamsterserum werd afgeleid van niet-geïmmuniseerde Armeense hamsters.
klonen van rat CD107a
Rat CD107a werd PCR versterkt uit cDNA gegenereerd uit PVG rat splenocyten en gesubkloneerd tot een PMX expressie vector die een puromycine resistentie gen bevat (een gulle gift van Dr.Michael R. Daws) (14). CD107 primers werden ontworpen op basis van een rat CD107a (LAMP1) cDNA sequentie (GenBank: NM_012857). Forward primer: 5′-GCCCCAGCACTGTTCGAGGT-3′; Reverse primer: 5′-GTTGTTACCGTCCTGTACACACT-3′. Een anionisch trypsine – 1 leader peptide (MSALLILALVGAAVA) werd gebruikt in de expressievector, en het originele cd107 transmembraangebied werd vervangen door een CD8 transmembraanfragment om hoge oppervlakteuitdrukking te vergemakkelijken. Een vlag-markering (DYKDDDDK) werd geligated aan de N-terminal van de proteã ne CD107 om de oppervlakteuitdrukking detecteerbaar te maken. Alle ingevoegde opeenvolgingen en open lezingskader in de definitieve chimerische plasmideconstructie werden onderzocht en bevestigd door het rangschikken van Sanger DNA.
Transfecting BWZ.36 cellen met PMX-CD107a plasmide
293T-cellen werden ingezaaid in een celcultuurplaat met 6 boorputten met 4 ml RPMI 1640-medium, getransfecteerd met 7,5 µl FuGENE6-reagens (Roche, Protocol van de fabrikant) en geïncubeerd bij 37°C met 5% CO2. Het FuGENE6-reagens werd vooraf verdund met Opti-MEM (Gibco) en gemengd met 1,5 µg pMX-CD107a-plasmide en 1 µg pCL-ECO-knaagdierspecifieke retrovirale verpakkingsplasmide (Addgene #12371). Vierentwintig uur na de transfectie werd het supernatant gedecanteerd en vervangen door RPMI1640 medium met 2% FBS en overgebracht naar 32°C voor retrovirale productie. Achtenveertig uur later werd het supernatans geoogst en gefilterd met een 0,2 µm Filtropur s-filter (Sarstedt) en bewaard bij -80°C voor retrovirale transductie.
de 105 BWZ.36 cellen werden gezaaid per goed in een 24-well celkweekplaat (Corning) en gekweekt met vers rpmi1640 medium met 10% FBS, ‘ s nachts. Het supernatant werd verwijderd en RPMI1640 met 10% FBS, 16 µg polybrene (tot een uiteindelijke concentratie van 8 µg / ml) en 1,5 ml retroviraal supernatant werd toegevoegd en gecentrifugeerd bij 32°C bij 2400 rpm gedurende 2 uur. De cellen werden vervolgens gedurende 1 uur bij 32°C geïncubeerd, waarna het supernatant werd verwijderd en vervangen door vers rpmi1640 medium met 10% FBS en gedurende 3 dagen gekweekt, bij 37°C met 5% CO2 (op dag 2 kon een volledig medium met 1 ng/ml puromycine worden gebruikt). De uitgebreide BWZ. CD107a-vlag transfectanten werden onderzocht voor oppervlakteuitdrukking van de vlag-markering en toen werden gebruikt voor antilichaamimmunisatie of antilichaamonderzoek.
Cd107a genererende Transfectanten
De chimerische rat CD107a-plasmide werd getransfecteerd in CHO-cellen. Kort, werden CHO cellen gekweekt in volledig rpmi1640 medium (cRPMI; rpmi1640 medium met 10% FBS, 1mm na Pyruvate, 50µM 2-mercaptoethanol) totdat zij 30% samenvloeiing bereikten. Het 2,5 µg plasmide werd gemengd met 7,5 µl Fugene 6-reagens (Roche) en druppelsgewijs aan cellen toegevoegd. Twee dagen daarna werden de CHO-cellen losgemaakt met RPMI1640-medium aangevuld met 2mm EDTA en werden uitgezaaid in 96-wells platte bodemcelcultuurplaten (25 cellen/put) met selectiemedium (cRPMI aangevuld met 20 µg/ml puromycine) voor het klonen van stabiele transfectanten. Na 10-12 dagen kweek werden volwassen klonen gescreend met Anti-FLAG antilichaam (M2). Een van de klonen die het hoogste oppervlakteniveau van vlag en CD107a uitdrukken werd gebruikt voor inentingen.
immunisatie en Celfusie
de 3 tot 10 weken oude mannelijke Armeense inteelthamsters werden gedurende 3 weken eenmaal per week geïmmuniseerd door intraperitoneale injecties (i.p.) met 2 × 106 CHO.CD107a-FLAG cellen. Een boost met 4 × 106 stabiel getransfecteerde BWZ.CD107a-FLAG cellen werd i.p. 32 dagen na de eerste immunisatie gegeven en de sera werden geanalyseerd op oppervlaktekleuring van zowel CHO.CD107a-FLAG als BWZ.CD107a-FLAG transfectanten. Twee van de drie dieren waren positief en drie dagen na het boosten werden miltcellen geoogst en samengevoegd van de twee dieren, waarvan er één splenomegalie had. Ongeveer 2,0 × 108 miltcellen en 1,4 × 108 NS0 myeloomcellen werden driemaal gewassen in DMEM met additieven (1mm natriumpyruvaat, 0,05 mM 2-mercaptoethanol en antibioticum/antimycoticum) en gecentrifugeerd bij 90 g gedurende 10 minuten. Terwijl alles vanaf dit punt op 37°C werd gehouden, werd de pellet opgelost door op de buis te tikken en werd druppel voor druppel polyethyleenglycol 1500 (Roche) toegevoegd onder voorzichtig roeren gedurende 1 min. Drie milliliter dmem met toevoegingen werden geleidelijk toegevoegd voor de volgende 3 minuten afwerking met een extra 7 ml voordat gecentrifugeerd op 500 g. de pellet werd gewassen door voorzichtig spoelen (geen resuspensie) met dmem met additieven en 20% FBS (DMEM-20) en gekweekt ‘ s nachts. De cellen werden de volgende dag geoogst en 100 ml DMEM-20 met 2 × hypoxanthine–aminopterine–thymidine (SIGMA) en 10% hybridoma cloning supplement (HCS) (PAA) werd toegevoegd. De celsuspensie werd overgebracht naar 96-wells platen. Na 12 dagen, werden supernatants van het kweken van klonen getest door cytometry stroom voor het bevlekken van oppervlakteantigenen huidig op BWZ.CD107a-vlag en CHO.CD107a-vlag, maar niet op BWZ.36 cellen getransfecteerd met irrelevante FLAG-tagged antigenen als negatieve controles. De 9 van de 12 positieve klonen die specifieke antilichamen produceerden werden verder gesubkloneerd met DMEM-20 aangevuld met hypoxanthine-thymidine en HCS. Slechts één kloon (SIM1) produceerde nog antilichamen na subcloning en dit werd nog een keer gesubcloneerd. CD107a specifieke hamster IgG antilichamen werden gedetecteerd door FITC anti-Armeense hamster IgG (Jackson Immunoresearch). Anti-CD107a van het SIM1 hybridoom werd gezuiverd door HiTrap-eiwit G HP (GE Healthcare, Life Sciences) en FITC-geconjugeerd volgens standaardprocedures of Alexa488-geconjugeerd volgens het Protocol van de fabrikant.
generatie effectorcellen
eencellige suspensies werden bereid uit de milt. Lymfocyten werden geïsoleerd met behulp van een Lymphoprep gradiënt en vervolgens over een nylon wol kolom om B-cellen en macrofagen te verwijderen. Voor het genereren van IL-2-geactiveerde NK-cellen (LAK) werden de resterende cellen ‘ s nachts gekweekt in IL-2. De volgende dag werden niet-adherente cellen verwijderd door wassen met PBS en werden de adherente NK-cellen gehandhaafd in RPMI aangevuld met IL-2, 10% warmte geïnactiveerde FBS, 1% streptomycine/penicilline, 1mm natriumpyruvaat en 50 µM 2-mercaptoethanol. Cellen werden gedurende 8-10 dagen gecultiveerd. Voor het genereren van verrijkte NK-cellen of gesorteerde T-en NK-cellen werden cellen verrijkt door negatieve selectie na de nylon wolstap. Voor de verrijking van NK-cellen werden Pan-mouse IgG-Dynabeads (Invitrogen-Dynal) gecoat met antilichamen tegen macrofagen (OX41), T-cellen (R73 en OX19) en B-cellen (OX12 en OX33). Voor de verrijking van T-cellen werden IgG-Dynabeads van de pan-muis gekleurd met antilichamen tegen macrofagen (OX41) en B-cellen (OX12 en OX33). Cellen werden verrijkt door twee stappen van negatieve selectie met gekleurde parels gedurende 30 minuten bij 4°C. Verrijkte NK-cellen hadden een zuiverheid van ongeveer 50-60% en werden gebruikt voor degranulatiestudies. Verrijkte T-cellen (79-85% zuiverheid) werden verder gesorteerd voor TCR+ cellen met behulp van een FACS Aria (Bd Biosciences).
degranulatie Assays
om de degranulatierespons te meten door kleuring met anti-rat CD107a (SIM1) tijdens doelcelstimulatie werden NK-effectoren en YAC-doelcellen geïncubeerd in een 1 op 1 verhouding van 3 × 105 cellen / put (tenzij anders vermeld) in media die de SIM1 mAb, de andere in de handel verkrijgbare anti-CD107a-antilichamen of isotype-controle bevatten. Om de degranulatiereactie op antilichaamstimulatie van NK-cellen te meten, gebruikten we vlakke 96-wells platen met verschillende concentraties van anti-Nkp46 (Wen23), anti-NKR-P1A (3.2.3) en een muis IgG1 isotype controle (TIB96). De volgende dag werden platen gewassen met PBS en Geblokkeerd met cRPMI voordat toevoeging van 3 × 105 verrijkte NK-cellen gesuspendeerd in cRPMI bevattende SIM1 per putje werden toegevoegd. Om degranulation van T-cellen te meten, werden zij gesorteerd en gecultiveerd in cRPMI met IL-2 gedurende 2-3 dagen. De 96-wells vlakke bodemplaten werden ‘ s nachts bedekt met antilichamen tegen CD3 (IF4), CD2 (OX34), of een IgM isotype controle (MM-30). Ongeveer 3 × 105 T cellen werden toegevoegd per put in cRPMI die SIM1 bevatten. Alle analyses werden geïncubeerd voor 4 h. Golgistop werd toegevoegd voor laatste 3 h van incubatie om de degradatie van internalized CD107a te verhinderen. cellen werden toen gewassen en bevlekt met antilichamen naar de aangewezen oppervlakte receptoren en geanalyseerd gebruikend FACS Canto of LSR II (Biosciences van BD).
Chromium Release Assay
YAC-1 doelcellen (5 × 106 cellen/ml cRPMI) met toegevoegde 3.7 MBq51Cr werden gedurende 1 uur bij 37°C geïncubeerd, waarbij elke 15 minuten werd geroerd. Cellen werden vervolgens driemaal gewassen met PBS met 2% FBS en geresuspendeerd tot 1 × 105 cellen/ml in cRPMI. LAK effectorcellen en doelcellen werden geplateerd op de gespecificeerde verhoudingen in een eindvolume van 200 µl. De cellen werden gecentrifugeerd en gedurende 4 uur bij 37°C geïncubeerd. de specifieke afgifte van 51Cr werd gemeten met behulp van de Cobra auto-gamma (Packard).
resultaten
om een antilichaam tegen CD107a aan te maken, hebben we een expressievector gemaakt die het extracellulaire membraangebied van rat CD107a, het transmembraangebied van rat CD8 en een 3′-terminalvlag-tag bevat om oppervlakte-expressie te detecteren (figuur 1A). De vector werd getransfecteerd in CHO cellen en de BWZ.36 t-cellijn en gescreend op CD107a-expressie met behulp van een Anti-FLAG antilichaam (M2) (figuur 1B). CD107a stabiel getransfecteerde CHO-cellen werden eenmaal per week gedurende 3 weken geïnjecteerd in Armeense inteelt hamsters met een laatste boost van CD107a stabiel getransfecteerde BWZ-cellen 3 dagen voor fusie met de NS0 myeloom cellijn. Supernatants van de verschillende klonen werden getest op specificiteit in de richting van BWZ. CD107a-vlag, maar niet irrelevante BWZ-tags.36 transfectanten. Eén kloon, SIM1, bleek specifiek te binden aan de CD107a-expressie transfectant, maar niet aan de Flag transfected control (figuur 1C).

figuur 1. Generatie van een Anti-rat CD107a monoklonaal antilichaam (SIM1). (A) schematische vectorkaart van de PMX-expressievector met leader-peptide, FLAG-tag, cd107a-insert en het transmembraandomein van CD8. B) stabiel getransfecteerde Chinese hamster ovarium en BWZ.36 cellen werden getest op de expressie van het celoppervlak van CD107A met een VLAGGETIKET met een anti-vlag antilichaam (M2) (gearceerde histogrammen). Negatieve controle is secundair antilichaam alleen (transparant histogram). C) BWZ-cellen getransfecteerd met CD107a-vlag of irrelevant antigeen (NKR-P1F-vlag) werden gekleurd met hamstercontroleserum, SIM1 supernatant of een anti-vlag antilichaam (M2).
De kloon SIM1 werd verder getest in functionele assays parallel met twee in de handel verkrijgbare CD107a-antilichamen, die in flowcytometrie mogelijk kruisreageren met cd107a van de rat. De geteste antilichaamklonen waren H4a3 van AbCam (die kruis reageert met mens, rat, Muis, en primaten in cytometrie stroom) en de antilichaamkloon LS-C8580 van levensduur Biowetenschappen (die kruis reageert met CD107a van muis, mens en ratten in immunohistochemie en Westelijke vlekken volgens de website van de fabrikant). Onze SIM1 antilichaam kloon identificeerde degranulerende cellen in de aanwezigheid van doelcellen en toonde weinig achtergrondkleuring in de afwezigheid van doelen (bovenste paneel figuur 2A). Kloon H4A3 bevlekte het hoogste percentage NK-cellen na doelcelstimulatie (middenpaneel). Nochtans, was er ook een hoog niveau van achtergrondkleuring in de afwezigheid van doelcellen, die niet-specifieke band aangeeft. Zeer lage niveaus van degranulatie, indien aanwezig, werden gemeten door de LS-C8580 mAb kloon (onderste paneel). De specificiteit van deze antilichamen werd bevestigd door positieve kleuring van het BWZ.CD107a-FLAG transfectant, maar niet BWZ.NKR-P1F-VLAGBESTURING (figuur 2B). Het antilichaamkloon H4A3, waarvan is aangetoond dat het zich bindt aan menselijke CD107a (16), gaf geen vlekken op CD107a-getransfecteerde BWZ-cellen van de rat, wat erop wijst dat er geen kruisreactie is met cd107a van de rat. Unconjugated LS-C8580, anderzijds, toonde specifieke kleuring van cd107a transfected cellen (gegevens niet getoond). De LS-C8580 kloon is echter alleen beschikbaar als ongeconjugeerd antilichaam dat niet geschikt is voor degranulatiestudies. Herhaalde pogingen in ons laboratorium om LS-C8580 aan Alexa488 te vervoegen hebben helaas geen sterke bevlekkende conjugaten verstrekt, hoewel de kleine steekproefgrootte en de concentratie van LS-C8580 de oorzaak van de slechte vervoeging kunnen zijn. Geconjugeerde LS-C8580 toont verminderde maar specifieke kleuring van cd107a getransfecteerde cellen (figuur 2B), maar zoals getoond in Figuur 2A, waren we niet in staat om degranulerende cellen te detecteren tijdens functionele assays met dit conjugaat. Concluderend, de SIM1 mAb specifiek vlekken degranulerende rat NK cellen na stimulatie met doelcellen.

Figuur 2. SIM1 meet degranulation van natural killer (NK) en CD8 T cellen. (A) het percentage degranulerende cellen werd gemeten met anti-CD107a antilichamen SIM1, H4A3 en LS-C8580, met of zonder YAC-1 doelcellen als stimulus. Een representatief experiment van vier wordt getoond (B). Kleuring van de BWZ. CD107a-FLAG cellijn met SIM1, H4A3, LS-C8580 of ID48 antilichaam klonen. BWZ.36 cellen getransfecteerd met irrelevant FLAG-tagged antigeen (BWZ.NKR-P1G-FLAG) werd opgenomen als een negatieve controle, (C) verrijkte NK-cellen werden gestimuleerd met plaatgebonden anti-NKp46, anti-NKR-P1A of muis IgG1 als isotiecontrole, en SIM1 werd gebruikt om percentage degranulerende cellen te meten. NKp46 + (Wen23) of nkr-P1Abright (3.2.3) cellen werden afgesloten. (D) TCR+ cellen werden gesorteerd (zuiverheid 99%) en gekweekt in IL-2 gedurende 2-3 dagen. De cellen werden toen gestimuleerd met plaatgebonden anti-CD3 en anti-CD2 of muis IgM isotype controle voor anti-CD3. Het onderste paneel toont stimulatie met anti-CD3 en anti-CD2 en kleuring met een SIM1 isotype controle (FITC hamster IgG polyclonal). De cellen van T werden gesorteerd gebruikend R73-Alexa647 en 3.2.3-PB antilichamen, gating op R73 + / 3.2.3-cellen. De getoonde gegevens zijn afkomstig van één representatief experiment van drie afzonderlijke onafhankelijke experimenten.
directe stimulatie van activerende NK-receptoren via plaatgebonden antilichamen is een andere krachtige methode om degranulatie te induceren. Om de SIM1-kloon in deze functionele test te testen, incubeerden we verrijkte NK-cellen op platen gecoat met antilichamen tegen de activerende receptoren NKp46 en NKR-P1A (figuur 2C). Als negatieve controle werden platen gecoat met muis IgG1 isotype controle. Kleuring met het SIM1-antilichaam identificeerde 25,5 of 44% degranulerende cellen na stimulatie van NK-cellen in platen die respectievelijk bedekt waren met 5 µg/ml anti-NKp46 of anti-NKR-P1A. Het percentage degranulerende cellen nam nog verder toe wanneer de platen werden bedekt met een hogere concentratie stimulerende antilichamen (10 µg/ml). Er werd geen degranulatie geïnduceerd in putjes bedekt met de muis IgG1 isotype controle.
we zagen duidelijk degranulatie in NK-cellen gestimuleerd met doelcellen of met antilichamen tegen activeringsreceptoren door gebruik te maken van ons SIM1-antilichaam. We wilden dit ook bevestigen in cytotoxische T-cellen. T-cellen werden gesorteerd uit miltcellen en gekweekt in IL-2 gedurende 2-3 dagen. De T-cellen werden vervolgens gestimuleerd met plaatgebonden anti-CD3 en anti-CD2 (figuur 2D). Degranulatie werd gemeten van gekweekte CD8 + T-cellen wanneer gestimuleerd met anti-CD3 en anti-CD2 op zowel dag 2 als Dag 3. Er werd geen degranulatie gemeten van niet-cytotoxische CD4 T-cellen of na stimulatie met isotype-controleantilichaam, wat de specificiteit van ons SIM1-antilichaam verder aantoont.
Lymfokine-geactiveerde killer (LAK) cellen worden gecreëerd door NK-cellen in IL-2 gedurende 7-10 dagen te kweken en worden vaak gebruikt als zeer krachtige effectorcellen in chroomvrijgave-assays om cytotoxiciteit te bestuderen en moeten daarom hoge niveaus van degranulatie kunnen genereren. Om de degranulatie van LAK-cellen te meten, gebruikten we in eerste instantie een 1:1 verhouding van effector tot targets maar vond onverwacht lage niveaus van degranulatie (gegevens niet weergegeven). Nochtans, het doen van een titratie om optimale effector aan doelverhoudingen te vinden zagen wij stijgende niveaus van degranulation kunnen worden bereikt wanneer effector aan doelverhoudingen onder 1 waren (figuur 3A). De optimale verhouding voor degranulatie assays is daarom in tegenstelling tot cytotoxiciteits assays waar het niveau van cytotoxiciteit toeneemt met hogere effector: target ratio ‘ s (Figuur 3B).
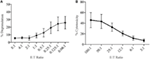
Figuur 3. Lage effector:doelverhoudingen zijn belangrijk om een adequate gevoeligheid bij degranulatietests met NK-cellen van ratten te garanderen. (A) degranulatie van LAK-cellen die 8-10 dagen in IL-2 zijn gekweekt tegen YAC-1-targets bij verschillende effector:target ratio ‘ s. (B) de cytotoxiciteit van IL-2 gekweekte LAK tegen YAC-1 doelcellen werd bevestigd met de chromium release assay voltooid op dag 8-10. Alle grafieken zijn cumulatief van drie of meer afzonderlijke experimenten met balken die SD tonen.
discussie
bij de eerste testen van SIM1 en de verschillende commerciële CD107a antilichamen in degranulatie assays bij de rat, kozen we een kleine range van effector naar target ratio ‘ s met een scheeftrekking naar meer effectorcellen dan targets gebaseerd op de huidige literatuur (12, 16, 17). Effector-doelcelratio ’s kunnen van papier tot papier verschillen, maar eerdere studies die effector-doelratio’ s getitreerd hebben, hebben aangetoond dat optimale degranulatie van muis-NK-cellen een piek bereikte bij 4,5: 1-verhouding met YAC – 1-doelcellen (18) en menselijke NK-cellen die k562-cellen gedood hebben bij een verhouding van 5:1 of 10:1 (12). Nochtans, wanneer het gebruiken van een grotere waaier van effector aan doelverhoudingen, tonen wij aan dat degranulation gebruikend rattenlakcellen effectiever werd veroorzaakt wanneer het gebruiken van vier of meer doelstellingen per effectorcel. Dit verschil in optimale effector: doelverhouding tussen de rat en andere species zou toe te schrijven aan het type van gebruikte doelcellen kunnen zijn, aangezien de menselijke en muiseffector aan doelverhouding titraties in de bovengenoemde studies doelcellen gebruikten die uit dezelfde species voortkwamen. De effectorcellen kunnen gevoeliger zijn voor doelcellen van dezelfde species en hebben daarom minder doelcellen nodig om geactiveerd te worden. De YAC-1 cellijn gebruikt in onze studie is een muis T cellymfoom, die de standaard voor vele jaren om cytotoxiciteit van rat NK cellen te stimuleren. We kunnen niet uitsluiten dat het gebruik van een rattendoelcel zou resulteren in sterkere stimulatie van de NK-cellen en vervolgens minder doelcellen nodig zouden kunnen zijn om degranulatie te induceren.
Het is ook duidelijk uit deze studie dat de effector / target ratio ’s die gebruikt worden voor cytotoxiciteitstesten niet goed correleren met de ratio’ s die nodig zijn om de optimale degranulatie respons in de effectorcellen te meten. Dit is niet verwonderlijk aangezien de lezing voor deze twee analyses verschillend is, met cytotoxicity die de dood van de doelcel meten, en degranulation die de NK-reactie op doelstellingen meten.
samenvattend hebben we een antilichaam tegen cd107a (SIM1) van de rat verhoogd en zijn vermogen om degranulatie in cytotoxische lymfocyten bij de rat te detecteren gekarakteriseerd. We hebben aangetoond dat SIM1 specifiek is voor degranulerende cellen, en door optimalisatie van het degranulation protocol, hebben we vastgesteld dat met behulp van effector:target cell ratio ‘ s lager dan 1:4 zorgen voor een optimale stimulatie van LAK cellen. De ontwikkeling van anti-rat CD107a (SIM1) maakt een betere analyse en karakterisering van de cytotoxische reacties van rattenlymfocyten mogelijk en zal een waardevol instrument zijn in de vele ziektemodellen van de rat.
ethische verklaring
het onderzoek is goedgekeurd door de National Animal Research Authority (FDU), Noorwegen (vergunningsnummer: ID-1698).
Auteursbijdragen
zoals verantwoordelijk is geweest voor de expressieanalyse, functionele assays en het schrijven van het manuscript. K-ZD heeft het cDNA klonen en de generatie van transfectanten uitgevoerd. JTV is betrokken geweest bij de projectplanning en-begeleiding, en bij het schrijven van het manuscript. LK is verantwoordelijk geweest voor immunisaties, de hybridoma technologie, het schrijven van het manuscript en project supervisie.
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.de auteurs danken Ulla Heggelund en Stine Martinsen voor technische bijstand in het laboratorium, en het personeel van de dierenkliniek van de afdeling vergelijkende Geneeskunde van Rikshospitalet, het universiteitsziekenhuis van Oslo voor hulp bij immunisaties. Met dank aan Marit Inngjerdingen voor wetenschappelijke discussies.
financiering
het onderzoek werd gefinancierd door de Universiteit van Oslo, South-Eastern Norway Regional Health (2009104), en Legatet til Henrik Homans Minde.
1. Oranje JS. Vorming en functie van de lytische NK-cel immunologische synaps. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038 / nri2381
PubMed Abstract | CrossRef Full Text/Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Perforine poriën in het endosomale membraan leiden tot de versie van endocytose granzyme B in het cytosol van doelcellen. Nat-Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Abstract / CrossRef Full Text / Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforine en granzymes: functie, dysfunctie en menselijke pathologie. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT, et al. Een tweede profylactische MHC-mismatched beenmergtransplantatie beschermt tegen rat acute myeloïde leukemie (BNML) zonder dodelijke graft-versus-host ziekte. Transplantatie (2008) 85(1):102-11. doi: 10.1097 / 01.tp.0000296856.53493. 1 f
PubMed Abstract / CrossRef Full Text / Google Scholar
14. Onishi M, Kinoshita S, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Toepassingen van retrovirus-bemiddelde uitdrukking het klonen. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Verminderde degranulatie van NK-cellen bij patiënten met vaak terugkerende herpes. Clin Vaccin Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstract / CrossRef Full Text / Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO, et al. Functionele analyse van menselijke NK cellen door cytometrie stroom. Methods Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
