
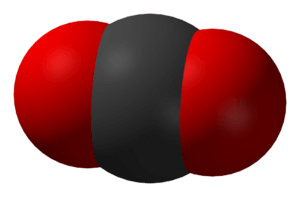
kooldioxide (CO2) is een chemische verbinding. Het is een gas bij kamertemperatuur. Het is gemaakt van één koolstof en twee zuurstofatomen. Mensen en dieren geven kooldioxide vrij als ze uitademen. Ook, elke keer als iets organisch wordt verbrand (of een vuur wordt gemaakt), maakt het kooldioxide. Planten gebruiken kooldioxide om voedsel te maken. Dit proces heet fotosynthese. De eigenschappen van kooldioxide werden bestudeerd door de Schotse wetenschapper Joseph Black in de jaren 1750.
kooldioxide is een broeikasgas. Broeikasgassen vangen warmte-energie. Broeikasgassen veranderen het klimaat en het weer op onze planeet, de aarde. Dit heet klimaatverandering. Broeikasgassen zijn een oorzaak van de opwarming van de aarde, de stijging van de temperatuur van het aardoppervlak.
biologische rol
kooldioxide is een eindproduct in organismen die energie verkrijgen uit het afbreken van suikers, vetten en aminozuren met zuurstof als onderdeel van hun metabolisme. Dit is een proces dat cellulaire ademhaling wordt genoemd. Dit geldt voor alle planten, dieren, veel schimmels en sommige bacteriën. Bij hogere dieren, de kooldioxide reist in het bloed van de weefsels van het lichaam naar de longen waar het wordt uitgeademd. Planten nemen koolstofdioxide uit de atmosfeer op voor fotosynthese.
droogijs
droogijs, of vast koolstofdioxide, is de vaste toestand van CO2-gas onder -109,3 ° F (-78,5°C). Droogijs komt niet van nature op aarde voor, maar is door de mens gemaakt. Het is kleurloos. Mensen gebruiken droogijs om dingen koud te maken, en om drankjes bruisend te maken, grondeekhoorns te doden en wratten te bevriezen. De damp van droogijs veroorzaakt verstikking en uiteindelijk de dood. Voorzichtigheid en professionele hulp wordt aanbevolen wanneer droogijs in gebruik is.

bij gebruikelijke druk smelt het niet van een vaste stof naar een vloeistof, maar verandert het direct van een vaste stof naar een gas. Dit heet sublimatie. Het zal direct veranderen van een vaste stof in een gas bij elke temperatuur hoger dan extreem koude temperaturen. Droogijs sublimeert bij normale luchttemperatuur. Droogijs blootgesteld aan normale lucht geeft kooldioxide gas dat geen kleur heeft. Kooldioxide kan vloeibaar worden gemaakt bij druk boven 5,1 atmosferen.
koolstofdioxidegas dat uit droogijs komt is zo koud dat wanneer het zich vermengt met lucht het de waterdamp in de lucht afkoelt tot mist, wat lijkt op een dikke witte rook. Het wordt vaak gebruikt in het theater om de verschijning van mist of rook te creëren.
isolatie en productie
chemici kunnen kooldioxide uit koellucht verkrijgen. Ze noemen dit luchtdistillatie. Deze methode is inefficiënt omdat een grote hoeveelheid lucht moet worden gekoeld om een kleine hoeveelheid CO2 te onttrekken. Chemici kunnen ook verschillende chemische reacties gebruiken om koolstofdioxide te scheiden. Kooldioxide wordt gemaakt in de reacties tussen de meeste zuren en de meeste metaalcarbonaten. De reactie tussen zoutzuur en calciumcarbonaat (kalksteen of krijt) veroorzaakt bijvoorbeeld kooldioxide:
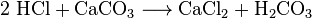
het koolzuur (H2CO3) ontbindt vervolgens in water en CO2. Dergelijke reacties veroorzaken schuimvorming of borrelen, of beide. In de industrie worden dergelijke reacties vaak gebruikt om afvalzuurstromen te neutraliseren.
ongebluste kalk (CaO), een chemische stof die wijdverbreid wordt gebruikt, kan kalksteen verhitten tot ongeveer 850 °C. Deze reactie veroorzaakt ook CO2:
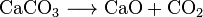
kooldioxide wordt ook gemaakt bij de verbranding van alle koolstofhoudende brandstoffen, zoals methaan (aardgas), aardoliedestillaten (benzine, diesel, kerosine, propaan), kolen of hout. In de meeste gevallen komt ook water vrij. Als voorbeeld is de chemische reactie tussen methaan en zuurstof:
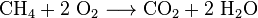
kooldioxide wordt gemaakt in staalfabrieken. Ijzer is verlaagd van het oxiden met cokes in een hoogoven, de productie van ijzer en koolstofdioxide:

Gist metaboliseert suiker te produceren koolstofdioxide en ethanol, ook wel bekend als alcohol, in de productie van wijnen, bieren en andere dranken, maar ook in de productie van bio-ethanol:
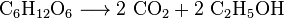
Alle aërobe organismen produceren CO2 als ze oxideren koolhydraten, vetzuren en eiwitten in de mitochondriën van de cellen. Het grote aantal reacties dat hierbij betrokken is, is buitengewoon complex en is niet gemakkelijk te beschrijven. (Ze omvatten cellulaire ademhaling, anaërobe ademhaling en fotosynthese). Photoautotrophs (d.w.z. planten, cyanobacteriën) gebruiken een andere reactie: planten absorberen CO2 uit de lucht, en, samen met water, reageren het om koolhydraten te vormen:
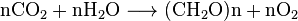
kooldioxide is oplosbaar in water, waarin het spontaan interconverteert tussen CO2 en H2CO3 (koolzuur). De relatieve concentraties van CO2, H2CO3 en de gedeprotoneerde vormen HCO−
3 (bicarbonaat) en CO2−
3(carbonaat) zijn afhankelijk van de zuurgraad (pH). In neutrale of licht alkalisch water (pH > 6.5), het bicarbonaat vorm overheerst (>50%) de meest voorkomende (>95%) op de pH van zeewater, terwijl in zeer alkalisch water (pH > 10.4) de overheersende (>50%) vorm is carbonaat. De bicarbonaat – en carbonaatvormen zijn zeer oplosbaar. Dus, lucht-equilibrated ocean water (mild alkalisch met typische pH = 8,2–8,5) bevat ongeveer 120 mg bicarbonaat per liter.
industriële productie
industriële kooldioxide wordt voornamelijk geproduceerd uit zes processen:
- door het opvangen van natuurlijke kooldioxidebronnen waar het wordt geproduceerd door de inwerking van aangezuurd water op kalksteen of dolomiet.
- als bijproduct van waterstofproductieinstallaties, waar methaan wordt omgezet in CO2;
- van de verbranding van fossiele brandstoffen of hout;
- als bijproduct van de vergisting van suiker bij het brouwen van bier, whisky en andere alcoholische dranken;
- afkomstig van thermische ontleding van kalksteen, CaCO3, bij het maken van kalk (calciumoxide, CaO);
chemische reactie
koolstofdioxide kan ontstaan door een eenvoudige chemische reactie:
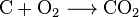 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of “dry ice”, a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

Pterapod shell opgelost in zeewater is aangepast aan een oceaan chemie voorspeld voor het jaar 2100.
-

overzicht van fotosynthese en ademhaling. Koolstofdioxide (rechts) vormt samen met water zuurstof en organische verbindingen (links) door fotosynthese, die kan worden uitgeademd naar water en (CO2).
-

stijgende CO2-niveaus bedreigden de Apollo 13-astronauten die patronen moesten aanpassen vanuit de commandomodule om de koolstofdioxide-scrubber in de maanmodule te leveren, die zij als reddingsboot gebruikten.
-

CO2 concentration meter using a nondispersive infrared sensor
