leerdoelen
- schrijf de chemische formule voor een eenvoudige ionische verbinding.
- herken polyatomische ionen in chemische formules.
We zijn al enkele chemische formules tegengekomen voor eenvoudige ionverbindingen. Een chemische formule is een beknopte lijst van de elementen in een verbinding en de verhoudingen van deze elementen. Om beter te begrijpen wat een chemische formule betekent, moeten we overwegen hoe een ionische verbinding wordt opgebouwd uit zijn ionen.
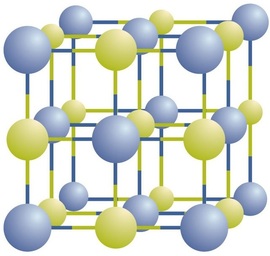
Ionverbindingen bestaan als afwisselende positieve en negatieve ionen in regelmatige, driedimensionale arrays die kristallen worden genoemd (figuur \(\Paginindex{1}\)). Zoals je kunt zien, zijn er geen individuele \(\ce{NaCl}\)” deeltjes ” in de array; in plaats daarvan is er een continu rooster van afwisselende natrium-en chloride-ionen. We kunnen echter de verhouding van natriumionen tot chlorideionen, uitgedrukt in de laagst mogelijke hele getallen, gebruiken als een manier om de verbinding te beschrijven. In het geval van natriumchloride is de verhouding van natriumionen tot chlorideionen, uitgedrukt in de laagste hele getallen, 1:1, dus gebruiken we \(\ce{NaCl}\) (één\ (\ce{Na}\) symbool en één\ (\ce{Cl}\) symbool) om de verbinding weer te geven. \(\Ce{NaCl}\) is dus de chemische formule voor natriumchloride, wat een beknopte manier is om het relatieve aantal verschillende ionen in de verbinding te beschrijven. Een macroscopisch Monster bestaat uit talloze NaCl-paren; elk individueel paar wordt een formuleeenheid genoemd. Hoewel het handig is om te denken dat\ (\ce{NaCl}\) kristallen zijn samengesteld uit individuele\ (\ce{NaCl}\) eenheden, geeft figuur\ (\Paginindex{1}\) aan dat geen enkel ion uitsluitend geassocieerd is met enig ander enkel ion. Elk ion is omgeven door ionen van tegengestelde lading.
De formule voor een ionische verbinding volgt verschillende conventies. Eerst wordt het kation voor het anion geschreven. Omdat de meeste metalen kationen vormen en de meeste niet-metalen anionen vormen, geven formules meestal eerst een lijst van het metaal en vervolgens van het niet-metaal. Ten tweede worden kosten niet in een formule geschreven. Vergeet niet dat in een ionische verbinding de samenstellende soorten ionen zijn, geen neutrale atomen, ook al bevat de formule geen ladingen. Ten slotte heeft de juiste formule voor een ionische verbinding altijd een netto nullastwaarde, wat betekent dat de totale positieve lading gelijk moet zijn aan de totale negatieve lading. Om de juiste formule van om het even welke combinatie van ionen te bepalen, bepaal hoeveel van elk ion nodig is om de totale positieve en negatieve ladingen in de verbinding in evenwicht te brengen.
deze regel is uiteindelijk gebaseerd op het feit dat materie over het algemeen elektrisch neutraal is.
aangenomen wordt dat er slechts één atoom is als er geen subscript aanwezig is. We gebruiken 1 niet als subscript.
als we kijken naar de ionische verbinding bestaande uit lithium− ionen en bromide-ionen, zien we dat het lithium-ion een 1+ lading heeft en het bromide-ion een 1-lading. Slechts één ion van elk is nodig om deze ladingen in evenwicht te brengen. De formule voor lithiumbromide is \(\ce{LiBr}\).
wanneer een ionische verbinding wordt gevormd uit magnesium en zuurstof, heeft het magnesiumion een 2+ lading en het zuurstofatoom een 2− lading. Hoewel beide ionen hogere ladingen hebben dan de ionen in lithiumbromide, balanceren ze elkaar nog steeds in een één-op-één verhouding. Daarom is de juiste formule voor deze ionische verbinding \(\ce{MgO}\).
overweeg nu de ionverbinding gevormd door magnesium en chloor. Een magnesiumion heeft een 2 + lading, terwijl een chloorion een 1-lading heeft:
\
door één ion van elk te combineren, worden de positieve en negatieve ladingen niet volledig in evenwicht gebracht. De eenvoudigste manier om deze ladingen te balanceren is om de aanwezigheid van twee chloride-ionen voor elk magnesiumion aan te nemen:
\
nu zijn de positieve en negatieve ladingen in evenwicht. We zouden de chemische formule voor deze ionische verbinding kunnen schrijven als \(\ce{MgClCl}\), maar de conventie is om een numerieke subscript te gebruiken als er meer dan één ion van een bepaald type is—\(\ce{MgCl2}\). Deze chemische formule zegt dat er één magnesiumion en twee chloride-ionen in deze formule zitten. (Lees het “Cl2” deel van de formule niet als een molecuul van het diatomaire elementair chloor. Chloor bestaat niet als diatomair element in deze verbinding. Het bestaat eerder als twee afzonderlijke chloride-ionen.) Volgens afspraak wordt de laagste gehele getalverhouding gebruikt in de formules van ionische verbindingen. De formule \(\ce{Mg2Cl4}\) heeft ladingen gebalanceerd met de ionen in een verhouding van 1:2, maar het is niet de laagste gehele getalverhouding.
voor verbindingen waarin de verhouding van ionen niet zo duidelijk is, kunnen de subscripten in de formule worden verkregen door ladingen te kruisen: gebruik de absolute waarde van de lading op een ion als subscript voor het andere ion. Deze methode is schematisch weergegeven in Figuur 3.3.2.
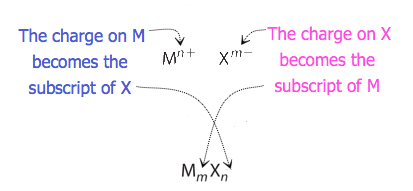
bij het overschrijden van lasten is het soms nodig om de subscripten tot hun eenvoudigste verhouding te reduceren om de empirische formule te schrijven. Denk bijvoorbeeld aan de verbinding gevormd door Pb4+ en O2−. Het gebruik van de absolute waarden van de ladingen op de ionen als subscripts geeft de formule Pb2O4. Dit vereenvoudigt tot de juiste empirische formule PbO2. De empirische formule heeft één Pb4 + ion en twee O2− ionen.
voorbeeld \(\Pagindex{1}\)
schrijf de chemische formule voor een ionische verbinding die bestaat uit elk paar ionen.
- het natriumion en het zwavelion
- het aluminiumion en het fluorideion
- het 3+ ijzerion en het zuurstofion
oplossing
- om een valentieschiloctet te verkrijgen, vormt natrium een ion met een 1+ lading, terwijl het zwavelion een 2− lading heeft. Twee natrium-1+ – ionen zijn nodig om de 2− lading op het zwavelion in evenwicht te brengen. In plaats van de formule als \(\ce{NaNaS}\) te schrijven, verkorten we deze bij overeenkomst tot \(\ce{Na2S}\).
- het aluminiumion heeft een 3 + lading, terwijl het fluoride-ion gevormd door fluor een 1− lading heeft. Drie fluor 1-ionen zijn nodig om de 3+ lading op het aluminium ion in evenwicht te brengen. Deze combinatie wordt geschreven als \(\ce{AlF3}\).
- ijzer kan twee mogelijke ionen vormen, maar het ion met een 3 + lading wordt hier gespecificeerd. Het zuurstofatoom heeft een 2-lading als ion. Om de positieve en negatieve ladingen in evenwicht te brengen, kijken we naar de kleinste gemene veelvoud—6: twee ijzer 3+ ionen geven 6+, terwijl drie 2− zuurstof ionen 6− geven, waardoor de totale positieve en negatieve ladingen in evenwicht worden gebracht. De formule voor deze ionische verbinding is dus \(\ce{Fe2O3}\). Bij wijze van alternatief kan de in Figuur 3.3.2 aangegeven methode voor het overschrijden van de ladingen worden gebruikt.
oefening \(\Paginindex{1}\)
schrijf de chemische formule voor een ionische verbinding die bestaat uit elk paar ionen.
- het calciumion en het zuurstofion
- het 2 + koperion en het zwavelion
- het 1 + koperion en het zwavelion
Antwoord A:
CaO
antwoord b:
CuS
antwoord c:
Cu2S
polyatomische ionen
sommige ionen bestaan uit groepen atomen die covalent met elkaar verbonden zijn en een totale elektrische lading hebben. Omdat deze ionen meer dan één atoom bevatten, worden ze polyatomische ionen genoemd. De Lewis structuren, namen en formules van sommige polyatomische ionen zijn te vinden in Tabel 3.3.1.
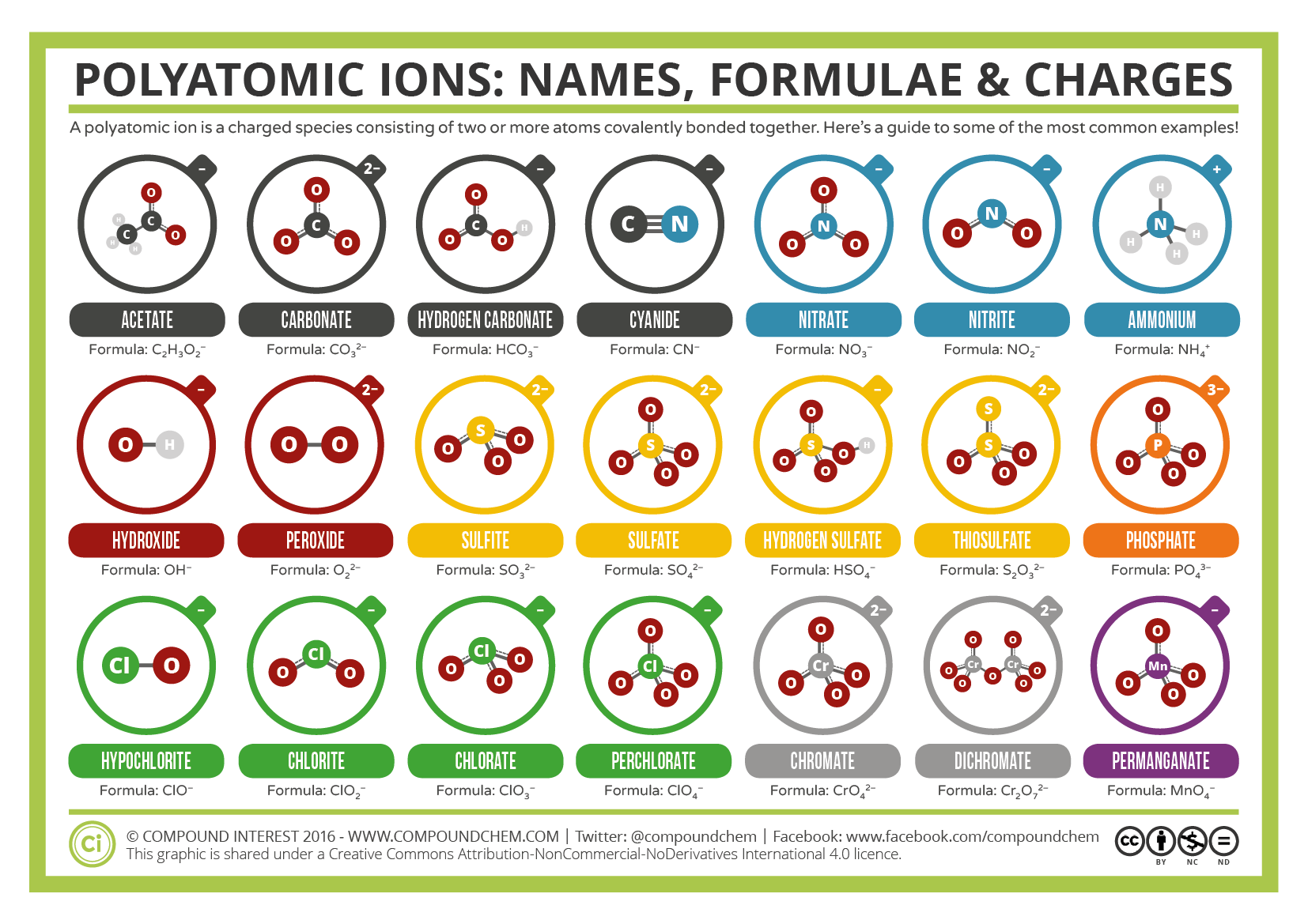
tabel \(\Paginindex{1}\): Sommige polyatomische ionen
polyatomische ionen hebben gedefinieerde formules, namen en ladingen die op geen enkele manier kunnen worden gewijzigd. Tabel \(\Paginindex{2}\) geeft een overzicht van de ion namen en ion formules van de meest voorkomende polyatomische ionen. Bijvoorbeeld, \(\ce{NO3^ { – }}\) is het nitraation; het heeft één stikstofatoom en drie zuurstofatomen en een totale 1− lading. Figuur \(\Paginindex{2}\) geeft de meest voorkomende polyatomische ionen weer.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. De overige polyatomische ionen zijn allemaal negatief geladen en worden daarom geclassificeerd als anionen. Echter, slechts twee van deze, het hydroxide ion en het cyanide ion, worden genoemd met behulp van de “-ide” achtervoegsel dat typisch indicatief is voor negatief-geladen deeltjes. De resterende polyatomische anionen, die allemaal zuurstof bevatten, in combinatie met een ander niet-metaal, bestaan als onderdeel van een reeks waarin het aantal zuurstofatomen binnen de polyatomische eenheid kan variëren. Zoals herhaaldelijk in verschillende delen van deze tekst is benadrukt, mogen geen twee chemische formules een gemeenschappelijke chemische naam hebben. Een enkel achtervoegsel, “- ide, ” is onvoldoende voor het onderscheiden van de namen van de anionen in een verwante polyatomaire reeks. Daarom worden”- ate “en” – ite ” achtervoegsels gebruikt om aan te geven dat de overeenkomstige polyatomische ionen deel uitmaken van een reeks. Bovendien, geven deze achtervoegsels ook het relatieve aantal oxygens aan die binnen de polyatomic ionen zijn vervat. Merk op dat alle polyatomische ionen waarvan de namen eindigen op “-ate” één meer zuurstof bevatten dan die polyatomische anionen waarvan de namen eindigen op “-ite.”Helaas, net als het gebruikelijke systeem voor het benoemen van overgangsmetalen, geven deze achtervoegsels alleen het relatieve aantal zuurstofatomen aan dat zich in de polyatomische ionen bevindt. Bijvoorbeeld, het nitraation, dat wordt gesymboliseerd als NO3−1, heeft één meer zuurstof dan het nitriet ion, dat wordt gesymboliseerd als NO2−1. Het sulfaation wordt echter gesymboliseerd als SO4-2. Terwijl zowel het nitraat-ion als het Sulfaat-ion een “- ate” achtervoegsel delen, bevat het eerste drie zuurstofatomen, maar het laatste bevat er vier. Bovendien bevatten zowel het nitraat-ion als het sulfiet-ion drie zuurstofatomen, maar deze polyatomische ionen hebben geen gemeenschappelijk achtervoegsel. Helaas, de relatieve aard van deze achtervoegsels verplicht dat de ion formule/Ion naam combinaties van de polyatomische ionen eenvoudig moet worden onthouden.
de regel voor het construeren van formules voor ionische verbindingen die polyatomische ionen bevatten is dezelfde als voor formules die monatomische (één-atoom) ionen bevatten: de positieve en negatieve ladingen moeten in evenwicht zijn. Als meer dan één van een bepaald polyatomisch ion nodig is om de lading te balanceren, moet de volledige formule voor het polyatomisch ion tussen haakjes worden ingesloten en wordt het numerieke subscript buiten de haakjes geplaatst. Dit is om aan te tonen dat het subscript van toepassing is op het gehele polyatomaire ion. Twee voorbeelden worden hieronder getoond:

voorbeeld \(\Paginindex{2}\)
schrijf de chemische formule voor een ionische verbinding die bestaat uit elk paar ionen.
- kaliumion en sulfaation
- calciumion en nitraation
- kaliumionen hebben een lading van 1+, terwijl sulfaationen een lading van 2−hebben. We hebben twee kaliumionen nodig om de lading op het sulfaation in evenwicht te brengen, dus de juiste chemische formule is \(\ce{K_2SO_4}\).
- calciumionen hebben een lading van 2+, terwijl nitraationen een lading van 1-hebben. We hebben twee nitraationen nodig om de lading op elk calciumion te balanceren. De formule voor nitraat moet tussen haakjes staan. Zo schrijven we \(\ce{Ca(NO3)2}\) als de formule voor deze ionische verbinding.
oplossing
oefening \(\Paginindex{2}\)
schrijf de chemische formule voor een ionische verbinding die bestaat uit elk paar ionen.
- het magnesium-ion en het carbonaat-ion
- de aluminium ion en de acetaat-ionen
Antwoord:
Mg2+ en CO32- = MgCO3
Antwoord b:
Al3+ en C2H3O2- = Al(C2H3O2)3
het Herkennen van Ionogene Verbindingen
Er zijn twee manieren om te herkennen ionogene verbindingen. Ten eerste zijn verbindingen tussen metalen en niet-metalen elementen meestal ionisch. Bijvoorbeeld, CaBr2 bevat een metallisch element (calcium, een groep 2A metaal) en een niet-metalen element (broom, een groep 7A niet-metalen). Daarom is het hoogstwaarschijnlijk een ionische verbinding. (In feite is het ionisch. De verbinding NO2 bevat daarentegen twee niet-metalen elementen (stikstof uit groep 5A en zuurstof uit groep 6A). Het is geen ionische verbinding; het behoort tot de categorie van covalente verbindingen elders bespreken. Merk ook op dat deze combinatie van stikstof en zuurstof heeft geen elektrische lading gespecificeerd, dus het is niet het nitriet ion.
ten tweede, als je de formule van een polyatomisch ion in een verbinding herkent, is de verbinding ionisch. Als je bijvoorbeeld de formule \(\ce{Ba(NO3)2}\) ziet, kun je het “NO3” gedeelte herkennen als het nitraat ion, \(\rm{NO_3^−}\). (Vergeet niet dat de conventie voor het schrijven van formules voor ionische verbindingen is niet om de Ionische lading op te nemen.) Dit is een aanwijzing dat het andere deel van de formule, \(\ce{Ba}\), eigenlijk het \(\ce{Ba^{2+}}\) ion is, waarbij de 2+ lading de totale 2− lading van de twee nitraationen uitbalanceert. Deze verbinding is dus ook ionisch.
voorbeeld \(\Paginindex{3}\)
Identificeer elke verbinding als ionisch of niet-ionisch.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{OF2}\)
oplossing
- natrium is een metaal en zuurstof is een niet-metaal; daarom wordt verwacht dat \(\ce{Na2O}\) Ionisch is.
- zowel fosfor als chloor zijn nietmetalen. Daarom is \(\ce{PCl3}\) niet ionisch.
- de \(\ce{NH4}\) in de formule vertegenwoordigt het ammoniumion, \(\ce{NH4^{+}}\), wat aangeeft dat deze verbinding ionisch is.
- zowel zuurstof als fluor zijn niet-metalen. Daarom is \(\ce{of2}\) niet ionisch.
oefening \(\Paginindex{3}\)
Identificeer elke verbinding als ionisch of niet-ionisch.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce {(NH4) 3PO4}\)
- \(\ce{SOCl2}\)
Antwoord A:
niet ionisch
antwoord b:
ionisch
antwoord c:
ionisch
antwoord d:
niet ionisch
nader kijken: bloed en zeewater
De wetenschap heeft lang erkend dat bloed en zeewater een vergelijkbare samenstelling hebben. Immers, beide vloeistoffen hebben ionische verbindingen opgelost in hen. De gelijkenis kan meer zijn dan louter toeval; veel wetenschappers denken dat de eerste levensvormen op aarde ontstonden in de oceanen. Een nadere blik toont echter aan dat bloed en zeewater heel verschillend zijn. Een 0,9% – oplossing van natriumchloride benadert de zoutconcentratie in het bloed. Zeewater is daarentegen hoofdzakelijk een 3% natriumchlorideoplossing, meer dan driemaal de concentratie in het bloed. Hier is een vergelijking van de hoeveelheden ionen in het bloed en zeewater:
| Ion | Procent in Zeewater | Procent in het Bloed |
|---|---|---|
| Na | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Dit verschil is significant omdat het waterstofcarbonaat-ion en sommige verwante ionen een cruciale rol spelen bij het beheersen van de zuur-base eigenschappen van bloed. De hoeveelheid waterstoffosfaationen – \(\ce{HPO4^{2−}}\) en \(\ce{H2Po4^{—}}\)-in zeewater is zeer laag, maar ze zijn in hogere hoeveelheden aanwezig in het bloed, waar ze ook de zuur-base-eigenschappen beïnvloeden. Een ander opmerkelijk verschil is dat bloed geen significante hoeveelheden sulfaat-ion (\(\ce{SO4^{2−}}\)), maar dit ion is aanwezig in zeewater.
Key Takeaways
- echte chemische formules voor ionverbindingen balanceren de totale positieve lading met de totale negatieve lading.
- groepen atomen met een totale lading, polyatomische ionen genoemd, bestaan ook.
oefeningen
-
welke informatie bevat de formule van een ionische verbinding?
-
waarom bevatten de chemische formules voor sommige ionverbindingen subscripten, terwijl andere niet?
3. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- Mg2+ en I−
- Na+ en O2−
4. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- Na+ en Br−
- Mg2+ en Br−
- Mg2+ en S2−
5. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- K+ en Cl−
- Mg2+ en Cl−
- Mg2+ en Se2−
6. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- Na+ en N3−
- Mg2+ en N3−
- Al3+ en S2−
7. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- Li+ en N3−
- Mg2+ en P3−
- Li+ en P3−
8. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- Fe3+ en Br−
- Fe2+ en Br−
- Au3+ en S2−
- Au+ en S2−
9. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- Cr3+ en O2−
- Cr2+ en O2−
- Pb2+ en Cl−
- Pb4+ en Cl−
10. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- Cr3+ en NO3−
- Fe2+ en PO43−
- Ca2+ en CrO42−
- Al3+ en OH−
11. Schrijf de chemische formule voor de ionische verbinding gevormd door elk paar ionen.
- NH4+ en NO3−
- H+ en Cr2O72−
- Cu+ en CO32−
- Na+ en HCO3−
12. Bepaal voor elk paar elementen de lading voor hun ionen en schrijf de juiste formule voor de resulterende ionische verbinding tussen hen.
- Ba en S
- Cs en I
13. Bepaal voor elk paar elementen de lading voor hun ionen en schrijf de juiste formule voor de resulterende ionische verbinding tussen hen.
- K en S
- Sc en Br
14. Welke verbindingen voorspelt u ionisch te zijn?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Welke verbindingen voorspelt u ionisch te zijn?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
antwoorden
1. de verhouding van elk type ion in de verbinding
2. Soms is meer dan één ion nodig om de lading op het andere ion in een ionische verbinding in evenwicht te brengen.
- MgI2
- Na2O
- NaBr
- MgBr2
- MGS
- KCL
- MgCl2
- mgse
- na3n
- mg3n2
- al2s3
- li3n
- mg3p2
- li3p
- febr3
- febr2
- au2s3
- au2s
- Cr2O3
- CRO
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- h2cr2o7
- cu2co3
- NaHCO3
- Ba2+, S2−, bas
- cs+, i−, CSI
- K+, S2−, K2s
- SC3+, br−, scbr3
- Ionische
- niet Ionogene
- Ionische
- niet Ionogene
- niet Ionogene
- niet Ionogene
- niet Ionogene
- niet Ionogene
- div>
- Ionische
niet ionische niet ionische - Ionische
niet ionische
- Ionische
