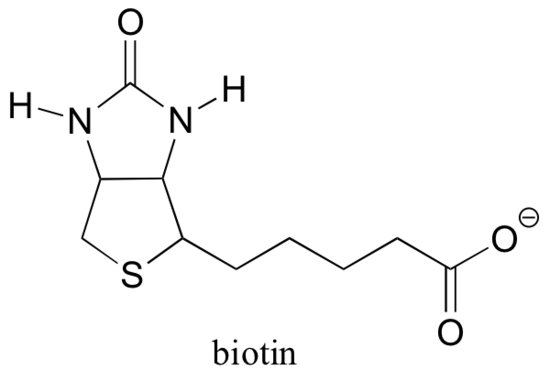
13.5 D: biotine is een CO2-dragend co – enzym
uit paragraaf 6.5 b komt naar voren dat veel enzymen afhankelijk zijn van de hulp van coenzymes, die kleine (ten opzichte van eiwit) organische moleculen zijn die-covalent of niet – covalent-binden in de actieve plaats van een enzym en deze helpen om zijn reactie te katalyseren. S-adenosylmethionine (SAM, paragraaf 9.1 A) en ATP (paragraaf 10.2) zijn twee voorbeelden die we tot nu toe hebben ontmoet, en we zullen er nog een aantal zien in de volgende hoofdstukken. Hoewel Rubisco (beschreven in Deel B van deze sectie) een uitzondering is, zijn de meeste enzymen die carboxylatiereacties katalyseren afhankelijk van een co-enzym genaamd biotine, dat als tijdelijke drager van kooldioxide dient.
Pyruvaatcarboxylase, het enzym dat de eerste stap van de gluconeogensis-route katalyseert, is een goed voorbeeld van een biotine-afhankelijke carboxyleringsreactie. Merk op dat het CO2 in deze reactie afkomstig is van bicarbonaat, in tegenstelling tot de Rubisco-reactie waarin CO2 direct uit de atmosfeer wordt ‘gefixeerd’.

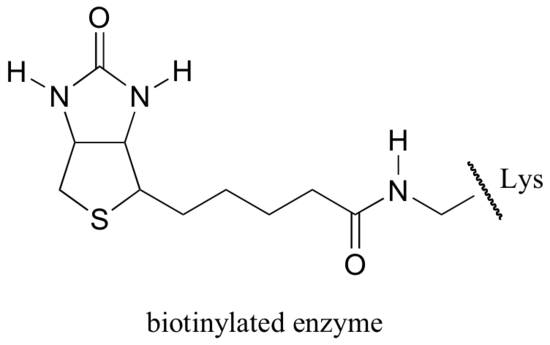
Biotine is covalent gebonden aan het enzym door een amideverbinding met een actieve lysine op de plaats.
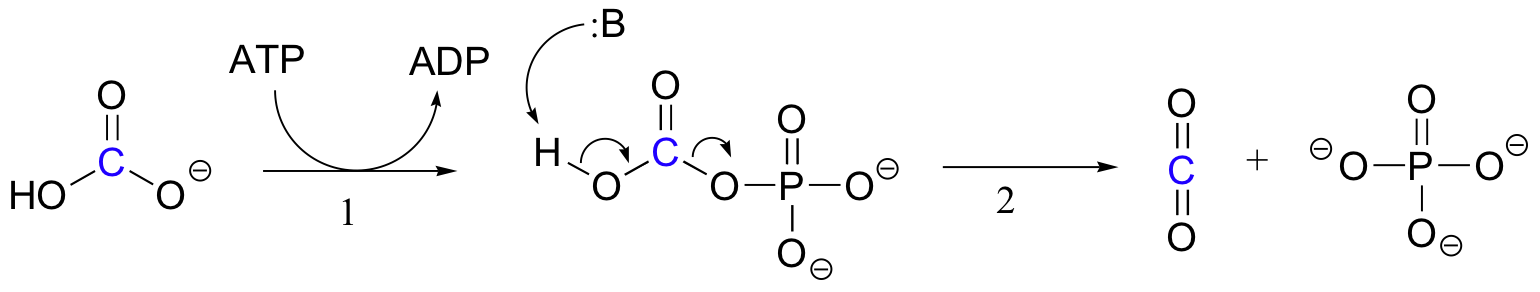
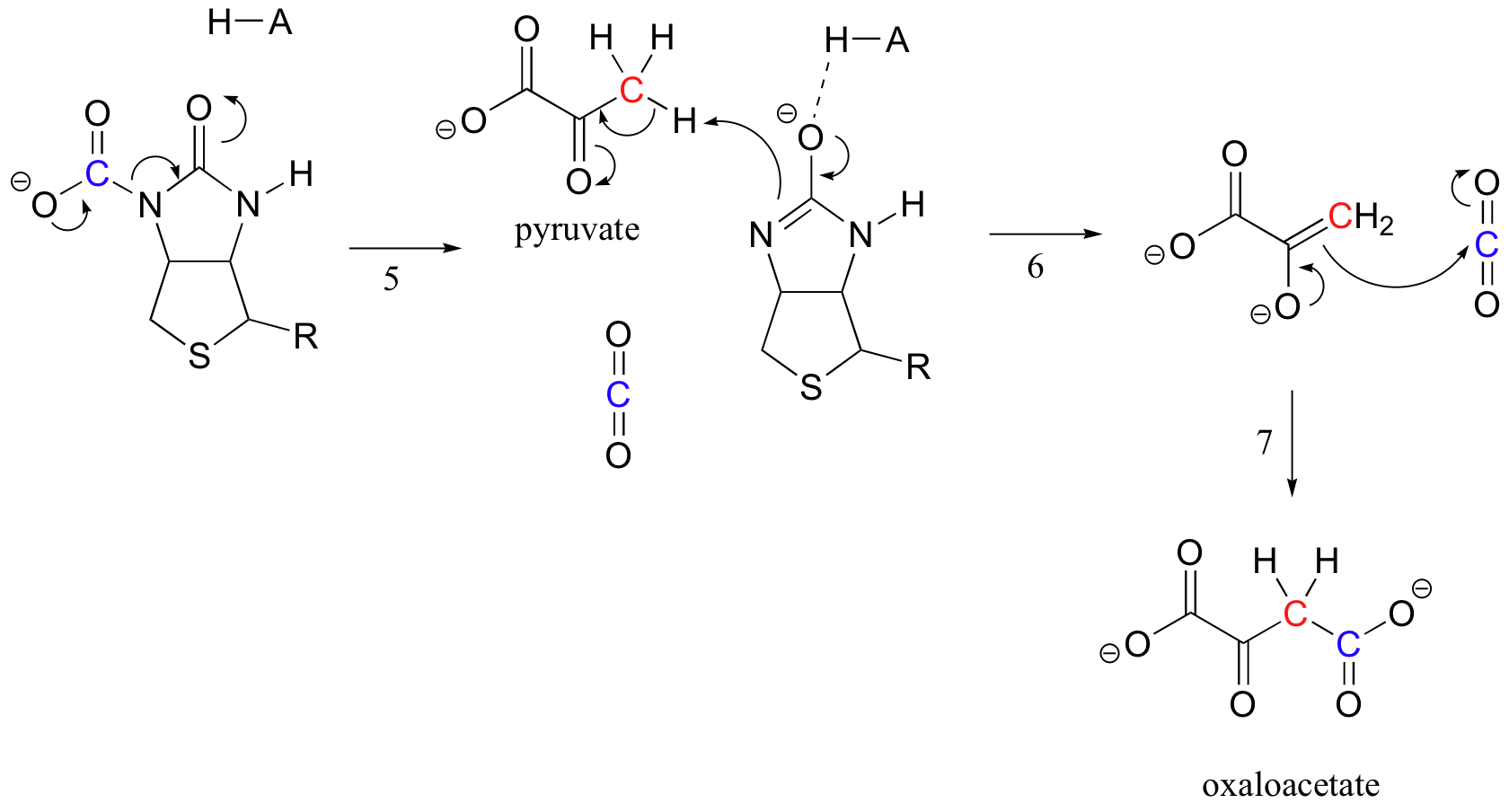
het exacte mechanisme waarmee biotine-afhankelijke carboxyleringsreacties werken is nog niet volledig begrepen, maar het volgende is een waarschijnlijk beeld. Ten eerste wordt het bicarbonaation gefosforyleerd door ATP (stap 1, zie paragraaf 10.2) en wordt het dus geactiveerd voor decarboxylering, die vrij CO2 genereert (stap 2).
biotine heeft als taak het koolstofdioxidemolecuul vast te houden totdat pyruvaat op de actieve plaats komt. Carboxylation van biotine impliceert deprotonation van de amidestikstof om een enolate-als tussenpersoon te vormen (stap 3 – amides hebben een pKa van ongeveer 17, en dit wordt verlaagd door de aanwezigheid van een actief plaatszuur dichtbij de zuurstof). Deze stap wordt gevolgd door aanval van de nucleofiele stikstof op kooldioxide om carboxybiotinylated enzym te vormen (stap 4).
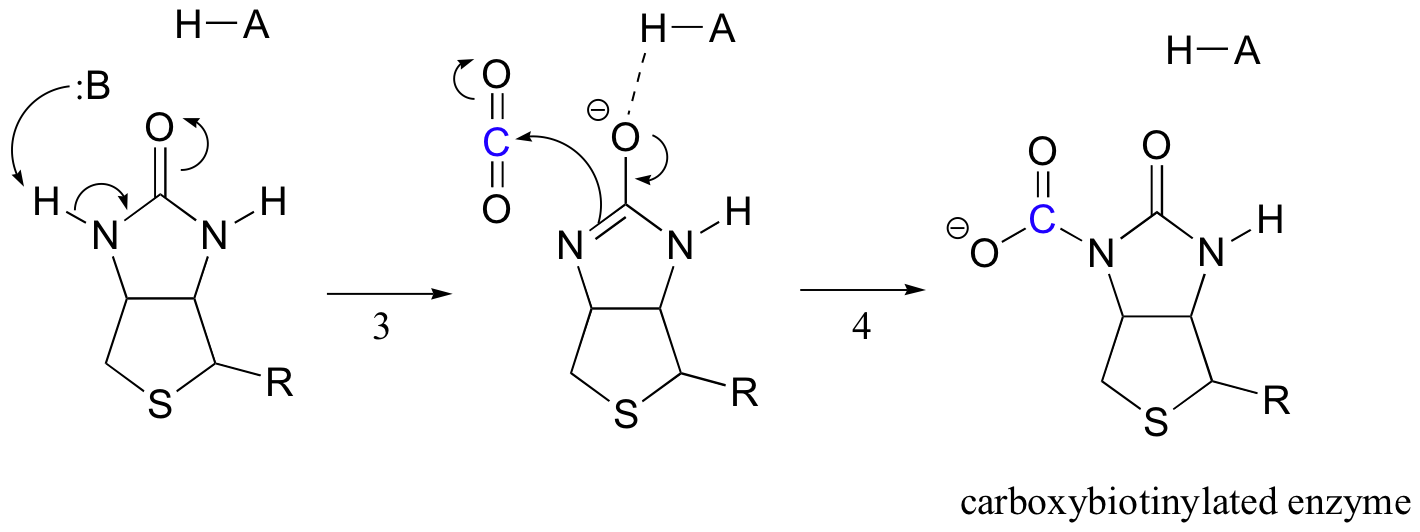
Wanneer een molecuul pyruvaat bindt, herschikking van de actieve site architectuur dat de vorige stap te gaan in omgekeerde richting (stap 5), waardoor de uitstoot van CO2 en het genereren van een biotine-base te deprotonate de alfa-koolstof van pyruvaat, zodat het kan condenseren, in een aldol-mode met CO2 vorm van oxaalacetaat (stappen 6-7).
Als u enige biochemie hebt bestudeerd, kunt u over biotine hebben gehoord in een iets andere context dan wat in deze paragraaf wordt besproken. Een eiwit genaamd avidin, in overvloed in eiwit wordt gevonden, bindt niet-covalent en uiterst strak aan biotine (in feite, is avidin-biotine het strakste eiwit-ligand bindende paar dat aan wetenschap wordt gekend). Biochemici maken vaak gebruik van deze eigenschap door covalent een biomolecule van belang te koppelen aan biotine. De ‘gebiotinyleerde’ soorten kunnen dan gemakkelijk uit een complex mengsel worden geïsoleerd door het mengsel door een ‘affiniteitskolom’ te laten lopen die met avidine is bedekt.
