Er zijn een aantal manieren waarop een cel van het ene punt in de ruimte naar het andere kan bewegen. In een vloeibaar medium, die methode kan een soort van zwemmen, gebruik te maken van ciliaire of flagellaire beweging om de cel voort te stuwen. Op vaste oppervlakken zullen deze mechanismen duidelijk niet efficiënt werken en ondergaat de cel een kruipend proces. In deze sectie, beginnen we met een bespreking van ciliaire/flagellaire beweging, en dan overwegen de meer gecompliceerde vereisten van cellulaire kruipen.
trilharen en flagella, die voornamelijk verschillen in lengte in plaats van constructie, zijn microtubule-gebaseerde organellen die bewegen met een heen-en-weer beweging. Dit vertaalt zich naar “roeien” door de relatief korte trilharen, maar in de langere flagella zorgt de flexibiliteit van de structuur ervoor dat de heen-en-weer beweging wordt gepropageerd als een golf, dus de flagellabeweging is meer golvend of zweepachtig (bedenk wat er gebeurt als je een tuinslang snel van links naar rechts kwispelt in vergelijking met een kort stuk van dezelfde slang). De kern van één van beide structuur wordt genoemd axoneme, die uit 9 microtubule doublets wordt samengesteld die met elkaar door ciliaire dynein motorproteã nen worden verbonden, en een centrale kern van twee afzonderlijke microtubules omringen.
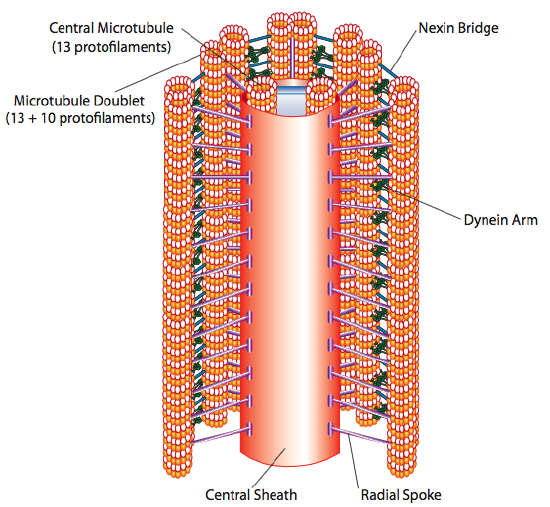
Dit is bekend als de” 9+2 ” formatie, hoewel de negen doublets niet hetzelfde zijn als de twee centrale microtubuli. De tubulus A is een volledig 13-protofilament, maar de tubulus B die ermee is gefuseerd bevat slechts 10 protofilamenten. Elk van de centrale microtubuli is een volledige 13 protofilamenten. Axoneme 9 + 2 breidt de lengte van cilium of flagellum uit van het uiteinde tot het de basis bereikt, en verbindt met het cellichaam door een basaal lichaam, dat uit 9 microtubule-triplets samengesteld is schikt in een kort vat, veel als centrioles waaruit zij worden afgeleid.
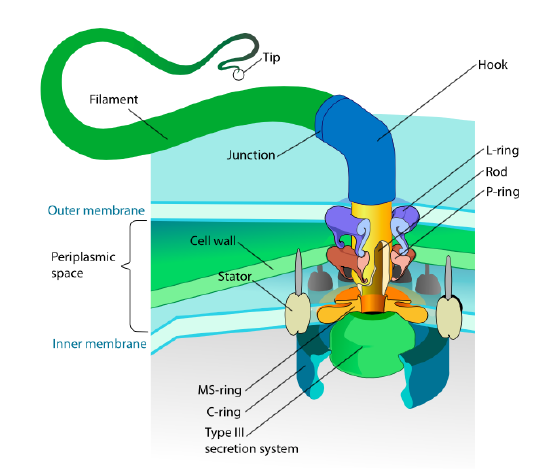
Deze sectie verwijst alleen naar eukaryoten. Sommige prokaryoten hebben ook beweeglijke aanhangsels die flagella worden genoemd, maar ze zijn volledig verschillend in zowel structuur als mechanisme. De flagella zelf zijn lange spiraalvormige polymeren van het eiwit flagellin en de basis van de flagellinvezels is verbonden met een rotatiemotoreiwit, geen translationele motor. Deze motor (figuur \(\Paginindex{18}\)) gebruikt ion (h+ of Na+ afhankelijk van de soort) langs een elektrochemische gradiënt om de energie te leveren om maar liefst 100000 omwentelingen per minuut te draaien. Men denkt dat de rotatie wordt gedreven door conformationele veranderingen in de statorring, genesteld in het celmembraan.
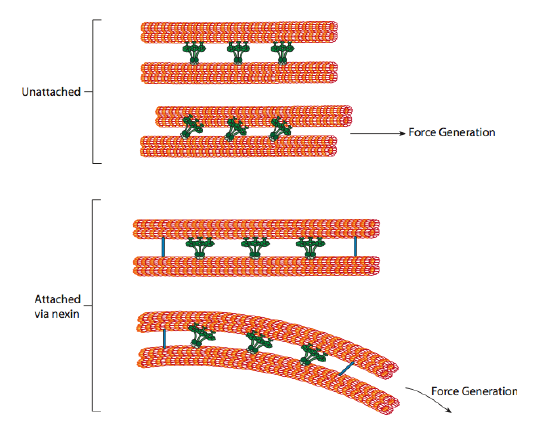
de ciliaire dyneïnen leveren het motorische vermogen, maar er zijn ook twee andere verbindingseiwitten in het axoneme. Er zijn knooppunten die de A-tubule van een doublet verbinden met de B-tubule van de aangrenzende doublet, waardoor de buitenste ring wordt verbonden. En er zijn radiale spaken die zich uitstrekken van de A tubule van elke doublet tot het centrale paar microtubuli in de kern van het axoneem. Geen van beide heeft een motorische activiteit. Echter, ze zijn cruciaal voor de beweging van trilharen en flagella, omdat ze helpen om een glijdende beweging te transformeren in een buigende beweging. Wanneer ciliary dynein (zeer gelijkend op cytoplasmic dyneins maar drie hoofden in plaats van twee heeft) in dienst is genomen, bindt het een A microtubule aan één kant, een B microtubule van het aangrenzende doublet, en beweegt één ten opzichte van andere. Een lijn van deze dyneins die in concert bewegen zou dus de ene doublet ten opzichte van de andere schuiven, als (en het is een grote “als”) de twee doublets volledige bewegingsvrijheid hadden. Echter, aangezien de doublets onderling verbonden zijn door de nexine eiwitten, wat er gebeurt als een doublet probeert te glijden is dat het in plaats daarvan de verbonden structuur buigt (figuur \(\Paginindex{17}\)). Deze bocht is goed voor de roeibeweging van de trilharen, die relatief kort zijn, evenals de zweepbeweging van de lange flagella, die de buigbeweging langs het axoneme propageren.
hoewel we denken aan ciliaire en flagellaire beweging als methoden voor de voortstuwing van een cel, zoals het flagellair zwemmen van sperma naar een ei, zijn er ook een aantal belangrijke plaatsen waar de cel stilstaat, en de trilharen worden gebruikt om vloeistof langs de cel te bewegen. In feite zijn er cellen met trilharen in de meeste belangrijke organen van het lichaam. Er zijn verschillende ciliaire dyskinesieën gemeld, waarvan de meest prominente, primaire ciliaire dyskinesie (PCD), waaronder het Kartagener-syndroom (KS), het gevolg is van mutatie van het DNAI1-gen, dat codeert voor een subeenheid (intermediaire keten 1) van axonemale (ciliaire) dynein. PCD wordt gekenmerkt door ademnood als gevolg van terugkerende infectie, en de diagnose van KS wordt gesteld als er ook situs inversus, een aandoening waarbij de normale links-rechts asymmetrie van het lichaam (bijvoorbeeld maag links, lever rechts) is omgekeerd. Het eerste symptoom is te wijten aan inactiviteit van de talrijke trilharen van epitheliale cellen in de longen. Hun normale functie is om slijm in de luchtwegen constant in beweging te houden. Normaal gesproken helpt het slijm om de longen vochtig te houden om de functie te vergemakkelijken, maar als het slijm stilstaat, wordt het een broedplaats voor bacteriën, evenals een irriterend en obstakel voor een goede gasuitwisseling.
Situs inversus is een interessante misvorming omdat het optreedt in embryonale ontwikkeling en slechts 50% van de PCD-patiënten treft omdat de verminderde ciliaire functie randomisatie van links-rechts asymmetrie veroorzaakt, niet omkering. In zeer eenvoudige termen, tijdens de vroege embryonale ontwikkeling, is links-rechts asymmetrie gedeeltelijk te wijten aan de beweging van moleculaire signalen in een linkswaarts ow door de embryonale knoop. Deze stroom wordt veroorzaakt door het gecoördineerde slaan van trilharen, dus wanneer ze niet werken, wordt de stroom verstoord en vindt randomisatie plaats.
andere symptomen van PCD-patiënten wijzen ook op het werk van cilia en flagella in het lichaam. Mannelijke onvruchtbaarheid komt vaak voor als gevolg van immotiel sperma. Vrouwelijke onvruchtbaarheid, hoewel minder vaak, kan ook optreden, als gevolg van dysfunctie van de trilharen van de eileider en eileider die normaal verplaatsen het ei langs van eierstok naar baarmoeder. Interessant is dat er ook een lage associatie van hydrocephalus internus (overvulling van de ventrikels van de hersenen met cerebrospinale vloeistof, waardoor hun uitbreiding die het hersenweefsel om hen heen comprimeert) met PCD. Dit is waarschijnlijk te wijten aan disfunctie van cilia in de ependymale cellen langs de ventrikels, en die helpen circuleren de CSF, maar zijn blijkbaar niet volledig nodig. Aangezien CSF bulkstroom wordt gedacht om hoofdzakelijk door de systole/ diastole verandering in bloeddruk in de hersenen worden gedreven, sommige hypothese dat de trilharen hoofdzakelijk in ow door sommige van de strakkere kanalen in de hersenen kunnen worden betrokken.
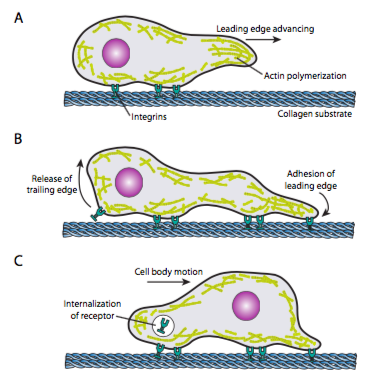
cell crawling (Figure \(\Paginindex{19}\)) vereist de gecoördineerde herschikking van het microfilament aan de voorkant, dat zich uitbreidt (door zowel polymerisatie als glijdende filamenten) en vervolgens verklevingen vormt op het nieuwe meest naar voren gerichte punt. Dit kan de vorm aannemen van filopodia of lamellipodia, en vaak beide tegelijk. Filopodia zijn lange en zeer dunne projecties met kernbundels van parallelle microfilamenten en hoge concentraties van receptoren van het celoppervlak. Hun doel is in de eerste plaats om de omgeving te voelen. Lamellipodia strekt zich vaak uit tussen twee lopodia en is meer een brede ruffle dan een vinger. Intern vormt actin meer in mazen dan bundels, en de bredere rand staat voor meer adhesie toe om aan het substraat worden gemaakt. Het microfilamentnetwerk herschikt dan opnieuw, dit keer het openen van een ruimte in het cytoplasma die als kanaal voor de beweging van de microtubules naar de voorzijde van de cel dienst doet. Dit zet het transportnetwerk op zijn plaats om intracellular bulkmateriaal vooruit te helpen bewegen. Aangezien dit voorkomt, worden de oude adhesie op het staarteind van de cel vrijgegeven. Deze versie kan door twee primaire mechanismen gebeuren: endocytose van de receptor of deactivering van de receptor door het signaleren/conformational verandering. Natuurlijk, deze oversimplificatie logenstraft de complexiteit in het coördineren en controleren van al deze acties om gerichte beweging van een cel te bereiken.
Eén model van microfilamentkrachtgeneratie, het elastische Brownse Ratelmodel (Mogilner en Oster, 1996), stelt voor dat als gevolg van Brownse beweging van het celmembraan als gevolg van continue minieme thermische fluctuatie, de actine filamenten die naar de randen van het membraan duwen in verschillende mate worden gebogen. Als de flex groot genoeg is, kan een nieuw actin monomeer tussen het membraan en het uiteinde van de gloeidraad passen, en wanneer de nu langere gloeidraad terug buigt, kan het een grotere druk op het membraan uitoefenen. Uiteraard genereert een enkel filament niet veel kracht, maar de gecoördineerde uitbreiding van veel filamenten kan het membraan naar voren duwen.
zodra een cel een signaal ontvangt om te bewegen, is de initiële cytoskeletale respons om actine te polymeriseren, waardoor meer microfilamenten worden opgebouwd die in de voorrand moeten worden opgenomen. Afhankelijk van het signaal (aantrekkelijk of afstotend), kan de polymerisatie optreden aan dezelfde of andere kant van de cel vanaf het punt van signaalreceptor activering. Beduidend, kan de polymerisatie van nieuwe F-actin alleen voldoende kracht produceren om het membraan vooruit te bewegen, zelfs zonder betrokkenheid van myosin-motoren! De modellen van krachtgeneratie worden besproken, maar beginnen over het algemeen met de integratie van nieuw g-actin in een gloeidraad bij zijn punt; dat wil zeggen, bij de gloeidraad-membraaninterface. Zelfs als dat technisch genoeg zou kunnen zijn, in een levende cel, myosins zijn betrokken, en helpen om te duwen en te rangschikken filamenten directionally om het opzetten van de nieuwe leading edge. Bovendien, moeten sommige gloeidraden en netwerken snel worden gescheiden, en nieuwe verbindingen gemaakt, zowel tussen gloeidraden als tussen gloeidraden en andere proteã nen zoals adhesiemolecules of microtubules.
Hoe wordt de polymerisatie en actin herschikking gecontroleerd? De receptoren die de voortbeweging van de signaalcel kunnen enigszins verschillende wegen in werking stellen, maar velen delen sommige gemeenschappelijkheden in het activeren van één of meer leden van de Ras-familie van kleine GTPases. Deze signalerende molecules, zoals Rac, Rho, en cdc42 kunnen door de kinases van de receptortyrosine worden geactiveerd (zie de activeringswegen van RTK-Ras, Chap. 14). Elk van deze heeft een lichtjes verschillende rol in celmotiliteit: cdc42 de activering leidt tot filopodia vorming, activeert Rac een weg die Arp2/3 en cofilin aan lamellipodia vorming omvat, en Rho activeert myosin II om brandpuntsadhesie en spanningsvezel vorming te controleren. Een ander type van receptorcascade, de G-eiwit signalerende cascade (ook hoofdstuk 14), kan tot activering van PLC en verdere splitsing van PIP2 en verhoging van cytosolic Ca2+leiden. Deze veranderingen, zoals eerder opgemerkt, kunnen myosin II, evenals het remodelleren van enzymen gelsolin, cofilin, en profilin ook activeren. Dit breekt bestaande actinstructuren af om de cel meer vloeibaar te maken, terwijl ook bijdragend meer g-actin om nieuwe belangrijke randcytoskeleton te vormen.
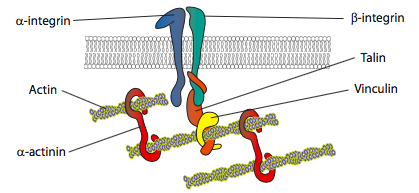
In vitro experimenten tonen aan dat naarmate het membraan naar voren duwt, nieuwe hechtingscontacten worden gemaakt door adhesiemoleculen of receptoren die het substraat binden (vaak worden celcultuurglaasjes of schalen bedekt met collageen, filaminine of andere extracellulaire matrixeiwitten). De contacten werven dan cytoskeletal elementen voor grotere stabiliteit om een focale hechting te vormen (figuur \(\Paginindex{20}\)). Nochtans, schijnt de vorming van brandpuntsadhesie om een Artefact van celcultuur te zijn, en het is onduidelijk als de types van adhesie die in vivo vormen de zelfde types van cytoskeletal componenten werven.
de derde stap naar celmotie is de bulkbeweging van de cellulaire inhoud naar voren. De mechanismen voor deze fase zijn onduidelijk, maar er is wat bewijsmateriaal dat gebruikend verbindingen tussen actin cytoskeleton bij de voorrand en voorwaartse delen van microtubule cytoskeleton, de microtubules worden herschikt om een efficiënte vervoerspad voor bulkbeweging te vormen. Een ander aspect aan dit kan een” kralend ” effect door de actin netwerken zijn, die direct ruimte naar de voorrand openen. De microtubules gaan dan die ruimte gemakkelijker in dan het werken door een strak actin netwerk, die stroom in de juiste richting dwingen.
veel van het werk met betrekking tot microtubule-actine interacties in celmotiliteit is gedaan door onderzoek naar de neuronale groeikegel, die soms aangeduid wordt als een cel aan de leiband, omdat het bijna onafhankelijk werkt als een kruipende cel, zoekend naar de juiste weg om zijn axon van het cellichaam naar zijn juiste synaptische verbinding te leiden (A. W. Schaefer et al, Dev. Cell 15: 146-62, 2008).
ten slotte moet de cel zijn oude adhesies aan de achterrand ongedaan maken. Dit kan op verschillende manieren gebeuren. In vitro, zijn de kruipende cellen waargenomen om zich van het substraat te scheuren, achterlatend uiterst kleine beetjes van membraan en bijbehorende adhesieproteã nen in het proces. De geproduceerde kracht wordt verondersteld om van actin-myosin spanningsvezels te komen die van de meer voorwaartse brandpuntsadhesie leiden. Nochtans, zijn er minder destructieve mechanismen beschikbaar aan de cellen. In sommige gevallen, kan de adhesivity van de cellulaire receptor voor het extracellulaire substraat intern, misschien door phosphorylation of dephosphorylation van een receptor worden geregeld. Een andere mogelijkheid is endocytose van de receptor, die het van het celoppervlak neemt. Het kan eenvoudig tot de voorrand recyclen waar het nodig is (d.w.z. transcytose), of als het niet meer nodig of beschadigd is, kan het in een lysosoom worden afgebroken.
