Forbedret småskala kontinuerlig kultiveringssystem
i denne studien viser vi ytterligere fremskritt og anvendelsesmuligheter for et småskala kontinuerlig kultiveringssystem, tidligere utviklet av Klein et al. , for økt grad av parallellisering og forbedret håndtering samt overvåking av de enkelte reaktorene. De viktigste aspektene ved endringene i systemet omfatter en økning i settet av parallelle kulturfartøy fra 8 til 24 reaktorer og en reduksjon i arbeidsvolum fra 10 til 6,5 mL. Det nåværende systemet består videre av skreddersydde lokkhus fire faste porter som brukes til lufting, medieforsyning, buljongfjerning samt inokulering eller prøvetaking (Fig. 1). I tillegg til de fire portene settes en optisk stangformet do-sonde inn gjennom lokket for DO-overvåking uten å forstyrre dyrkingsprosessen, og på denne måten erstatte oksygen fluorescerende sensorpunkt fra forrige oppsett . Vannbadet, som i det forrige oppsettet opprettholdt en konstant dyrkningstemperatur, ble erstattet av en skreddersydd aluminiumsvarmeblokk, som er smeltet sammen med en mikroplate omrører. Som den forrige versjonen av småskala bioreaktor systemet ble validert ved hjelp av fisjon gjær Schizosaccharomyces pombe, presenterer vi her forbedret dyrking set-up For S. cerevisiae dyrking.
Grunnleggende operasjonelle trinn, samt justeringer av fortynningshastigheter ved å velge riktig rørdiameter og pumpehastighet for medieinnstrømningspumpen, ble utført som tidligere beskrevet . Her ble vekten av væskeinnholdet i hver bioreaktor bestemt gravimetrisk ved slutten av dyrkingen, slik at den nøyaktige beregningen av den respektive fortynningshastigheten med en 5.1% avvik. Kulturbuljong og reaktorgassfasen ble begge fjernet gjennom samme port av reaktorlokket ved hjelp av effluxpumpen (Fig. 1). Efflukspumpehastigheter på 7,5 mL min-1 ble brukt til alle dyrkningsforsøk. Efflukspumpehastigheten var langt over matepumpehastigheten, og genererte et lite negativt trykk inne i kulturbeholderen. Denne trykkforskjellen resulterte i tilførsel av luft gjennom lufteporten. Den gjennomsnittlige oksygenmasseoverføringskoeffisienten kLa oppnådde var 110 h-1, som tillot DO-nivåer godt over 30% metning gjennom hele dyrkingsprosessen. PH ble ikke overvåket online eller kontrollert under dyrking, da mediet ble a priori justert til en pH på 6,0, noe som resulterte i en endelig pH på 5,5 i dyrkningsbuljongen. PH ble målt på linje på daglig basis fra utløpet av reaktorene og etter høsting. PH forble konstant så snart steady-state ble oppnådd, og reaktoravløpet viste et mindre avvik på 0,1 pH-enheter (data ikke vist).
Utforsking av 3-HK-produksjon i småskala kjemostater ved forskjellige fortynningshastigheter under C-begrensende forhold
For å bestemme den maksimale spesifikke vekstraten (µ) ble s. cerevisiae ST938 dyrket i batchbetingelser som anvendte overflødig næringstilgjengelighet. Ved bruk av glukose som karbonkilde var µ 0,265 h−1, biomasseutbytte var 24,9 g mol-1, og 3-HK karbonutbytte på glukose var 0,6% C-mol (Tabell 1). I denne kultiveringsmodusen ble det meste av karbonet metabolisert til etanol og CO2, som høye glykolytiske flukser i villtype S. cerevisiae er sterkt knyttet til alkoholholdig gjæring . Kjemostatkultiveringer styres av tilførsel av et vekstbegrensende substrat. Ved steady state produserer ikke villtype s. cerevisiae betydelige mengder overløpsmetabolitter under en viss vekstrate, noe som markerer den kritiske fortynningshastigheten (Dcrit (h−1)) på grunn av manglende akkumulering av karbonkilde. Ved eller over denne kritiske fortynningshastigheten akkumuleres karbonkilden i reaktoren og overløpsmetabolismen utløses, noe som resulterer i produksjon av forskjellige biprodukter, som etanol, acetat og mindre mengder organiske syrer . Følgelig ble kontinuerlige kulturer brukt til å undersøke forholdet mellom vekstraten og biomassespesifikk 3-HP produktdannelse I s. cerevisiae ST938. De fire forskjellige fortynningsratene D (h−1): 0.04, 0.09, 0.17 og 0.21 ble valgt til å være under s. cerevisiae-stammen ST938 bestemt i batchkultivering. Biomasseutbyttet på glukose samt 3-HP-utbyttet, spesifikk 3-HP-produksjonshastighet og den spesifikke substratopptakshastigheten ble undersøkt (Fig. 2a-d, Tabell 1). Alle relevante dyrkingsparametere, dvs. utbytter og rater med de respektive standardavvikene, er oppsummert I Tabell 1.

Selected rates and yields for C-limited aerobic chemostat cultivations of S. cerevisiae ST938 a 3-HP yield (C-mol C-mol−1) on glucose, b biomass yield on glucose (g mol−1), c specific 3-HP production rate (mmol gCDW−1 h−1) and d specific glucose uptake rate (mmol gCDW−1 h−1) at different dilution rates for S. cerevisiae ST938. Cultivations were carried out in triplicates at 30 °C and pH 5.5 under C-limited conditions. Feil samsvarer med standardavvik avledet fra triplikatkultiveringer
kultivering Av s. cerevisiae ST938 under c-begrensende forhold viste en bytte fra overveiende fermentativ metabolisme observert i batchmodus til en respiratorisk metabolisme i kjemostater, noe som reflekteres i høyere biomasseutbytter så vel som i ubetydelig etanol-og glyseroldannelse (Tabell 1). Videre er mindre mengder restglukose under 0.1 mM ble påvist i prøvene tatt fra efflux av de forskjellige reaktorene, og verifiserte at kulturene var glukosebegrensede. Karbonbegrensede forhold funnet i steady-state kjemostatkulturer syntes å fremme dannelsen av 3-HP, da utbyttet av dette produktet var 20 til 25 ganger høyere enn utbyttet bestemt i batchkultur (Tabell 1). Dette skyldes mest sannsynlig den mer effektive omdannelsen av karbon til energi i FORM AV ATP under respirasjon i forhold til gjæring i batchkulturer. Interessant, dyrking Av S. cerevisiae ST938 under C-begrensende forhold viste at med fallende spesifikke vekstrater kunne en konstant økning i 3-HK karbonutbytte observeres, med det høyeste 3-HK utbyttet på 16,6% C-mol observert ved en fortynningshastighet på 0,04 h−1 (Fig. 2a). 3-HP-utbyttet på biomasse er ti ganger høyere enn utbyttet i batchkulturer og økt mer enn todelt fra 0,19 til 0,43 g gCDW-1 ved å senke fortynningshastigheten fra 0,21 til 0,04 h-1 (Tabell 1). Maksimal spesifikk produktivitet for 3 HK på omtrent 0,50 mmol gCDW-1 h-1 ble sett ved fortynningshastigheter på 0,17 og 0.21 h-1, som er omtrent fire ganger høyere enn målt i batchkultiveringer (Fig. 2c, Tabell 1). Som forventet økte den spesifikke glukoseopptakshastigheten (qS)med høyere fortynningshastigheter fra 0,51 til 2,1 mmol gCDW-1 h-1 (Fig . 2d). Disse verdiene er opp til 20 ganger under den maksimale spesifikke glukoseopptakshastigheten på 10,7 mmol gCDW-1 h−1 observert ved µ under glukosebegrensede vekstforhold i batchmodus (Tabell 1). Verdier oppnådd for den spesifikke substratopptakshastigheten og biomasseutbyttet ved en fortynningshastighet på 0.09 h – 1 (Tabell 1) var i samsvar med data fra kjemostatkultiveringer med villtype s. cerevisiae med en fortynningshastighet på 0,10 h-1, med angivelse av henholdsvis 1,1 og 1,25 mmol gCDW−1 h−1 samt 0,49 g g−1 . Det har blitt funnet at biomasseutbyttet per substrat øker med økende fortynningshastigheter, for villtype s. cerevisiae er denne parameteren imidlertid generelt konstant under Dcrit så lenge vedlikeholdsmetabolisme utgjør en betydelig karbonvask som reduserer biomasseutbyttet ved lave fortynningshastigheter . I tilfelle Av S. cerevisiae stamme ST938, men det virket som karbon, som ikke var rettet mot biomasse dannelse, bidro til en viss grad til dannelsen av både 3-HK og biprodukter.for å konkludere, forskjeller opplevd i kontinuerlige kulturer ved forskjellige fortynningshastigheter, så vel som i forhold til lignende oppsett med s. cerevisiae wild-type antyder at den integrerte biosyntetiske banen for å produsere 3-HP har en enorm innvirkning på gjærfysiologi, som antagelig forsterkes av adaptive stressresponser. Endelig, c-begrenset chemostat dyrking ved laveste fortynning rate av 0.04 h-1 resulterte i det høyeste 3-HK karbonutbyttet.
Undersøkelse av nitrogen – og fosfatbegrensning for økte 3-HP-utbytter i småskala kjemostatkulturer
etter karakterisering Av s. cerevisiae ST938 under C – begrensende forhold ble kultiveringer under nitrogen – og fosfatbegrensende forhold utført, da de tidligere har vist seg å være gunstige for produksjon av forskjellige innfødte og ikke-innfødte metabolitter i forskjellige organismer . Her ble de tilsvarende dyrkingene under nitrogen (N) og fosfor (P) begrensning undersøkt i det småskala kontinuerlige dyrkningssystemet (Fig. 1) med en fast fortynningshastighet på 0,04 h-1, som tidligere hadde resultert i de høyeste karbonutbyttene på 3 HK under c-begrensede forhold (Tabell 1). Parametrene og respektive standardavvik fra n-og p-begrensede kultiveringer av gjærstamme ST938 er oppsummert I Tabell 2.
For N – og P-begrensede dyrkningsbetingelser ble det ikke påvist rester av ammonium eller fosfat i prøvene tatt fra effluksen til de forskjellige reaktorene, og verifiserte at kulturer skal begrenses med hensyn til den tilsvarende substratbegrensningen (Tabell 2). Mindre mengder restglukose i området 0,63 og 0,19 mM ble imidlertid påvist under n-og p-begrensning (Tabell 2). Under c-begrensning var restglukosenivået godt under 0,1 mM (Tabell 2). Kultiveringer som anvendte n-og P-begrensninger viste et 3-HK utbytte på henholdsvis 17,7 og 21,1% C-mol, og viste en signifikant høyere verdi under p-begrensede forhold sammenlignet med 3-HK karbonutbytte på 16,6% C-mol beregnet For C-begrensede dyrkningsbetingelser (Tabell 1, 2). Tilsvarende ble den spesifikke produktiviteten for 3-HK betydelig økt for N-og p-begrensede kultiveringer som avslørte verdier på 0,22 og 0,23 mmol gCDW-1 h-1 i forhold til 0,17 mmol gCDW−1 h−1 nådd I C-begrensede kulturer. Videre viste 3-HK-utbyttet på biomasse sammenlignbare verdier på 0,43 og 0.44 g gCDW – 1 For C-og n-begrensende forhold, men ved p−begrensning ble det observert et økt utbytte på 0,50 g gCDW-1. På grunn av den totale lave konsentrasjonen av kvantifiserte biprodukter er disse ubetydelige (Tabell 2). Verdiene for den spesifikke substratopptakshastigheten (qS) for c – og P-begrensning var sammenlignbare, og en svakt forhøyet verdi på 0,61 mmol gCDW−1 h−1 ble oppnådd under n-begrensede forhold. Biomasse gir per substrat avslørt for N – og P-begrensede forhold tilsvarende verdier av 72.4 og 75.2 g mol−1, henholdsvis. Sammenlignet med biomasseutbyttet på 78.4 g mol-1 oppnådd Under c-begrensede forhold, disse verdiene er like. Vår studie støtter begrunnelsen at høyere produktutbytter per substrat ble oppnådd under n-Og P-begrensende forhold. Følgelig ser det ut til at en høyere spesifikk substratopptakshastighet i Tilfelle N-begrensning kombinert med minimal dannelse av biprodukter til slutt favoriserte produktdannelse. Under P-begrensende forhold ble de minste mengder biprodukter dannet, noe som kunne favorisere produktsyntese. Det kan videre spekuleres i at noen metabolske endringer muligens fører til at en senket mengde karbon frigjøres SOM CO2.
i sammendraget viste kjemostatkultiveringer under n-og p-begrensning økte 3-HP-utbytter og spesifikke produksjonsrater sammenlignet Med C-begrensede forhold, Med P-begrensning som muliggjør de høyeste produktutbyttene.
Overførbarhet av de fysiologiske parametrene målt i småskala kjemostater til fed-batch kulturer i 1-L benk – top bioreaktorer under C-og P – begrensende forhold
Siden denne studien videre rettet mot å vurdere overførbarhet og sammenlignbarhet av de fysiologiske parametrene målt under forskjellige dyrkningsbetingelser, ble dyrkingsparametrene oppnådd fra C – Og P-begrensende forhold bestemt i kjemostatkulturer overført til 1-L omrørte benk-toppreaktorer som kjører i fed-batch-modus. Konseptet med denne tilnærmingen var derfor å holde viktige forhold og parametere konstant for kjemostat og fed-batch kulturer for å sikre sammenlignbarhet. Disse forholdene omfattet (i) Det samme C: P-forholdet som anvendt I P-begrensende kjemostatkultiveringer, (ii) de samme prosessbetingelsene som pH og temperatur, og (iii) de samme spesifikke vekstratene som anvendt i kjemostater, oppnådd gjennom en eksponentiell feedprofil. For å optimalisere produkttiter, parametrene med maksimal produktutbytte per substrat fra kjemostatforsøkene (D = 0.04 h-1) under C – og P-begrensning ble valgt for overforing til fed-batch-systemet. På grunn av tekniske begrensninger i oppsettet ble fed-batch-dyrkinger utført med en vekst på 0,05 h-1, noe som er litt høyere sammenlignet med den angitte fortynningsgraden på 0,04 h−1 i kjemostatkultiveringer. Fed-batch-dyrkingen besto av en innledende batchfase for å generere biomasse etterfulgt av en eksponentiell, næringsbegrenset matingsfase for å kontrollere vekstraten. Bare foringsfasen ble ansett som relevant for overførbarhetsvurderingen av parametrene oppnådd fra det kontinuerlige dyrkningssystemet, siden substratkonsentrasjonen bare i denne fasen kontrollerte og dermed begrenset mikrobiell vekst. Fed-batch dyrking profiler Av S. cerevisiae ST938 anvende C – Og P-begrensende forhold er vist I Fig. 3, og de tilsvarende dyrkingsparametrene med deres respektive standardavvik er oppsummert i Tabell 3.
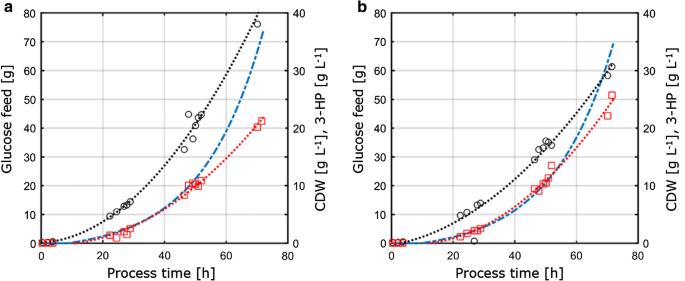
Aerob fed-batch dyrking i 1-L benk-topp fermentorer Av s. cerevisiae ST938 ved hjelp av en eksponentiell materampe Ved D = 0,05 h−1 med det begrensende substratet et karbon eller b fosfor. Svarte sirkler refererer til biomasse titer, røde firkanter til 3-HP titer og blå stiplet linje til den absolutte mengden glukose matet til reaktorene
biomasseutbyttet observert i fed-batch−kulturer var henholdsvis 77,9 og 67,7 g mol – 1 for C-og p-begrensning. Biomasseutbyttet for c-begrensede kultiveringer var sammenlignbart blant kjemostat-og fed-batch-drift, mens For P-begrensning ble det observert et svakt redusert biomasseutbyttet under fed-batch-drift (Tabell 2, 3), som er innenfor standardavvikene observert for begge biomasseutbyttet. Karbonutbyttet per substrat for 3-HK var 15,9% For C-begrensning, som er nesten identisk i forhold til verdien beregnet i kjemostatsystemet (Fig. 4a). De 3-HK avkastningene som ble bestemt i denne studien, er videre i nær overensstemmelse med et karbonutbytte per substrat på 14% oppnådd i tidligere c-begrensede fed-batch-studier ved pH 5,0 med En s. cerevisiae-stamme konstruert for å bruke den malonyl-CoA reduktaseavhengige banen og på 13% med En s. cerevisiae som bruker den malonyl-CoA reduktaseavhengige banen . Høyere 3-HK karbonutbytter per substrat via β-alanin-banen ble bestemt i studier Med Escherichia coli som angav en verdi på 42% i fed-batch-kultiveringer på glukose .

Sammenligning av dyrkingsparametere under forskjellige begrensninger bestemt i småskala kjemostater og 1-L benk-reaktorer i fed-batch-modus. en 3-HK karbon utbytte (%C-mol) og b 3-HK utbytte på biomasse (g gCDW-1). Feil tilsvarer standardavvik avledet fra tredobbelte kultiveringer
for P-begrensende forhold, men vår studie viste en betydelig økning i 3-HK karbonutbytte på 25,6% (Fig. 4a). De observerte 3-HK utbyttene på biomasse var henholdsvis 0,38 og 0,65 g gCDW−1 for C – og P-begrensende forhold. For c-begrensning bekreftet dette verdiene observert i kjemostatoppsettet (Fig. 4b). På grunn av økningen i utbytte på 3-HP per substrat Under P-begrensende forhold og liten reduksjon i biomasse utbytte per substrat på samme tid, utbyttet av 3-HP per biomasse ble betydelig økt i forhold til chemostat eksperiment. I motsetning til kultiveringene utført i kjemostater, ble det ikke påvist signifikant akkumulering av etanol eller glyserol i fed-batch-kultiveringer. En lukket karbonbalanse for C – og P-begrensende forhold indikerte at det ikke ble dannet relevante mengder av andre (bi-)produkter (Tabell 3). Denne forskjellen i biproduktspektrum kan forklare økningen i 3-HK utbytte per glukose.
i forhold til kultiveringene utført i kjemostater, viser de spesifikke glukoseopptaksratene som er bestemt i mat-batchkulturer, betydelig høyere verdier på henholdsvis 0,75 og 0,77 mmol gCDW−1 h−1 for C – og P-begrensende forhold. Som nevnt ovenfor ble settpunktet for eksponentiell faktor av feed profilen satt til 0,05 h-1 og varierte opp til 0,059 h-1, noe som resulterer i en 30-45% høyere spesifikk vekst i fed-batch dyrking sammenlignet med chemostat eksperimenter med 0.04 h−1 (Tabell 3), som forårsaker økt spesifikk glukoseopptakshastighet. Ikke desto mindre, For C-begrensede fermenteringer, var biomasseutbyttet på glukose sammenlignbart mellom kjemostat og fed-batch dyrking. På samme måte ble de spesifikke 3-HK produksjonsratene forhøyet i fed-batch kultiveringer, med henholdsvis 0,24 mmol gCDW−1 h−1 og 0,38 mmol gCDW−1 h−1. 3-HK utbytter per substrat var sammenlignbare mellom kjemostat og fed-batch dyrking, noe som tyder på at utbytter er en robust dyrkingsparameter som er motstandsdyktig mot forstyrrelser indusert av mindre svingninger i dyrkingsoppsettet. Ingen restfosfat, så vel som glukose, ble påvist i prøvene tatt fra de forskjellige reaktorene For P-begrensende forhold, noe som bekrefter at kulturer skal begrenses med hensyn til den tilsvarende begrensningen. På Samme måte ble Det ikke påvist restglukose i prøvene for c-begrensning.
her presenteres forbedringer av en liten skala chemostat system, tidligere utviklet Av Klein et al. , omfattet blant annet en økning i antall reaktorer til 24 og en reduksjon i dyrkningsvolum til 6,5 mL. Denne økte graden av parallellisering gjør systemet til et egnet screeningsverktøy med høy gjennomstrømning, da ulike sammenlignbare småskala kjemostatsystemer opererer med høyere arbeidsvolumer og med et lavere antall reaktorer: CosBios-systemet (continuous parallel shaken bioreactor) bruker seks henholdsvis åtte parallelle kulturfartøy med et kulturvolum på 20-25 mL . For kontinuerlig dyrking modifisert engangs omrørt tank bioreaktor system (bioreaktor, 2mag AG) opererer med åtte parallelle reaktorer ved et arbeidsvolum på 10 mL . Mini-chemostat (MC) – systemet utviklet Av Bergenholm et al. består av 16 parallelle reaktorer og krever et arbeidsvolum på 40 mL. Vårt system er derfor godt anvendelig for enkel og kostnadseffektiv screening av mikrobiell ytelse i kontinuerlig modus. Det kan imidlertid være relevant for systemet ytterligere ved å overvåke tilleggsparametere, for eksempel eksosgass, for å tillate en detaljert analyse av karbonfordelingen, noe som er av særlig betydning for fysiologiske belastningskarakteriseringer.Som vår studie foreslo N – og P-begrensning for å være gunstig for 3-HP-dannelse I s. cerevisiae, kan fremtidige eksperimenter innebære ytterligere screening av vekstrater med n – Og P-begrensning anvendt for å finne den optimale 3-HP-produksjonen med hver respektive begrensning. Vår studie viste videre overførbarheten av fysiologiske parametere fra kjemostat til fed-batch dyrking. Dette anser bare å være mulig dersom ingen giftige eller hemmende forbindelser akkumuleres under fed-batch dyrking, siden fysiologiske parametere vil endres over tid og avvike fra de oppkjøpte parametrene i kjemostater. Som en generell tilnærming kan kjemostatforsøk tjene som et verktøy for å undersøke påvirkning av en potensiell giftig eller hemmende forbindelse ved å legge stoffet til selve tilførselen. Siden alle andre parametere er konstante, kan påvirkning av forbindelsen og dens konsentrasjon direkte vurderes og evalueres. I vår studie var det ingen biproduktdannelse detektert i fed-batch kultiveringer, og en antagelig lignende stressrespons ble indusert på grunn av svake syrer, noe som tillot fysiologiske forhold i småskala kjemostater å ligne de i fed-batch-forhold.i sammendraget viste denne studien at begrepet C – og P-begrensende forhold for produksjon av 3-HP ble undersøkt i et nytt parallelisert kjemostatkultiveringssystem og kunne overføres til 1-L benk-bioreaktorer som opererer i fed-batch-modus. Derfor, fysiologiske parametere ervervet i chemostats kan brukes for design og ytelse vurdering av fed-batch dyrking ved hjelp av yield-baserte parametere for prosessen oppsett.
