Kort beskrivelse av to typer programmert celledød: apoptose og autofagi
Apoptose, eller type i programmert celledød, er den mest studerte av former for celledød. Dens morfologiske egenskaper kan identifiseres under lysmikroskopi, og inkluderer cellekrymping, komprimering av kromatinet, blebbing av cytoplasmisk membran, og til slutt dannelsen av apoptotiske legemer (Figur 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
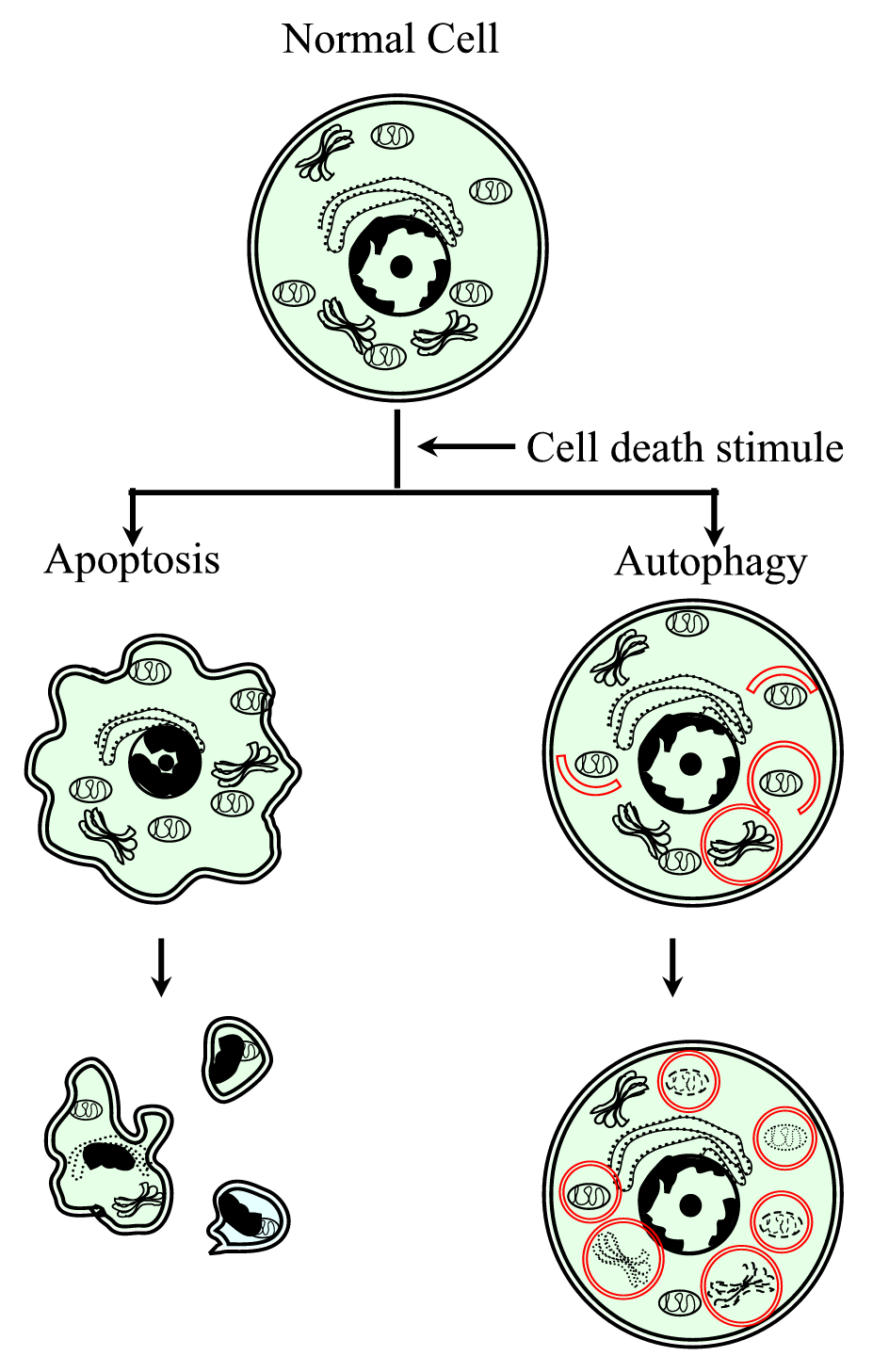
Figure 1.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi= » http://www.w3.org/2001/XMLSchema-instanceSkjematisk fremstilling av den programmerte celledødsprosessen type i (apoptose) og TYPE II (autofagi). Apoptose er preget av en cellulær sammentrekning, kromatinkomprimering, membranøse blebs og dannelse av apoptotiske legemer. Autofagi er preget av tilstedeværelsen av et stort antall autofagosomer med cytoplasmatisk innhold. Begge typer celledød genererer ikke en inflammatorisk respons siden den cytoplasmatiske membranen er bevart til det cellulære rusk elimineres av nabolag eller spesialiserte.
Caspaser er cysteinyl-aspartatspesifikke proteaser som syntetiseres i en inaktiv form som zymogener kalt pro-caspaser (Figur 2). Det er denne inaktive formen som tillater kontrollert utførelse av celledødsprosessen. Caspases ble først identifisert I nematoden Ceanorhabditis elegans, men homologe former er tilstede i pattedyr .
kjennetegnene til apoptose, SOM DNA-fragmentering og komprimert kromatin, skyldes caspaseaktivitet. Under apoptose er DNA fragmentert i nukleosomstørrelse (200 bp). Faktoren som er ansvarlig FOR DNA-fragmentering under apoptose er en spesifikk DNase (CAD, caspase-aktivert DNase) som aktiveres av aktiv caspase-3 . Aktiv caspase-3 er i sin tur involvert i morfologiske celleendringer under apoptose, hvor den klipper rho-assosiert kinase-1 (ROCK-1) for å aktivere den, og dette påvirker til slutt cytoskeletal-arrangementet som forårsaker apoptotisk krympemorfologi .

Figur 2.
xmlns: xlink=» http://www.w3.org/1999/xlink » xmlns:mml=» http://www.w3.org/1998/Math/MathML»xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceCaspaser involvert i den apoptotiske prosessen syntetiseres i en inaktiv form som zymogener, konstitueres av et pro-domene, en stor underenhet og en liten underenhet. Zymogenene aktiveres som danner tetramere.
Apoptotisk celledød er sterkt regulert av medlemmer Av b-celle lymfom 2 (Bcl-2) familien . Bcl – 2 familiemedlemmer har blitt klassifisert som anti-apoptotiske og pro-apoptotiske proteiner i henhold Til Deres Bcl – 2 homologi (BH) og domeneorganisasjon (Figur 3). Tilstedeværelsen av domener BH1, BH2, BH3 og BH4 tilsvarer gruppen som hemmer apoptose. Den pro-apoptotiske gruppen er derimot delt inn i to grupper: de med domener BH1, BH2 og BH3, og de med BARE BH3-domenene (bare DEFINERT SOM BH3; se anmeldelsen i ). Denne familien av proteiner utfører sine funksjoner på intracellulært nivå inne i mitokondriene, et nøkkelelement i apoptose.

figur 3.
xmlns: xlink= » http://www.w3.org/1999/xlink «xmlns: mml=» http://www.w3.org/1998/Math/MathML » xmlns:xsi= » http://www.w3.org/2001/XMLSchema-instanceB-celle lymfom 2 (Bcl-2) familieproteiner. A) Generell skjematisering av strukturen Av Bcl – 2 proteiner. B) de anti-apoptotiske medlemmene-de har alle DE fire BH-domenene. C) pro-apoptotiske medlemmer som igjen er delt inn i to grupper: bare multidomene og BH3.
Apoptose kan initieres av to godt beskrevne ruter: ytre og indre veier (Figur 4). Ekstrinsisk aktivering utføres ved deltakelse av døds-ligander (som tumornekrosefaktor – TNF – superfamilie og TNF-relaterte apoptoseinduserte ligander eller TRAIL) med deres beslektede celleoverflatedødsreceptorer (SOM TNF-reseptor 1, Fas, TRAIL-reseptor 1 eller TRAIL-reseptor 2) (omtalt i). Når liganden gjenkjenner og binder seg til sin reseptor, dannes en rekke intracellulære komplekser for å aktivere initiatoren caspases (som -8 og -10), som deretter aktiverer executioner caspases (som -3, -6 og -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Ligand-reseptor-interaksjonen induserer samlingen av det døds-induserende signalkomplekset (PLATE) for å fremme aktiveringen av caspase-8, som igjen er i stand til å aktivere til eksekutor caspase -3, -6 eller -7, som fører til de morfologiske endringene av apoptosen. Den indre ruten styres av mitokondriell ytre membranpermeabilisering, som tillater frigjøring av pro-apoptotiske elementer som cytokrom – C. Cytokrom-C induserer apoptose protease-aktiverende faktor 1 (Apaf-1) for å fremme aktiveringen av caspase-9 for å samle apoptosomet. Apoptosomet er i stand til å aktivere til eksekutor caspases.
den iboende apoptotiske banen kan derimot aktiveres av ulike stimuli, inkludert DNA-skade, vekstfaktor sult og oksidativt stress . Under eksponering av celler til disse stimuli påvirkes mitokondriene, siden flere medlemmer Av Bcl – 2-familien aktiveres og fremmer mitokondriens ytre membranpermeabilisering (MOMP). Den gjennomsyrede eksterne mitokondriamembranen tillater frigjøring av cytokrom c (cyt c), som er forbundet Med Apaf – 1-proteinet. Cyt c-og Apaf-1-foreningen bindes deretter til initiatoren caspase-9 for å danne komplekset som utgjør apoptosomet, som har evnen til å aktivere initiatoren caspaser som utfører sine funksjoner ved å spalte bestemte cellulære substrater.den andre prosessen med celledød, autofagi, er en genetisk programmert og evolusjonært konservert prosess som produserer nedbrytning av foreldede organeller og proteiner. Det aktiveres av slike ekstracellulære stimuli som næringssult, hypoksi, høy temperatur og endrede intracellulære forhold, inkludert akkumulering av skadede eller overflødige organeller(vurdert i).i eukaryote organismer er det beskrevet tre typer autofagi: mikroautofagi, makroautofagi (ofte kalt bare autofagi) og anstandsmediert autofagi (Figur 5). Mikroautofagi innebærer engulfing av cytoplasmatiske komponenter direkte på nivået av lysosomet ved hjelp av en invaginasjonsprosess, mens makroautofagi innebærer dannelse av dobbeltmembranvesikler som inneholder cellulære komponenter, som smelter sammen med lysosomer for å danne et autofagolysosom. Det er inne i autofagolysosomet at de intravesikulære komponentene nedbrytes og om mulig resirkuleres av cellen(vurdert i). Chaperonmediert autofagi innebærer til slutt deltakelse av chaperoner i å gjenkjenne proteiner utpekt for eliminering av lysosomer .

figur 5.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceSkjematiske representasjoner av de forskjellige mekanismene for autofagi. Makroautofagi-autofagi-innebærer dannelsen av en dobbeltmembranvesikkel, som omslutter cytoplasmatisk innhold som vil bli utført til lysosomet som skal nedbrytes. Mikroautofagi er preget av direkte engulfing av cytoplasmatiske komponenter av lysosomet. Denne prosessen innebærer remodeling av membranen i organellen ved å danne en lysosomal membraninvaginering. Under chaperonmediert autofagi er proteinene som skal nedbrytes målrettet for En Hsp70, som igjen transporterer mållasten til lysosomet.
Autofagi er rettet Av atg (Autofagirelaterte) gener, som kreves for å aktivere signalkomplekset som utløser dannelsen av autofagosomer . Atggener ble oppdaget i gjær, men mange har orthologues i høyere eukaryoter (Figur 6). Autofagosomdannelse innebærer deltakelse av cytoplasmisk protein LC3 (Atg8), som gjennomgår lipidering av fosfatidyletanolamin, og rekrutteres deretter til den naserende autofagosommembranen (Figur 7). Akkumulering av lipidated lc3 protein (kjent SOM LC3-II) brukes som en markør for autofagi .

figur 6.
xmlns: xlink= » http://www.w3.org/1999/xlink «xmlns: mml=» http://www.w3.org/1998/Math/MathML » xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. LC3-proteinet lipideres av fosfatidyletanolamin.
Autofagisk celledød, eller type II programmert celledød, er preget av en massiv engulfing av cytoplasma av autofagiske vesikler. Denne intense autofagiske aktiviteten skiller seg vesentlig fra autofagi som oppstår kontinuerlig på basale nivåer. Ultrastrukturelle studier I Drosophila har avslørt akkumulering av autofagiske vakuoler i de fleste larvvev. Denne typen programmert celledød begynner med nedbrytning av cytoplasmatiske organeller ved autofagi, selv om cytoskeletal elementene er bevart til de sene stadier av prosessen (anmeldt i ).
