Læringsmål
- Beskriv den grunnleggende strukturen til en aminosyre
- Beskriv de kjemiske strukturer av proteiner
- Oppsummere de unike egenskapene til proteiner
i begynnelsen av dette kapitlet ble et berømt eksperiment beskrevet der forskere syntetiserte aminosyrer under forhold som simulerte de som er tilstede på jorden lenge før utviklingen av livet som vi kjenner det. Disse forbindelsene er i stand til å binde sammen i stort sett et hvilket som helst antall, noe som gir molekyler av stort sett alle størrelser som har et bredt spekter av fysiske og kjemiske egenskaper og utfører mange funksjoner som er avgjørende for alle organismer. Molekylene avledet fra aminosyrer kan fungere som strukturelle komponenter i celler og subcellulære enheter, som kilder til næringsstoffer, som atom – og energilagringsreservoarer, og som funksjonelle arter som hormoner, enzymer, reseptorer og transportmolekyler.
Aminosyrer og Peptidbindinger

Figur 1.
en aminosyre er et organisk molekyl der et hydrogenatom, en karboksylgruppe (–COOH) og en aminogruppe (- NH2) alle er bundet til det samme karbonatomet, det såkalte α karbon. Den fjerde gruppen som er bundet til det α karbonet varierer mellom de forskjellige aminosyrene og kalles en rest eller en sidekjede, representert i strukturelle formler ved bokstaven R. a rest er en monomer som resulterer når to eller flere aminosyrer kombinerer og fjerner vannmolekyler. Den primære strukturen av et protein, en peptidkjede, er laget av aminosyrerester. De unike egenskapene til de funksjonelle gruppene og R-gruppene tillater disse komponentene i aminosyrene å danne hydrogen -, ioniske og disulfidbindinger, sammen med polare/ikke-polare interaksjoner som trengs for å danne sekundære, tertiære og kvaternære proteinstrukturer. Disse gruppene består hovedsakelig av karbon, hydrogen, oksygen, nitrogen og svovel, i form av hydrokarboner, syrer, amider, alkoholer og aminer. Noen eksempler som illustrerer disse mulighetene er gitt I Figur 1.
Aminosyrer kan kjemisk binde sammen ved reaksjon av karboksylsyregruppen av ett molekyl med aminigruppen av en annen. Denne reaksjonen danner en peptidbinding og et vannmolekyl og er et annet eksempel på dehydreringssyntese (Figur 2). 50 eller færre) kalles peptider, og prefikser brukes ofte til å spesifisere disse tallene: dipeptider (to aminosyrer), tripeptider (tre aminosyrer) og så videre. Mer generelt er det omtrentlige antall aminosyrer betegnet: oligopeptider dannes ved å bli med opp til ca 20 aminosyrer, mens polypeptider syntetiseres fra opptil ca 50 aminosyrer. Når antall aminosyrer knyttet sammen blir svært store, eller når flere polypeptider brukes som byggeunderenheter, kalles makromolekylene som resulterer proteiner. Den kontinuerlig variable lengden (antall monomerer) av disse biopolymerene, sammen med variasjonen av mulige r-grupper på hver aminosyre, muliggjør et nesten ubegrenset mangfold i typer proteiner som kan dannes.

Figur 2. Peptidbindingsdannelse er en dehydreringssyntesereaksjon. Karboksylgruppen av den første aminosyren (alanin) er knyttet til aminogruppen av den innkommende andre aminosyren (alanin). I prosessen frigjøres et molekyl vann.
Tenk på det
- Hvor mange aminosyrer er i polypeptider?
Proteinstruktur
størrelsen (lengden) og spesifikk aminosyresekvens av et protein er viktige determinanter for dens form, og formen til et protein er kritisk for dens funksjon. For eksempel, i prosessen med biologisk nitrogenfiksering (se Biogeokjemiske Sykluser), samhandler jordmikroorganismer kollektivt kjent som rhizobia symbiotisk med røtter av legume planter som soyabønner, peanøtter eller bønner for å danne en ny struktur kalt en knute på planterøttene. Planten produserer deretter et bærerprotein kalt leghemoglobin, et protein som bærer nitrogen eller oksygen. Leghemoglobin bindes med en meget høy affinitet til substratoksygenet i et bestemt område av proteinet der formen og aminosyresekvensen er passende (det aktive stedet). Hvis formen eller det kjemiske miljøet på det aktive stedet endres, kan det hende at substratet ikke kan binde så sterkt, eller det kan ikke binde seg i det hele tatt. For at proteinet skal være fullt aktivt, må det derfor ha riktig form for sin funksjon.Proteinstruktur er kategorisert i form av fire nivåer: primær, sekundær, tertiær og kvaternær. Den primære strukturen er ganske enkelt sekvensen av aminosyrer som utgjør polypeptidkjeden. Figur 3 viser den primære strukturen til et protein.
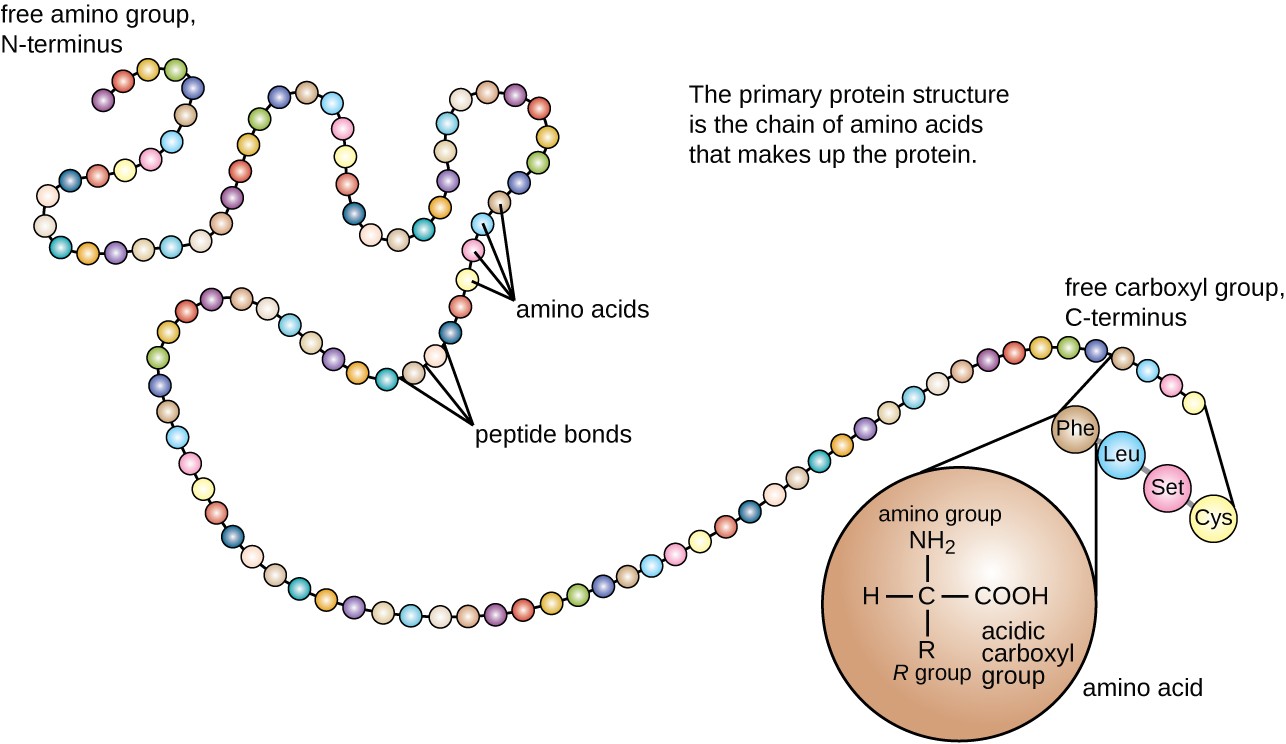
Figur 3. Klikk for å se et større bilde. Den primære strukturen av et protein er sekvensen av aminosyrer. kjeden av aminosyrer som definerer et proteins primære struktur er ikke stiv, men i stedet er fleksibel på grunn av arten av bindingene som holder aminosyrene sammen. Når kjeden er tilstrekkelig lang, kan hydrogenbinding forekomme mellom amin-og karbonylfunksjonelle grupper innenfor peptid-ryggraden (unntatt r-sidegruppen), noe som resulterer i lokalisert folding av polypeptidkjeden i helikser og ark. Disse formene utgjør et proteins sekundære struktur. De vanligste sekundærstrukturene er α-helix og β-plissert ark. I α-helix-strukturen holdes helixen av hydrogenbindinger mellom oksygenatomet i en karbonylgruppe av en aminosyre og hydrogenatomet i aminogruppen som bare er fire aminosyreenheter lenger langs kjeden. I det β-plisserte arket dannes brettene av lignende hydrogenbindinger mellom kontinuerlige sekvenser av karbonyl-og aminogrupper som videre separeres på ryggraden i polypeptidkjeden(Figur 4).

Figur 4. Den sekundære strukturen til et protein kan være en α-helix eller et β-plissert ark, eller begge deler.
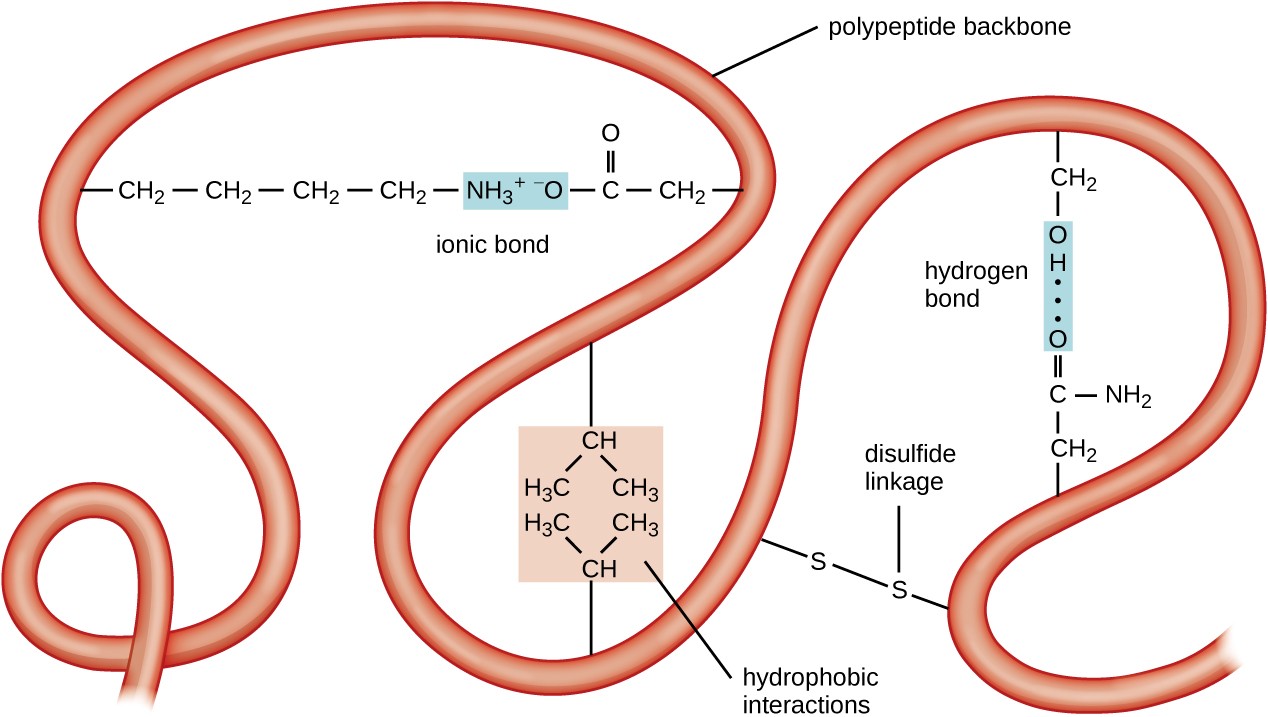
Figur 5. Klikk for å se større bilde. Den tertiære strukturen av proteiner bestemmes av en rekke attraktive krefter, inkludert hydrofobe interaksjoner, ionisk binding, hydrogenbinding og disulfidbindinger.Det neste nivået av proteinorganisasjon er den tertiære strukturen, som er den store tredimensjonale formen av en enkelt polypeptidkjede. Tertiær struktur bestemmes av interaksjoner mellom aminosyrerester som er langt fra hverandre i kjeden. En rekke interaksjoner gi opphav til protein tertiær struktur, slik som disulfid broer, som er bindinger mellom sulfhydryl (–sh) funksjonelle grupper på aminosyre sidegrupper; hydrogenbindinger; ioniske bindinger; og hydrofobe interaksjoner mellom ikke-polare sidekjeder. Alle disse interaksjonene, svake og sterke, kombineres for å bestemme den endelige tredimensjonale formen av proteinet og dets funksjon (Figur 5).
prosessen der en polypeptidkjede antar en storskala tredimensjonal form kalles proteinfolding. Foldede proteiner som er fullt funksjonelle i sin normale biologiske rolle sies å ha en innfødt struktur. Når et protein mister sin tredimensjonale form, kan det ikke lenger være funksjonelt. Disse utfoldede proteiner er denaturert. Denaturering innebærer tap av sekundær struktur og tertiær struktur (og, hvis tilstede, den kvaternære strukturen) uten tap av primærstrukturen.
noen proteiner er sammensetninger av flere separate polypeptider, også kjent som proteinunderenheter. Disse proteinene fungerer bare tilstrekkelig når alle underenheter er til stede og riktig konfigurert. Interaksjonene som holder disse underenhetene sammen utgjør den kvaternære strukturen av proteinet. Den samlede kvaternære strukturen stabiliseres av relativt svake interaksjoner. Hemoglobin har for eksempel en kvaternær struktur av fire globulære proteinunderenheter: to α og to β polypeptider, hver med en jernbasert heme (Figur 6).

Figur 6. Et hemoglobinmolekyl har to α og to β polypeptider sammen med fire hemegrupper.
En annen viktig klasse proteiner er de konjugerte proteinene som har en nonproteindel. Hvis det konjugerte proteinet har et karbohydrat festet, kalles det et glykoprotein. Hvis den har en lipid festet, kalles den et lipoprotein. Disse proteinene er viktige komponenter i membraner. Figur 7 oppsummerer de fire nivåene av proteinstruktur.

Figur 7. Proteinstrukturen har fire organisasjonsnivåer. (kreditt: modifikasjon av arbeid Av National Human Genome Research Institute)
Tenk på det
- Hva kan skje Hvis et proteins primære, sekundære, tertiære eller kvaternære struktur endres?
Primær Struktur, Dysfunksjonelle Proteiner og Cystisk Fibrose

figur 8. Klikk for å se et større bilde. DET normale CFTR-proteinet er et kanalprotein som hjelper salt (natriumklorid) til å bevege seg inn og ut av celler.
Proteiner assosiert med biologiske membraner er klassifisert som ytre eller indre. Ekstrinsiske proteiner, også kalt perifere proteiner, er løst forbundet med den ene siden av membranen. Intrinsiske proteiner, eller integrerte proteiner, er innebygd i membranen og fungerer ofte som en del av transportsystemer som transmembranproteiner. Cystisk fibrose (cf) er en menneskelig genetisk lidelse forårsaket av endring i transmembranproteinet. Det påvirker hovedsakelig lungene, men kan også påvirke bukspyttkjertelen, leveren, nyrene og tarmen. CF er forårsaket av tap av aminosyren fenylalanin i et cystisk fibrose transmembranprotein (CFTR). Tapet av en aminosyre endrer den primære strukturen til et protein som normalt bidrar til å transportere salt og vann inn og ut av celler (Figur 8).
endringen i primærstrukturen forhindrer proteinet i å fungere skikkelig, noe som får kroppen til å produsere uvanlig tykt slim som tetter lungene og fører til opphopning av klebrig slim. Slimet hindrer bukspyttkjertelen og stopper naturlige enzymer fra å hjelpe kroppen å bryte ned mat og absorbere viktige næringsstoffer.
i lungene til personer med cystisk fibrose gir det endrede slimet et miljø der bakterier kan trives. Denne koloniseringen fører til dannelsen av biofilmer i lungens små luftveier. De vanligste patogener som finnes i lungene hos pasienter med cystisk fibrose Er Pseudomonas aeruginosa (Figur 9a) Og Burkholderia cepacia. Pseudomonas skiller seg i biofilmen i lungen og danner store kolonier, kalt» mucoid » Pseudomonas. Koloniene har en unik pigmentering som dukker opp i laboratorietester (Figur 9b) og gir leger den første anelse om at pasienten har CF (slike kolonier er sjeldne hos friske individer).

Figur 9. (a) en skanningelektronmikrograf viser den opportunistiske bakterien Pseudomonas aeruginosa. (B) Pigment-produserende P. aeruginosa på cetrimide agar viser det grønne pigmentet kalt pyocyanin. (credit a: modification of work By The Centers For Disease Control And Prevention)
Nøkkelbegreper og Sammendrag
- Aminosyrer er små molekyler som er essensielle for alt liv. Hver av dem har et α karbon som et hydrogenatom, karboksylgruppe og amingruppe er bundet til. Den fjerde bonded gruppen, representert Ved R, varierer i kjemisk sammensetning, størrelse, polaritet og ladning mellom forskjellige aminosyrer, noe som gir variasjon i egenskaper.Peptider Er polymerer dannet ved kobling av aminosyrer via dehydreringssyntese. Bindingene mellom de koblede aminosyrene kalles peptidbindinger. Antall aminosyrer knyttet sammen kan variere fra noen til mange.
- Proteiner er polymerer dannet ved kobling av et meget stort antall aminosyrer. De utfører mange viktige funksjoner i en celle, som tjener som næringsstoffer og enzymer; lagringsmolekyler for karbon, nitrogen og energi; og strukturelle komponenter.
- strukturen av et protein er en kritisk determinant av dens funksjon og er beskrevet ved en gradert klassifisering: primær, sekundær, tertiær og kvaternær. Den opprinnelige strukturen til et protein kan bli forstyrret av denaturering, noe som resulterer i tap av sin høyere orden struktur og dens biologiske funksjon.
- noen proteiner dannes av flere separate proteinunderenheter, samspillet mellom disse underenhetene som utgjør den kvaternære strukturen av proteinkomplekset.
- Konjugerte proteiner har en ikke-polypeptiddel som kan være et karbohydrat (danner et glykoprotein) eller en lipidfraksjon (danner et lipoprotein). Disse proteinene er viktige komponenter i membraner.
Multiple Choice
Hvilke av følgende grupper varierer mellom forskjellige aminosyrer?
- hydrogenatom
- karboksylgruppe
- r-gruppe
- aminogruppe
aminosyrene som er tilstede i proteiner, varierer i hvilken av følgende?
- størrelse
- form
- sidegrupper
- alle de ovennevnte
Hvilke av følgende bindinger er ikke involvert i tertiær struktur?
- peptidbindinger
- ioniske bindinger
- hydrofobe interaksjoner
- hydrogenbindinger
Fyll Inn Blankt
sekvensen av aminosyrer i et protein kalles dens __________.
Denaturering innebærer tap av __________ og __________ strukturer uten tap av __________ struktur.
Sann/Usann
en endring i en aminosyre i en proteinsekvens resulterer alltid i tap av funksjon.
Tenk på det
- Oppvarming av et protein i tilstrekkelig grad kan føre til denaturering. Med tanke på definisjonen av denaturering, hva sier denne uttalelsen om styrken av peptidbindinger i forhold til hydrogenbindinger?
- bildet som vises representerer et tetrapeptid.

- Hvor mange peptidbindinger er i dette molekylet?
- Identifiser sidegruppene til de fire aminosyrene som komponerer dette peptidet.
