

Karbondioksid (CO2) er en kjemisk forbindelse. Det er en gass ved romtemperatur. Den består av ett karbon og to oksygenatomer. Mennesker og dyr slipper ut karbondioksid når de puster ut. Også, hver gang noe organisk er brent (eller en brann er laget), gjør det karbondioksid. Planter bruker karbondioksid til å lage mat. Denne prosessen kalles fotosyntese. Egenskapene til karbondioksid ble studert Av Den Skotske forskeren Joseph Black på 1750-tallet.
Karbondioksid er en drivhusgass. Drivhusgasser fanger varmeenergi. Klimagasser endrer klimaet og været på vår planet, Jorden. Dette kalles klimaendringer. Drivhusgasser er en årsak til global oppvarming, økningen Av jordens overflatetemperatur.
Biologisk rolle
Karbondioksid er et sluttprodukt i organismer som får energi fra å bryte ned sukker, fett og aminosyrer med oksygen som en del av stoffskiftet. Dette er en prosess som kalles cellulær respirasjon. Dette inkluderer alle planter, dyr, mange sopp og noen bakterier. I høyere dyr, karbondioksid reiser i blodet fra kroppens vev til lungene hvor det er pustet ut. Planter tar i karbondioksid fra atmosfæren til bruk i fotosyntese.
Tørris
Tørris, eller fast karbondioksid, er co2-gassens faste tilstand under -109.3 °F (-78.5°C). Tørris forekommer ikke naturlig på jorden, men er menneskeskapt. Det er fargeløst. Folk bruker tøris for å gjøre ting kaldt, og å lage drinker brus, drepe gophers og fryse vorter. Dampen av tørris forårsaker kvelning og til slutt død. Forsiktighet og profesjonell hjelp anbefales når tørris er i bruk.

ved vanlig trykk vil det ikke smelte fra et fast stoff til en væske, men i stedet endres direkte fra et fast stoff til en gass. Dette kalles sublimering. Det vil endres direkte fra et fast stoff til en gass ved en temperatur høyere enn ekstremt kalde temperaturer. Tøris sublimerer ved normal lufttemperatur. Tøris utsatt for normal luft avgir karbondioksid gass som ikke har farge. Kullsyre kan væskes ved trykk over 5,1 atmosfærer.
Karbondioksidgass som kommer ut av tøris er så kald at når den blandes med luft, avkjøler den vanndampen i luften til tåke, som ser ut som en tykk hvit røyk. Det brukes ofte i teatret for å skape utseende av tåke eller røyk.
Isolasjon og produksjon
Kjemikere kan få karbondioksid fra kjøleluft. De kaller denne luftdestillasjonen. Denne metoden er ineffektiv fordi en stor mengde luft må kjøles for å trekke ut en liten MENGDE CO2. Kjemikere kan også bruke flere forskjellige kjemiske reaksjoner for å skille karbondioksid. Kullsyre er laget i reaksjonene mellom de fleste syrer og de fleste metallkarbonater. For eksempel gjør reaksjonen mellom saltsyre og kalsiumkarbonat (kalkstein eller kritt) karbondioksid:
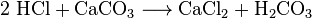
karbonsyren (H2CO3) dekomponerer deretter til vann og CO2. Slike reaksjoner forårsaker skummende eller boblende, eller begge deler. I industrien brukes slike reaksjoner mange ganger for å nøytralisere avfallssyrestrømmer.
Quicklime (CaO), et kjemikalie som har utbredt bruk, kan gjøres oppvarming kalkstein til ca 850 °C. Denne reaksjonen gjør OGSÅ CO2:
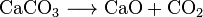
Karbondioksid er også laget ved forbrenning av alle karbonholdige brensel, som metan (naturgass), petroleumsdestillater (bensin, diesel, parafin, propan), kull eller tre. I de fleste tilfeller frigjøres også vann. Som et eksempel er den kjemiske reaksjonen mellom metan OG oksygen:
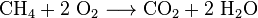
Karbondioksid er laget i stålverk. Jern er redusert fra sine oksider med koks i en masovn, som produserer råjern og karbondioksid:

Gjær metaboliserer sukker for å produsere karbondioksid og etanol, også kjent som alkohol, i produksjon av viner, øl og andre ånder, men også i produksjon av bioetanol:
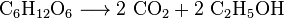
alle aerobe organismer produserer co2 når DE oksiderer KARBOHYDRATER, fettsyrer og proteiner i mitokondriene i cellene. Det store antallet reaksjoner involvert er overordentlig komplekse og ikke beskrevet lett. (De inkluderer cellulær respirasjon, anaerob respirasjon og fotosyntese). Photoautotrophs (dvs.planter, cyanobakterier) bruker en annen reaksjon: Planter absorberer CO2 FRA luften, og reagerer sammen med vann for å danne karbohydrater:
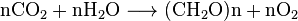
Karbondioksid er løselig i vann, hvor det spontant interconverterer MELLOM CO2 OG H2CO3 (karbonsyre). De relative konsentrasjonene AV CO2, H2CO3 og de deprotonerte formene HCO−
3 (bikarbonat) og CO2−
3(karbonat) avhenger av surheten (pH). I nøytralt eller svakt alkalisk vann (pH > 6.5) dominerer bikarbonatformen (>50%) som blir den mest utbredte (>95%) ved ph i sjøvann, mens i svært alkalisk vann (pH > 10.4) den dominerende (>50%) form er karbonat. Bikarbonat – og karbonatformene er meget oppløselige. Så inneholder luftbalansert havvann (mildt alkalisk med typisk pH = 8,2–8,5) ca 120 mg bikarbonat per liter.
Industriell produksjon
Industriell karbondioksid produseres hovedsakelig fra seks prosesser:
- ved å fange naturlige karbondioksidfjærer hvor det produseres ved hjelp av surgjort vann på kalkstein eller dolomitt.
- Som et biprodukt av hydrogenproduksjonsanlegg, hvor metan omdannes TIL CO2;
- fra forbrenning av fossilt brensel eller tre;
- som et biprodukt av gjæring av sukker i brygging av øl, whisky og andre alkoholholdige drikker;
- fra termisk dekomponering av kalkstein, CaCO3, ved fremstilling av kalk (Kalsiumoksid, CaO);
Kjemisk reaksjon
Karbondioksid kan opprettes med en enkel kjemisk reaksjon:
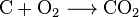 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of «dry ice», a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

pterapod skall oppløst i sjøvann justert til havkjemi anslått for år 2100.
-

oversikt over fotosyntese og respirasjon. Karbondioksid (til høyre), sammen med vann, danner oksygen og organiske forbindelser (til venstre) ved fotosyntese, som kan respireres til vann og (CO2).
-

stigende nivåer av co2 truet apollo 13-astronautene som måtte tilpasse patroner fra kommandomodulen for å levere karbondioksidskrubberen i månemodulen, som de brukte som livbåt.
-

CO2 concentration meter using a nondispersive infrared sensor
