hva er tettheten av celler?
Lesermodus
tettheten av biologisk materiale er ansvarlig for sedimentering av celler til bunnen av laboratorierørene og flerbrønnplater og tjener som grunnlag for rutinemessig sentrifugering som er en del av det daglige livet til så mange biologer. Disse samme forskjellene i tetthet mellom celler og deres vannige eksteriør er også grunnlaget for kontrasten vi observerer i fasemikroskopibilder. Disse forskjellene er også viktige utenfor laboratorieinnstillingen. For eksempel må plankton kjempe med denne tetthetsforskjellen for å forbli på en dybde i havet der sollyset er rikelig i stedet for å synke til de svarte dypene. Gitt at de fleste biologer og biokjemikere gjør bruk av separasjon basert på tetthet på en daglig basis virker det overraskende hvor sjelden tettheter som de samlet I Tabell 1 er faktisk diskutert.
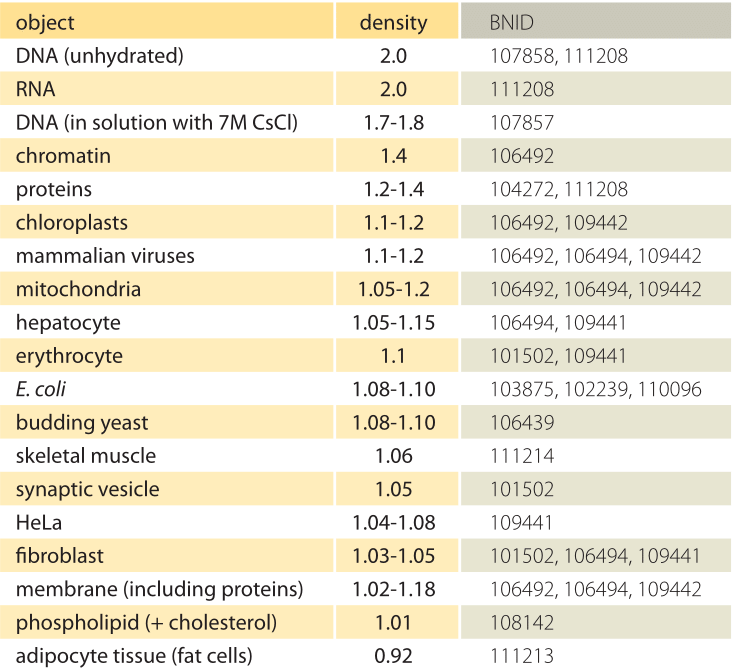
Tabell 1: Tettheter av biologiske objekter i forhold til vann. Dette tilsvarer nesten å gi dem i enheter på g / ml eller 1000 kg / m3. Verdiene er sortert i synkende rekkefølge. Med mindre annet er angitt, ble verdiene målt i sukrose eller ficoll-oppløsning.
Hva er det underliggende grunnlaget for varierende tettheter av forskjellige organeller og celletyper? I stor grad kan disse forskjellene tilskrives forholdet mellom vanninnhold og tørr masse. Proteiner har en tetthet på ≈1,3 – 1,4 (BNID 104272, 101502) i forhold til vann (eller nesten ekvivalent i enheter g/ml eller 1000 kg/m3). Gitt referanseverdien på 1 for tettheten av vann, et spektrum av mellomverdier for celletettheten mellom 1 og 1.3 er oppnådd basert på den relative overflod av proteiner og vann. Lipider er i den lave enden ved siden av vann med en tetthet på ca 1 (BNID 108142). På den andre ytterligheten kan stivelsesgranulat med en tetthet på ≈1,5 (BNID 103206) og nukleotider ved ≈1,7 forskyve den totale massebalansen i motsatt retning.Å Vite tettheten er ofte basert på stedet der en gitt biologisk komponent avgjøres når den spinnes i en sentrifuge som inneholder en gradient av konsentrasjoner som ofte produseres av sukrose eller I TILFELLE AV DNA, cesiumklorid. Tettheten reflekterer massen delt på volumet, men for ladede forbindelser i oppløsning påvirkes tettheten også av skall av såkalt bundet vann. Tettheten i dette tilfellet blir en effektiv tetthet, redusert av bundet vann, og dermed noe avhengig av saltkonsentrasjonen (BNID 107858).
sedimenteringshastigheten, som forekommer i en sentrifuge, kvantifiseres I enheter Av Svedberg som er opprinnelsen TIL navnene 70S, 23S etc. for ribosomet og dets rRNA-underenheter. En 23s rRNA vil sedimentere med en hastighet på 23×10-12 m / s under normal tyngdekraft. I en ultracentrifuge som gir en akselerasjon på en million g, vil hastigheten proporsjonalt skalere til 23×10-6 m / s eller omtrent 1 mm / min. Sedimenteringshastigheten avhenger av tetthet, størrelse og form av molekylet. For lignende former og tettheter skalerer sedimenteringshastigheten som kvadratroten av molekylmassen. For slike tilfeller går molekylmassen som kvadratet av sedimenteringshastigheten, slik AT 23s og 16s underenheter av ribosomet har en molekylvekt med et forhold på omtrent (23/16) 2 eller omtrent 2 som er tett inline med målinger av 0,9 og 0.5 MDa henholdsvis (BNID 110972, 110967). I klinikken brukes sedimenteringshastigheten av erytrocytter (røde blodlegemer) rutinemessig til å måle betennelse. Priser mye høyere enn 10 mm / time indikerer vanligvis tilstedeværelsen av pro-sedimenteringsfaktoren fibrinogen som er en generell indikator på en inflammatorisk tilstand.
det er velkjent at vann er den mest omfattende molekylære fraksjonen av celler,men hvor rikelig nøyaktig? Hvis vi undersøker vev fra multicellulære organismer, er det å finne vanninnholdet en enkel oppgave å måle vevets masse før og etter tørking. Men hvordan kan man utføre slike målinger for celler? Når vi veier en masse celler før og etter tørking, hvordan måler vi bare cellene uten vann rundt dem? Selv etter sentrifugering er det vann igjen i cellepellet, noe som resulterer i tvetydighet om selve tørrmassen.
igjen kommer radio-isotopisk merking til redning(Cayley et al 1991). Først måles merket vann (ved bruk av tritium, 3h) i en cellepellet. Dette indikerer summen av vann i og utenfor cellene. Deretter måler en annen løselig forbindelse som er merket, men som ikke kan komme inn i cellen, for EKSEMPEL 14C-inulin ELLER 3H-PEG, volumet av vann utenfor cellene i en sentrifugert pellet (for Eksempel i E. coli ca 25-35% av pelletvolumet (BNID)). Forskjellen indikerer vanninnholdet i cellene. Slike metoder fører til typiske verdier som varierer fra ≈60-65 vektprosent for spirende gjær og røde blodceller til ≈70% For E. coli Og amøbe d. discoideum og opp til ≈80% for rottemuskler og grisehjertevev (BNID 105938, 103689). Siden tørrstoffbidraget domineres av bestanddeler av tetthet ≈1.3 (dvs.proteiner), fører dette til den karakteristiske totale tettheten til ≈1.1 (BNID 103875, 106439, 101502). Fra disse karakteristiske fraksjonene kan tørrmassen per volum utledes til å være omtrent 300-500 mg / ml (BNID 108131, 108135, 108136), men under langsom vekst kan verdiene være høyere. Lav tetthet er vanlig i tørre frø og undervannsplanter som har flytende deler med tetthet mindre enn det omkringliggende vannet, slik at de kan flyte. Tetthet lavere enn vann kan oppnås enten ved gass som i tare og noen bakterier eller ved å bruke oppløsninger av molekylvekt (MW) lavere enn de omkringliggende medier (f. eks erstatte natrium med MW≈23 med ammonium med MW≈18) som i de små krepsdyr, antarktis hoppekreps.Mennesker er laget av ca 60% vann (40% i celler, 15% i interstitiell væske og 5% i blodplasma, BNID 110743) og de fleste av oss har opplevd de sterke effektene av dehydrering etter å ha glemt å drikke selv bare noen få glass. Likevel kan noen celler være overraskende robuste for en nedgang i vanninnholdet. For eksempel ble glukosemetabolismen i rottelevercellene ikke påvirket av 25% tap av intracellulært vann. En slik reduksjon kan oppnås ved osmose-endring av toniciteten (løsningskonsentrasjon) av det ekstracellulære væsken. Et ekstremt eksempel er den bemerkelsesverdige saltlake reker. Å leve i miljøer der saltkonsentrasjonen utenfor kan svinge og være veldig høy, ble vist å ha cyster som kan tørkes til bare 2% vann uten irreversibel skade og ved hydreringsnivåer på høyere enn 37% (bare omtrent halvparten av sin fullt hydrerte tilstand) oppfører deres fysiologi seg som normalt. Denne robustheten i møte med vanntap kan være relatert til et skille som noen ganger gjøres mellom to former for vann i cellens indre. Normal «bulk vann» som er mer unnværlig og «bundet vann» som er forbundet med de cellulære komponentene og fungerer som et løsningsmiddel som er avgjørende for riktig funksjon.





