Introduksjon
Cytotoksiske celler er integrert i kampen mot virusinfiserte og kreftceller. Disse cellene dreper gjennom tre forskjellige veier, frigivelsen av lytiske granulater, Fas-reseptor-ligand-vei eller TRAIL-TRAIL-reseptorveien. For formålet med dette papiret vil vi fokusere på degranulering. Når en cytotoksisk celle møter en målcelle, holder den seg tett til den som danner immunsynapsen. De lytiske granulatene polariseres deretter mot den immunologiske synapsen og frigjøres fra den cytotoksiske cellen rettet mot målet (1). Disse granulatene inneholder forskjellige cytotoksiske mediatorer som perforin og granzymes. Utgitt perforin kan danne forbigående porer i målcellemembranen slik at granzymes kan komme inn i målcellen. Oppføring er sannsynligvis også mediert av perforinoligomerer som danner ufullstendige porer (buer) (2), og det har også blitt antydet at granzymer og perforin kan tas opp i målcellene gjennom endosomalveien (3, 4). Dataene bak disse foreslåtte mekanismene har nylig blitt diskutert i detalj (5). Når granzymes går inn i målceller aktiveres caspase-banen, noe som resulterer i apoptose (6, 7). Membranen til disse cytotoksiske granulatene inneholder lysosomalassosiert membranglykoprotein-1 (LAMP1), også Kjent Som CD107a (8). Den luminale delen av rat CD107a blir transientlig eksponert for den ekstracellulære siden av cellemembranen etter degranulering før den igjen internaliseres. Cd107a-farging indikerer derfor at det har oppstått en degranuleringshendelse (9). Mens Rollen For CD107a fortsatt blir bestemt, har siRNA-studier mot CD107a vist at Det er viktig for perforinhandel i vesiklene, da levering av perforin til lytiske granulater hemmes i fravær Av CD107a (10). CD107a har også vist seg å ha en rolle i å beskytte cytotoksiske celler fra død ved å binde seg til perforin og hindre innføring i cellemembranen (11).det finnes to hovedtyper av cytotoksiske lymfocytter, naturlige dreperceller (nk) og CD8 t-celler. Begge celletyper dreper gjennom frigjøring av lytiske granulater, Fas-reseptoren / fas-ligandbanen og STIEN / STIEN reseptorveien, men stimulansen som er nødvendig for å aktivere disse to cellegruppene er forskjellig. T-celler gjenkjenner antigen presentert av MHC klasse I-molekyler gjennom deres aktiverende t-cellereseptor (TCR), MENS NK-celler gjenkjenner målcelleantigener gjennom forskjellige hemmende og aktiverende reseptorer. Inhibitoriske reseptorer er viktige for å forhindre AT nk-celler dreper friske celler mens aktivering av reseptorer induserer nk-cellens cytotoksisitet.
Før identifisering Av CD107a som markør for degranulering I nk-celler (12), var utgangen for måling av cytotoksisk evne død av målcellene. Påvisning Av CD107a ved flowcytometri tillot forskere å identifisere de spesifikke effektorceller med cytotoksisk evne. Siden oppdagelsen har et bredt spekter av publikasjoner av data fra mus og humane studier blitt fullført som viser fordelen av å bruke Et Anti-CD107a antistoff. Rotten er en verdifull immunologisk dyremodell for å studere sykdommer som leukemi og graft vs. vertssykdom (13), men funksjonelle avlesninger har blitt hemmet av mangel på kvalitetsspesifikke Anti-rat CD107a-antistoffer for flowcytometri. Dette papiret beskriver dannelsen av et antistoff mot rotte CD107a og karakterisering av degranuleringsresponsen i rotte NK og CD8+ T-celler.
Materialer og Metoder
Dyr
armenske innavlede hamstere (Cytogen Research and Development Inc., MA, USA) ble plassert Ved Institutt For Komparativ Medisin Ved Rikshospitalet, Oslo Universitetssykehus, i samsvar med institusjonelle retningslinjer. Rottestammene PVG-RT1U, PVG-RT7b, PVG-RT1N og PVG-R23 ble brukt om hverandre og vedlikeholdt i mer enn 20 generasjoner og ble plassert i samsvar med retningslinjer fastsatt av Forsøksdyrstyret under Landbruksdepartementet Og Av Den Europeiske Konvensjonen for Beskyttelse Av Virveldyr som brukes Til Eksperimentelle Og Andre Vitenskapelige Formål. Rotter ble brukt i alderen 8-12 uker. Laboratoriedyreanleggene er underlagt et rutinemessig helseovervåkingsprogram og testet for smittsomme organismer i henhold til En modifikasjon Av Federation Of European Laboratory Animal Science Association anbefalinger. Dyreforsøk ble regulert gjennom laboratorieforskrifter, som er fremsatt Av Dyrevelferdsloven Der Norge følger EUS laboratorieretning og Den Europeiske laboratoriekonvensjonen.
Abs og Reagenser
Antistoffer mot NKp46, NKR-P1A 3.2.3-PB, eller ukonjugert (bindende BARE NKR-P1A, men ikke NKR-P1B, I PVG-stammen), CD8 (OX8-biotin), CD2 (OX34, ukonjugert), TCR (R73-Alexa647), Mus IgD b allotype (TIB96-ukonjugert, brukt som Mus IgG isotype) og CD45.2 (His41-FITC, brukt som Mus IgG isotype) ble laget i vårt laboratorium og konjugert I henhold til standardprotokoller. Antistoffer mot CD3 (IF4, ukonjugert) Og dets isotype mus IgM (MM-30, ukonjugert) og armensk hamster IgG isotype control (HTK88-FITC) ble kjøpt fra Biolegend (San Diego, CA, USA). Kommersielle anti-CD107a-antistoffer ble kjøpt fra AbCam (Cambridge, STORBRITANNIA) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) og Lifespan (Seattle, WA, USA) (LS-C8580-ukonjugert). LS-C8580 ble konjugert Med Alexa488 nhs ester (Sigma-Aldrich, St. Louis, MO, USA) for bruk i funksjonelle analyser. ANTI-FLAGG antistoff (M2, ukonjugert) Og anti-mus IgG (goat polyclonal-FITC) ble kjøpt Fra Sigma-Aldrich (St. Louis, MO, USA). IL-2 ble oppnådd fra en dialysert cellekultur supernatant Av En kinesisk hamster ovarie (CHO) cellelinje stabilt transfisert med en rotte IL-2 uttrykkskonstruksjon. Peridinin Klorofyll-Et Protein (PerCP) konjugert streptavidin, FITC hamster IgG polyclonal isotype control, FITC mouse IgG1 isotype control (MOPC-FITC) og GolgiStop ble kjøpt fra Bd biosciences (Franklin Lakes, NJ, USA). Geit anti-armensk hamster (polyclonal-FITC) ble kjøpt fra Jackson Immunoresearch (West Grove, PA, USA). Supernatanter FRA hybridomene OX41, CD172a (SIRPa), R73 (anti-rat TCRaß), OX19 (anti-CD5), OX12 (anti-Igk kjede) og OX33 (ANTI-CD45RA) ble laget internt. Kontroll hamster serum ble avledet fra u-immuniserte armenske hamstere.
Kloning av rotte CD107a
Rotte CD107a ble PCR forsterket fra cDNA generert FRA PVG rotte splenocytter og subklonert til en pmx uttrykksvektor som inneholder et puromycin resistensgen (en generøs gave Fra Dr. Michael R. Daws) (14). CD107 primere ble designet basert på en rotte CD107a (LAMP1) cDNA sekvens (GenBank: NM_012857). Forward primer: 5′-GCCCCAGCACTGTTCGAGGT-3′; Omvendt primer: 5 ‘- GTTGTTACCGTCCTGTACACACT-3’. ET anionisk trypsin-1-lederpeptid (MSALLILALVGAAVA) ble brukt i uttrykksvektoren, og den opprinnelige CD107-transmembranregionen ble erstattet AV ET CD8-transmembranfragment for å lette høy overflateuttrykk. EN FLAGG-tag (DYKDDDDK) ble ligert Til N-terminalen TIL CD107-proteinet for å gjøre overflateuttrykket detekterbart. Alle innsatte sekvenser og åpen leseramme i den endelige kimære plasmidkonstruksjonen ble undersøkt og bekreftet Ved Sanger DNA-sekvensering.
Overføring AV BWZ.36 Celler med Pmx-CD107a Plasmid
293T celler ble sådd til en 6-brønns cellekulturplate med 4 ml RPMI 1640 medium, transfisert med 7,5 µ fugene6 reagens (Roche, produsentens protokoll) og inkubert ved 37°C med 5% CO2. FuGENE6-reagensen ble forfortynnet Med Opti-Mem (Gibco) og blandet med 1,5 µ pmx-CD107a plasmid og 1 µ pCL-ECO spesifikt retroviralt pakningsplasmid (Addgen #12371). Tjuefire timer etter transfeksjonen ble supernatanten descanted og erstattet MED RPMI1640 medium med 2% FBS og overført til 32°C for retroviral produksjon. Førtiåtte timer senere ble supernatanten høstet og filtrert med et 0.2-µ Filtropur s filter (Sarstedt) og lagret på -80°C for retroviral transduksjon.
Den 105 BWZ.36 celler ble sådd per brønn i en 24-brønncellekulturplate (Corning) og dyrket med fersk RPMI1640 medium med 10% FBS, over natten. Supernatanten ble fjernet OG RPMI1640 inneholdende 10% FBS, 16 µ polybrene (til en endelig konsentrasjon 8 µ/ml), og 1,5 ml retroviral supernatant ble tilsatt og sentrifugert ved 32°C ved 2400 o / min i 2 timer. Cellene ble deretter inkubert ved 32°C i 1 time, hvorpå supernatanten ble fjernet og erstattet med fersk rpmi1640 medium med 10% FBS og dyrket i 3 dager, ved 37°C med 5% CO2 (på dag 2 kunne komplett medium med 1 ng/ml puromycin brukes). Utvidede BWZ. CD107a-FLAGGTRANSFEKTANTER ble undersøkt for overflateuttrykk AV FLAGGMERKET og ble deretter brukt til antistoffimmunisering eller antistoffscreening.
Generering Av CD107a Som Uttrykker Transfektanter
Den kimære rotte CD107a plasmid ble transfisert til CHO-celler. Kort sagt ble cho-celler dyrket i komplett rpmi1640 medium (cRPMI; RPMI1640 medium med 10% FBS, 1mm Na Pyruvat, 50µ 2-merkaptoetanol) til de nådde 30% konfluens. 2,5 µ plasmid ble blandet med 7,5 µ Av Fugen 6 reagens (Roche) og tilsatt dråpevis på celler. To dager etter ble CHO-cellene løsrevet MED RPMI1640 medium supplert med 2MM EDTA og ble sådd ut i 96-brønns flatbunns cellekulturplater (25 celler/brønn) med seleksjonsmedium (cRPMI supplert med 20 µ/ml puromycin) for kloning av stabile transfektanter. Etter 10-12 dagers kultur ble voksne kloner screenet med anti-FLAGG antistoff (M2). En av klonene som uttrykker høyeste overflatenivå AV FLAGG Og CD107a ble brukt til immuniseringer.
Immunisering og Cellefusjon
de 3 til 10 uker gamle mannlige armenske innavlede hamstere ble immunisert ved intraperitoneale injeksjoner (i.p.) med 2 × 106 Cho. CD107a-flaggceller en gang i uken i 3 uker. Et løft med 4 × 106 stabilt transfiserte bwz. CD107a-FLAGGCELLER ble gitt i. p. 32 dager etter første immunisering og sera ble analysert for overflatefarging av BÅDE CHO. CD107a-FLAGG OG BWZ.CD107a-FLAGG transfectants. To av de tre dyrene var positive, og 3 dager etter økning ble miltceller høstet og samlet fra de to dyrene, hvorav den ene hadde splenomegali. Omtrent 2,0 × 108 miltceller og 1,4 × 108 ns0 myelomceller ble vasket tre ganger i DMEM med tilsetningsstoffer (1 mm natriumpyruvat, 0,05 mM 2-merkaptoetanol og antibiotika/antimykotisk) og sentrifugert ved 90 g i 10 min. Holde alt på 37°C fra dette punktet fremover, ble pelleten oppløst ved å tappe røret og forvarmet polyetylenglykol 1500 (Roche) ble tilsatt dråpe for dråpe mens forsiktig omrørt i 1 min. Tre milliliter DMEM med tilsetningsstoffer ble gradvis tilsatt for de neste 3 min etterbehandling med en ekstra 7 ml før sentrifugert ved 500 g. pelleten ble vasket ved forsiktig spyling (ingen resuspensjon) MED DMEM med tilsetningsstoffer og 20% FBS (DMEM-20) og dyrket over natten. Cellene ble høstet neste dag og 100 ml DMEM-20 med 2× hypoksantin-aminopterin-tymidin (SIGMA) og 10% hybridom kloningstilskudd (HCS) (PAA) ble tilsatt. Cellesuspensjonen ble overført til 96-brønnplater. Etter 12 dager ble supernatanter fra voksende kloner testet ved flowcytometri for farging av overflateantigener tilstede PÅ BWZ. CD107a-FLAG og CHO.CD107a-FLAG, men ikke PÅ BWZ.36 celler transfisert med irrelevante FLAGGMERKEDE antigener som negative kontroller. 9 av 12 positive kloner som produserte spesifikke antistoffer ble videre subklonert ved BRUK AV DMEM – 20 supplert med hypoxantin-tymidin og HCS. BARE EN klon (SIM1) produserte fortsatt antistoffer etter subkloning, og dette ble ytterligere subklonert en gang til. CD107a spesifikke hamster IgG antistoffer ble påvist AV FITC anti-armensk hamster IgG (Jackson Immunoresearch). Anti-CD107a FRA SIM1 hybridoma ble renset Av HiTrap Protein G HP (GE Healthcare, Life Sciences) og FITC-konjugert i henhold til standardprosedyrer eller Alexa488-konjugert i henhold til produsentens protokoll.
Generering Av Effektorceller
Enkeltcellesuspensjoner ble fremstilt fra milten. Lymfocytter ble isolert ved Hjelp Av En Lymfoprep-gradient og deretter kjørt over en nylonullsøyle for å fjerne B-celler og makrofager. For generering AV IL-2-aktiverte nk-celler (LAK) ble de resterende cellene dyrket over natten i IL-2. Dagen etter ble ikke-adherente celler fjernet ved vask MED PBS og de adherente nk-cellene ble opprettholdt i RPMI supplert MED IL-2, 10% varmeinaktivert FBS, 1% Streptomycin / Penicillin, 1 mm natriumpyruvat og 50 µ 2-merkaptoetanol. Celler ble dyrket i 8-10 dager. For generering av berikede nk-celler eller sorterte t-og NK-celler ble cellene beriket med negativt utvalg etter nylonullstrinnet. For anrikning AV nk-celler ble pan-mouse IgG-Dynabeads (Invitrogen Dynal) belagt med antistoffer mot makrofager (OX41), T-celler (R73 OG OX19) og B-celler (OX12 OG OX33). For anrikning av T-celler ble pan-mouse IgG Dynabeads farget med antistoffer mot makrofager (OX41) Og B-celler (OX12 OG OX33). Cellene ble beriket av to trinn med negativt utvalg med farget perler for 30 min ved 4°C. Beriket NK celler hadde en renhet på ca 50-60% og ble brukt for degranulation studier. Beriket T-celler (79-85% renhet) ble videre sortert FOR TCR + celler ved HJELP AV EN FACS Aria (BD Biosciences).
Degranulasjonsanalyser
for å måle degranuleringsresponsen ved farging Med Anti-rat CD107a (SIM1) under målcellestimulering ble NK-effektorer og yac-målceller inkubert, med et 1 til 1-forhold på 3 × 105 celle / brønn (med mindre annet er angitt) i medier som inneholder SIM1 mAb, de andre kommersielt tilgjengelige anti-CD107a-antistoffene eller isotypekontroll. For å måle degranuleringsresponsen på antistoffstimulering fra nk-celler brukte vi flatbunnsplater på 96 brønner belagt med varierende konsentrasjoner av anti-nkp46 (Wen23), anti-NKR-P1A (3.2.3) og en Mus IgG1 isotypekontroll (TIB96). Dagen etter ble platene vasket MED PBS og blokkert med cRPMI før det ble tilsatt 3 × 105 berikede nk-celler suspendert i cRPMI inneholdende SIM1 per brønn. For å måle degranulering fra T-celler ble de sortert og dyrket i cRPMI MED IL-2 i 2-3 dager. De 96-brønns flatbunnsplatene ble belagt over natten med antistoffer MOT CD3 (IF4), CD2 (OX34) eller En IgM isotypekontroll (MM-30). Det ble lagt til om lag 3 × 105 t-celler per brønn i cRPMI som inneholdt SIM1. Alle analyser ble inkubert for 4 h. Golgistop ble tilsatt for den siste 3 h av inkubasjon for å forhindre nedbrytning av internalisert CD107a. Celler ble deretter vasket og farget med antistoffer mot de aktuelle overflatereseptorene og analysert ved HJELP AV FACS Canto ELLER LSR II (BD Biosciences).
Kromfrigjøringsanalyse
YAC-1 målceller (5 × 106 celler/ml cRPMI) med tilsatt 3.7 MBq51Cr ble inkubert ved 37°C i 1 time, omrørt hvert 15. minutt. Cellene ble deretter vasket tre ganger med PBS med 2% FBS og resuspendert til 1 × 105 celler / ml i cRPMI. Lak effektorceller og målceller ble belagt med de angitte forholdene i et endelig volum på 200 µ. Cellene ble sentrifugert og inkubert i 4 timer ved 37°C. Spesifikk frigivelse av 51Cr ble målt ved Bruk Av Cobra auto-gamma (Packard).
Resultater
for å skape et antistoff mot CD107a, laget vi en ekspresjonsvektor som inneholder den ekstracellulære membranregionen av rotte CD107a, den transmembrane regionen av rotte CD8 og en 3 ‘ – terminal FLAGG-tag for å oppdage overflateuttrykk (Figur 1a). Vektoren ble overført TIL CHO-celler og BWZ.36 t celle linje og screenet For CD107a uttrykk ved hjelp av en ANTI-FLAGG antistoff (M2) (Figur 1b). CD107a stabilt transfiserte CHO-celler ble injisert i armenske innavlede hamstere en gang i uken i 3 uker med en endelig økning På CD107a stabilt transfiserte BWZ-celler 3 dager før fusjon MED ns0 myelomcellelinjen. Supernatanter fra de forskjellige klonene ble testet for spesifisitet mot BWZ. CD107a-FLAGG, men ikke irrelevant FLAGGMERKET BWZ.36 transfektanter. EN klone, SIM1, ble funnet å binde seg spesifikt Til CD107a uttrykker transfektant, men ikke TIL FLAGGET transfected kontroll (Figur 1c).

Figur 1. Generering Av Et Anti-rotte CD107a monoklonalt antistoff (SIM1). (A) Skjematisk vektorkart av pmx uttrykk vektor med leder peptid, FLAGG-tag, CD107a innsats, og transmembrane domenet TIL CD8. (B) Stabilt transfektert kinesisk hamster ovarie og BWZ.36 celler ble testet for celleoverflateuttrykk AV FLAGGMERKET CD107a ved bruk av et ANTI-FLAGG antistoff (M2) (skyggelagte histogrammer). Negativ kontroll er sekundært antistoff alene (gjennomsiktig histogram). Bwz-celler transfisert Med CD107a-FLAG eller irrelevant antigen (NKR-P1F-FLAG) ble farget med hamster control serum, SIM1 supernatant eller Et ANTI-FLAG antistoff (M2).klonen SIM1 ble ytterligere testet i funksjonelle analyser parallelt med to kommersielt tilgjengelige CD107a antistoffer, som potensielt kunne kryssreagere Med rotte CD107a i flowcytometri. Antistoffklonene som ble testet var H4A3 Fra AbCam (som kryssreagerer med mennesker, rotter, mus og primater i flowcytometri) og antistoffklonen LS-C8580 fra LifeSpan BioSciences (som kryssreagerer Med CD107a fra mus, mennesker og rotter i immunhistokjemi og Western blots i henhold til produsentens nettsted). VÅR SIM1 antistoff klon identifisert degranulating celler i nærvær av målceller og viste lite bakgrunnsfarging i fravær av mål (øvre panel Figur 2a). Clone H4A3 farget den høyeste prosentandelen av nk-celler etter målcellestimulering (midtpanel). Imidlertid var det også et høyt nivå av bakgrunnsfarging i fravær av målceller, noe som indikerer uspesifikk binding. Svært lave nivåer av degranulering, om noen, ble målt AV ls-C8580 mAb klonen (nedre panel). Specificiteten av disse antistoffene ble bekreftet ved positiv farging AV BWZ. CD107a-FLAGGTRANSFEKTANT, men IKKE BWZ.NKR-P1F-FLAGGKONTROLL (Figur 2b). Antistoffklonen H4A3, som har vist seg å binde seg til humane CD107a (16), flekkte ikke rotte CD107a-transfiserte bwz-celler, noe som indikerer at det ikke er kryssreaksjon med rotte CD107a. Anti-mus CD107a-klonen ID48 klarte heller ikke å flekke rotte CD107a-transfektanten. Ukonjugert LS-C8580 viste derimot spesifikk farging Av CD107a transfiserte celler (data ikke vist). LS-C8580 klonen er imidlertid bare tilgjengelig som ukonjugert antistoff som ikke er egnet for degranulasjonsstudier. Gjentatte forsøk i vårt laboratorium for å konjugere LS-C8580 Til Alexa488 har dessverre ikke gitt noen sterke fargekonjugater, selv om den lille prøvestørrelsen og konsentrasjonen AV LS-C8580 kan være årsaken til den dårlige konjugasjonen. Konjugert LS-C8580 viser redusert, men spesifikk farging Av CD107a transfiserte celler (Figur 2b), men som vist I Figur 2A, var vi ikke i stand til å oppdage degranulerende celler under funksjonelle analyser med dette konjugatet. TIL slutt flekker SIM1 mAb spesielt degranulerende rotte NK-celler etter stimulering med målceller.

Figur 2. SIM1 måler degranulering fra natural killer (NK) og CD8 t-celler. (A) Prosent degranulerende celler ble målt ved bruk av Anti-CD107a antistoffer SIM1, H4A3 og LS-C8580, MED ELLER uten YAC – 1 målceller som stimulus. Et representativt eksperiment på fire er vist (B). Farging AV BWZ. CD107a-FLAGGCELLELINJEN MED SIM1, H4A3, LS-C8580 eller ID48 antistoffkloner. BWZ.36 celler transfisert med irrelevant FLAGG-merket antigen (BWZ.NKR-P1G-FLAG) ble inkludert som negativ kontroll, (C) anrikede nk-celler ble stimulert med platebundet anti-NKp46, anti-NKR-P1A eller Mus IgG1 som isotypekontroll, OG SIM1 ble brukt til å måle prosentvise degranulerende celler. Nkp46 + (Wen23) eller NKR-P1Abright (3.2.3) celler ble inngjerdet. (D) tcr+ – celler ble sortert (renhet 99%) og dyrket I IL-2 i 2-3 dager. Cellene ble deretter stimulert med platebundet anti-CD3 og anti-CD2 Eller mus IgM isotype kontroll for anti-CD3. Det nedre panelet viser stimulering med ANTI-CD3 og anti-CD2 og flekker MED EN sim1 isotype kontroll (FITC hamster IgG polyclonal). T-celler ble sortert ved hjelp Av r73-Alexa647 og 3.2.3-PB antistoffer, gating På R73+ / 3.2.3-celler. Data som vises er fra ett representativt eksperiment av tre separate uavhengige eksperimenter.Direkte stimulering av aktivering AV nk-reseptorer gjennom platebundne antistoffer er en annen potent metode for å indusere degranulering. FOR å teste SIM1-klonen i denne funksjonelle analysen inkuberte VI berikede nk-celler på plater belagt med antistoffer mot de aktiverende reseptorene NKp46 og NKR-P1A (Figur 2c). Som en negativ kontroll ble platene belagt med mus IgG1 isotype kontroll. Farging MED SIM1-antistoffet identifiserte 25,5 eller 44% degranulerende celler etter nk-cellestimulering i plater belagt med henholdsvis 5 µ/ml anti-NKp46 eller anti-NKR-P1A. Prosentandelen av degranulerende celler økte ytterligere når platene ble belagt med en høyere konsentrasjon av stimulerende antistoffer (10 µ/ml). Ingen degranulering ble indusert i brønner belagt med mus IgG1 isotype kontroll.Vi så tydelig degranulering i nk-celler stimulert med enten målceller eller med antistoffer mot aktiveringsreseptorer ved Å bruke VÅRT SIM1-antistoff. Vi ønsket også å bekrefte dette i cytotoksiske T-celler. T-celler ble sortert fra miltceller og dyrket I IL-2 i 2-3 dager. T-cellene ble deretter stimulert med platebundet anti-CD3 og anti-CD2 (Figur 2d). Degranulering ble målt fra dyrkede CD8+ t-celler når stimulert med anti-CD3 og anti-CD2 på begge dagene 2 og 3. Ingen degranulering ble målt fra IKKE-cytotoksiske CD4 T-celler, eller etter stimulering med isotypekontrollantistoff, noe som ytterligere demonstrerte spesifisiteten til VÅRT SIM1-antistoff.Lymfokinaktiverte dreperceller (Lak) opprettes ved å dyrke NK-celler I IL-2 i 7-10 dager og brukes ofte som svært potente effektorceller i kromfrigjøringsanalyser for å studere cytotoksisitet og bør derfor kunne generere høye nivåer av degranulering. For å måle degranulering fra lak-celler brukte vi først en 1:1 forholdet mellom effektor til mål, men fant uventet lave nivåer av degranulering(data ikke vist). Ved å gjøre en titrering for å finne optimal effektor til målforhold, så vi at økende nivåer av degranulering kunne oppnås når effektor til målforhold var under 1 (Figur 3A). Det optimale forholdet for degranuleringsanalyser er derfor i motsetning til cytotoksisitetanalyser der nivået av cytotoksisitet øker med høyere effektor: målforhold( Figur 3B).
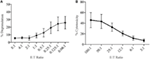
Figur 3. Lav effektor:målforhold er viktige for å sikre tilstrekkelig sensitivitet i degranulasjonsanalyser med rotte nk-celler. (A) Degranulering AV lak-celler dyrket 8-10 dager I IL-2 mot YAC-1-mål ved forskjellige effektor: målforhold. (B) Cytotoksisitet AV IL-2 kultivert LAK mot YAC-1 målceller ble bekreftet med chromium release assay fullført på dag 8-10. Alle grafer er kumulative av tre eller flere separate eksperimenter med barer som viser SD.
Diskusjon
i den innledende testing AV SIM1 og de forskjellige kommersielle CD107a antistoffer i degranulation analyser i rotte, valgte vi et lite utvalg av effektor til målet forholdstall med en skjevhet mot flere effektor celler enn mål basert på gjeldende litteratur (12, 16, 17). Effektor til målcelleforhold kan variere fra papir til papir, men tidligere studier som titrerte effektor til målforhold har vist at optimal degranulering fra MUSENS nk-celler toppet ved 4,5:1-forhold med YAC-1-målceller (18) og humane nk-celler drepte K562-celler best i et forhold på 5:1 eller 10:1 (12). Men når vi bruker et større utvalg av effektor til målforhold, viser vi at degranulering ved bruk av rotte lak-celler ble mer effektivt indusert ved bruk av fire eller flere mål per effektorcelle. Denne forskjellen i optimal effektor:målforholdet mellom rotte og andre arter kan skyldes typen målceller som brukes, da human og mus effektor til målforhold titreringer i de ovennevnte studiene brukte målceller som stammer fra samme art. Effektorcellene kan være mer følsomme for målceller fra samme art og trenger derfor færre målceller for å bli aktivert. YAC – 1-cellelinjen som brukes i vår studie er et Mus-t-cellelymfom, som i mange år har vært standard for å stimulere cytotoksisitet fra rotte-nk-celler. Vi kan ikke utelukke at bruk av en rottemålcelle vil resultere i sterkere stimulering AV nk-cellene, og senere kan det være behov for færre målceller for å indusere degranulering.
det er også klart fra denne studien at effektor-til-mål-ratioene som brukes for cytotoksisitetsanalyser, ikke korrelerer godt med forholdene som trengs for å måle optimal degranuleringsrespons i effektorcellene. Dette er ikke overraskende da lesingen for disse to analysene er forskjellige, med cytotoksisitet som måler målcelledød, og degranulering som måler NK-responsen på mål.som konklusjon har vi hevet et antistoff mot rotte CD107a (SIM1) og karakterisert dets evne til å oppdage degranulering i cytotoksiske lymfocytter hos rotte. VI har vist AT SIM1 er spesifikk for degranulerende celler, og gjennom optimalisering av degranulasjonsprotokollen har vi bestemt at bruk av effektor: målcelleforhold lavere enn 1:4 sikrer optimal stimulering av lak-celler. Utviklingen Av Anti-rotte CD107a (SIM1) tillater bedre analyse og karakterisering av cytotoksiske responser av rotte lymfocytter og vil være et verdifullt verktøy i de mange sykdomsmodeller av rotte.
Etikkerklæring
studien er godkjent Av Dyreforskningsmyndigheten (Fdu), norge (tillatelsesnummer: ID-1698).
Forfatterbidrag
AS har vært ansvarlig for uttrykksanalyse, funksjonelle analyser og skriving av manuskriptet. K-ZD har utført cDNA kloning og generering av transfektanter. JTV har vært involvert i prosjektering og veiledning, og i skrivingen av manuskriptet. LK har vært ansvarlig for vaksinasjoner, hybridomteknologi, skriving av manuskriptet og prosjekttilsyn.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Takk
forfatterne takker Ulla Heggelund Og Stine Martinsen for teknisk assistanse i laboratoriet, og de ansatte ved dyreanlegget Ved Institutt For Sammenlignende Medisin Ved Rikshospitalet, Oslo Universitetssykehus for hjelp med vaksinasjoner. Takk Til Marit Inngjerdingen for vitenskapelige diskusjoner.
Finansiering
forskningen er finansiert av Universitetet I Oslo, Helse Sør-Østlandet (2009104), Og Legatet Til Henrik Homans Minde.
1. Oransje JS. Dannelse og funksjon av lytisk NK-celle immunologisk synapse. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038 / nri2381
PubMed Abstrakt | CrossRef Fulltekst/Google Scholar
2. M, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Perforinporer i endosomalmembranen utløser frigjøring av endocytosert granzyme B i cytosol av målceller. Nat Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
5. Voskoboinik jeg, Whistock JC, Trapani JA. Perforin og granzymes: funksjon, dysfunksjon og human patologi. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Jm, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT, et al. EN annen profylaktisk MHC-mismatched benmargstransplantasjon beskytter mot rotte akutt myelogen leukemi (bnml) uten dødelig graft-versus-host sykdom. Transplantasjon (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
Pubmed Abstrakt | CrossRef Fulltekst | Google Scholar
14. J. m., J. M., Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Anvendelser av retrovirus-mediert uttrykk kloning. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Redusert degranulering AV nk-celler hos pasienter med hyppig tilbakevendende herpes. Clin Vaksine Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Tre Sm, Bj Hryvrkströ Nk, Lang EO, Et al. Funksjonell analyse av humane nk-celler ved flowcytometri. Metoder Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
