Innføring av celle syklus inhibitor
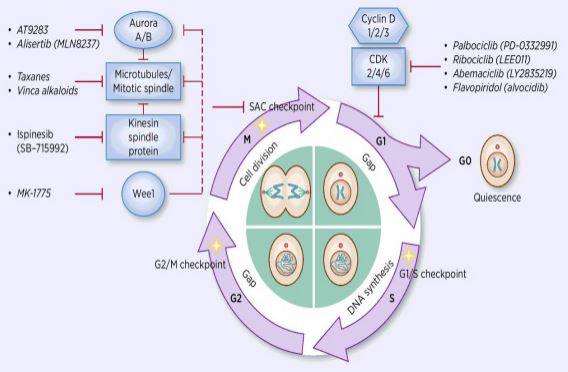
prosessen med celle syklus regulering er aktivering eller inaktivering av ulike regulatoriske faktorer under overvåking av sjekkpunkter, og dermed initiere prosessen med celle DNA replikasjon og deling i to datterceller. Blant mange cellesyklusregulatorer er syklinavhengig kinase (CDK) kjernen, og det er et nettverkssystem som regulerer cellesyklusen med syklin og syklinavhengige kinasehemmere (CKIs). Cdk er en klasse av serin / treoninkinaser,og for tiden finnes 13 arter, inkludert CDK1~13, som spiller en rolle i cellesyklusregulering Av Cdk og transkripsjonell regulering av Cdk. Reguleringen av cellesyklusen er faktisk reguleringen av kontrollpunkter, Med G1 / S reguleringspunkter som de viktigste. Når cellesyklusen stimuleres av eksterne signaler som vekstfaktorer, bindes den katalytiske UNDERENHETEN CDK4/CDK6 til Den regulatoriske Underenheten CyclinD, Og CDKs-rester aktiveres ved fosforylering / defosforylering. Etter aktivering Av CDKs fosforyleres rb-proteinet. Rb-genet, også kjent som retinoblastomgenet, er det første klonede tumorsuppressorgenet, og dets evne til å danne et kompleks med transkripsjonsfaktorer (SOM E2F) etter at fosforylering av proteinet er tapt. E2F spiller en viktig rolle i cellesyklusregulering og induserer uttrykket Av Cyklin og CDK2 og danner Et Cyklin / CDK2-kompleks, som videre fosforylerer Rb-protein og fullstendig frigjør E2F.Deretter går E2F inn i kjernen for å aktivere en serie cellesykluser i s-fase. I SEN FASE AV DNA-replikasjon under s-fasen aktiveres CDK2 av syklin, som inaktiverer transkripsjonsfaktor E2F i tide, og forhindrer apoptose forårsaket av vedvarende aktivert E2F. Forskningsstatistikk viser at mer enn 90% av humane kreftformer har mutasjoner i relaterte gener I CDK -, Cyclin -, CKI-og Rb-banene, MED CDK og tilhørende regulatoriske Underenhet Cyclin som den hyppigst dysfunksjonelle. I tillegg fremmer svingninger i cellesyklusen kjemoterapiresistens og reduserer effekten av kjemoterapi. Derfor er reguleringen AV CDK / Syklinaktivitet, som gjenoppretter normal cellesyklus, en av strategiene for behandling av svulster.Legemiddelforskere har fokusert på å finne FORSKJELLIGE TYPER CDK og Syklinhemmere som banebrytende anti-kreft medisiner. FOR TIDEN ER CDK-hemmere hovedsakelig delt inn i det endogene og det eksogene. Den største klassen av endogene småmolekylinhibitorer er proteiner med lav molekylvekt, som er klassifisert i to brede kategorier i henhold til forskjeller i strukturelle funksjoner, og en klasse kalles dual specific family INK4, inkludert p15, p16, p18, p19, som hemmer proteinfamilien. Det hemmende avhengige proteinet av Cyklindassosiert kinase binder seg til det korresponderende FRIE CDK4, og blokkerer dermed bindingen AV CDK4 til det korresponderende cyklindet for å danne et katalytisk dimer-kompleks. Den andre klassen kalles Kip-familien, inkludert P21, P27, P57. Denne proteinfamilien kan danne en trimer med et dimerisk kompleks bestående av cyclin E / CDK2 og cyclin/CDK1, ved å blokkere det katalytisk aktive sentrum av dimeren. Inhibering av disse endogene inhibitorene, når de kombineres med kinasekomplekset, regulerer spesifikt sin aktivitet, og regulerer dermed nøyaktig cellens transformasjon Fra G1 til s-fase. Studier har vist at forekomsten og utviklingen av flere svulster er forbundet med redusert ekspresjon Av CDKs/cykliner eller redusert ekspresjon av endogene hemmere, som sletting Av P16, som har forhold til utvikling av melanom, lungekreft, brystkreft og kolorektal kreft. Sletting Av P27-protein er vanlig ved brystkreft, prostatakreft, tykktarmskreft og gastrointestinal kreft. Derfor er sletting av endogen CDKs-hemmer eller genmutasjon en viktig referanse for svulstdiagnose. Endogene småmolekylhemmere er også en klasse av viktige ikke-kodende Rna oppdaget de siste årene. Målområdene binder seg til hverandre for raskt og effektivt å nedbryte mRNA eller hemme oversettelse av proteinet, kontrollere proteinet på et lavere eller optimalt nivå og kreve livsaktiviteter. Mer enn 10 mikrornaer har blitt oppdaget involvert i cellesyklusregulering. Blant dem, miR1-2 og miR3-4 mål CDK4, henholdsvis, og cellesyklusen blir arrestert I g1-fasen, som hemmer tumorcelleproliferasjon; miR-22 mål CDK6-celler. Syklusen er stillestående I g1-fasen, noe som induserer senescens i brystkreftceller. I forskjellige biologiske prosesser regulerer disse mirnaene cellesyklusprogresjon ved å målrette E2F, CDK,Cyclin, P21, P27, DNA-polymerase alfa, etc. å fremme eller blokkere nøkkelregulatorer av cellesyklusen. Eksogene inhibitorer inkluderer antisens nukleinsyrer, antistoffer, små interfererende rna-interferens (siRNA) og små molekylforbindelser. Små molekylforbindelser er den viktigste klassen av eksogene CDK-hemmere. I de senere år, som forståelsen av krystallstruktur tillater folk å gjennomføre molekylære simuleringsstudier, har gjennombrudd blitt gjort i design og utvikling av svært effektive og selektive studier på kjemiske hemmere Av CDKs. Det kan sies at slike forbindelser har nye medlemmer hver dag. FOR tiden KAN CDK-hemmere med SMÅ molekyler deles inn i følgende 13 kategorier, Roscovitine Og Olomouc, Pyrimidiner (pd-033299), Flavonoider (Flavopiridoler), Tiazoler (SNS03), antracen og dets derivater (SU951), piperidon (Paullones), imidazopyridin, pyrazolopyridin (AZ703), pyraziner ( AT751), butyrolakton-1 (butyrolakton-1), skorpionin (ucn-01) Og Andre To Arter. Tretten små molekylhemmere har gått inn i kliniske studier. De er alle småmolekylære kjemikalier av plan heterocykler som konkurrerer MED ATP for binding TIL ATP-bindingsstedet FOR CDK-kinase. In vivo eksperimenter viste AT CYC202 har god medikamentresistens og god oral fysiologisk aktivitet og har åpenbare hemmende effekter på solide svulster i nakne mus inokulert av humane tykktarmskreft og livmor kreftceller. I Fase Ib-studier tok 10 pasienter MED eggstokkreft CYC i mer enn 20 måneder, uten økning i svulster eller alvorlige behandlingsrelaterte bivirkninger, blant annet en pasients svulst har krympet med mer enn 30%, og noen pasienter som har blitt behandlet i mer enn ett år har en stabil tilstand. Fase II kliniske studier har funnet AT CYC202 alene har en litt dårligere effekt og er effektiv i kombinasjon med andre kjemoterapeutiske legemidler. Fase IIB kliniske studier AV CYC202 i kombinasjon med kapecitabin for behandling av brystkreft, kombinert med 2,2-difluorodeoksycytidin eller cisplatin for behandling av lungekreft og nasofaryngeal karsinom pågår også. Utviklingen OG anvendelsen av småmolekyl RNA-interferensteknologi har gjort det mulig å studere genuttrykket av spesifikke intervensjonsmålmolekyler, og mange forskere har begynt å gripe inn i syntesen AV CDK / Cyclin på genetisk nivå. Limaet al. transfektert CyclinE-målretting siRNA I Hep3B, HepG2, SNU449 (CyclinE overexpression) Og HuH7 (CyclinE overexpressed) og fant At CyclinE uttrykk ble redusert med 90% i celler. DNA-syntese er betydelig redusert, og celler gjennomgår apoptose. Galimberti et al. transfisert siRNA målretting CyclinE, CDK2 OG CDK1 i mus lungekreftceller HOP-62, H-522 og H-23, henholdsvis, og fant At CyclinE / CDK2 kan indusere apoptose og hemme spredning av lungekreftceller. Redusert CDK1 uttrykk forårsaket AV CDK1 siRNA interferens bare forårsaker celle fase arrest og bremser celleproliferasjon; MENS CDK1 og CDK2 siRNA co-interferens føre til en samtidig reduksjon AV CDK1 og CDK2 uttrykk, forårsaker motstand i celle syklus s og G2/m faser. Stagnasjonen induserte også apoptose av cellene. Cao Yinfang og annen vellykket transfeksjon AV CDK2/Cyklin siRNA rekombinant ekspresjonsvektor i HepG2-celler viste AT CDK2 og Cyklin mRNA-ekspresjon sank signifikant, cellesyklusen ble stoppet i s-fase, G1-faseceller økte signifikant, caspase-3-aktivitet økte, HepG2-celler gjennomgikk apoptose, og cellesyklusendringer var konsistente med redusert proliferasjon Av HepG2-celler sin vitro etter transfeksjon.
funksjon av cellesyklusinhibitor
med dypere forståelse av den viktige rollen av cellesyklusregulering i tumordannelse og apoptose, har cellesyklusregulering blitt ytterligere studert i tumor kjemoterapi resistens. Syklinavhengige kinaser (Cdks), som spiller en rolle i å drive cellemotoren under cellesyklusen, er ideelle mål for tumorbehandling. De fleste kreftcellene har aktivering, overuttrykk av celledeling syklus (cdk) genet og defekter I CDKIs funksjon. CDK-inhibitoren utøver en pause som hemmer cellesyklusen. I de senere år Har CDKIs blitt et stort høydepunkt i kreftbehandling, som hemmer Aktiviteten Til CDKs i cellesyklusen. En rekke kliniske studier har også vist at en enkelt applikasjon kan ha moderate effekter. I kombinasjon med tradisjonelle cytotoksiske kjemoterapeutiske legemidler Kan CDKIs imidlertid øke antitumoreffekten av tradisjonelle kjemoterapeutiske legemidler betydelig. Derfor har forskning på kreftvirkninger Av CDKIs-legemidler og andre kjemoterapeutiske stoffer blitt et sted i dagens behandling av tumorresistens.Bendris N, Lemmers B, Blanchard J M. Cellesyklus, cytoskelettdynamikk og utover: de mange funksjonene til sykliner og CDK-hemmere. Celle Syklus. 2015, 14(12):1786-1798.
