Ladningsoverføringskomplekser viser ladningsoverføringsoverganger der absorpsjon utløser overføring av et elektron fra giveren til akseptoren.
når jod oppløses i løsninger av donorløsningsmidler, erstattes den slående lilla fargen på molekylær jod med en gulbrun farge. Dette skyldes at ladningsoverføringskomplekser som de dannet av \(I_2\) kan absorbere lys på måter som verken giveren eller akseptoren kan alene. Spesielt viser ladningsoverføringskomplekser ladningsoverføringsbånd (CT-bånd) i deres absorpsjonsspektra. I ladningsoverføringsovergangen skyves den første delvise overføringen av ladning fra Donor Lewis-basen til Akseptor Lewis-syren i ladningsoverføringskomplekset videre ved fotoeksitasjon.arten av disse ladningsoverføringsovergangene er sett fra den orbitale beskrivelsen av binding for jodladningsoverføringskomplekser. Når et donor-I2-kompleks danner dannelsen av donor-I2-binding og antibonderende orbitaler, resulterer det i et skifte i\(I2 \ sigma \rightarrow\ sigma*\) overgang til høyere energi a dannelsen av et nytt ladningsoverføringsbånd assosiert med eksitasjon av et elektron fra den stort sett amin-sentrerte amin-I2 \(\sigma\) orbitale til den stort Sett i2-sentrerte amin-i2 \(\sigma*\) orbitale.
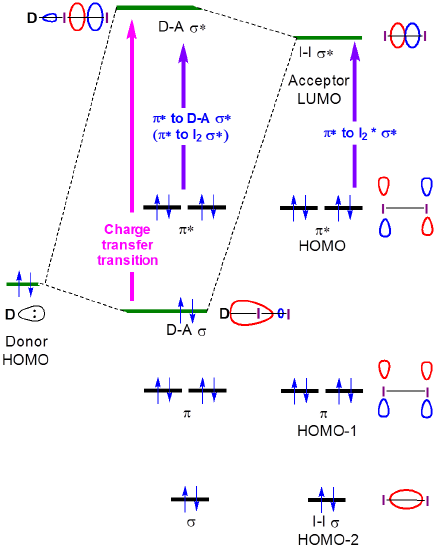
Figur 6.4.2.\ (\PageIndex{2}\). Frontier orbital interaksjoner som gir opphav til endringer i absorpsjonsspektrene av jod når det danner et ladningsoverføringskompleks med En Lewis-basedonor.
Løsninger Av I2 som blandinger Med Lewis baser som aminer og i donor løsemidler klart lade overføring bånd. Flere slike spektra er gitt i Figur 6.4.2.3.
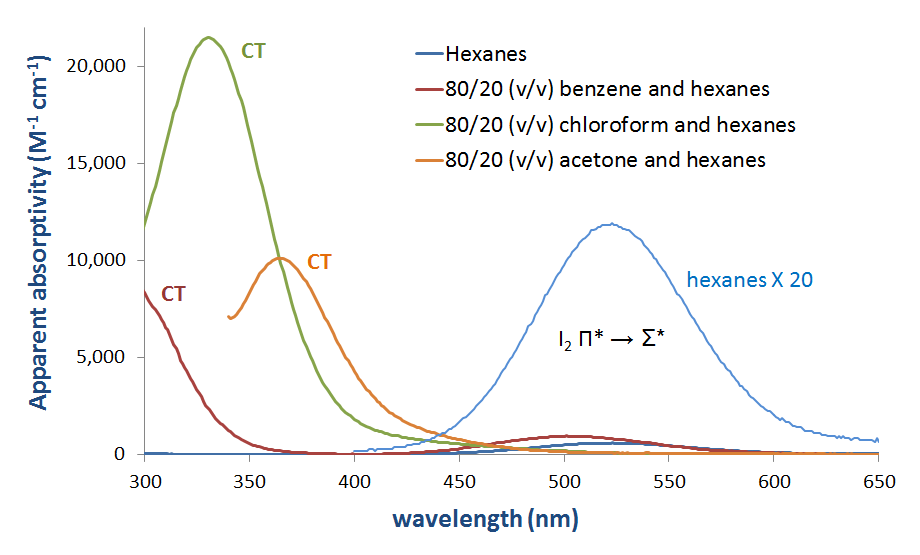
Figur 6.4.2.\ (\PageIndex{3}\). Absorpsjonsspektrum av molekylært jod (I2) i forskjellige løsningsmidler som viser utseendet TIL ET CT-bånd i donorløsningsmidler.*
i prinsippet øker energiene til både ladningsoverføringen og \(i_2~\pi * ~\rightarrow ~D-A~ \sigma*\) overganger begge med donorstyrke, som vist i Figur 6.4.2.4.
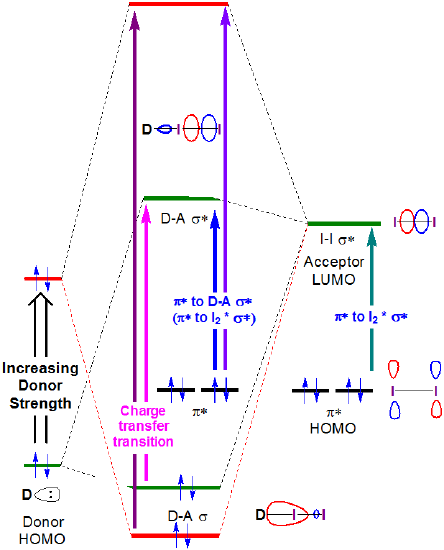
Figur 6.4.2.\ (\PageIndex{4}\). Forventet endring i frontier orbital energier assosiert Med i2 donor akseptor kompleks formasjon når HOMO energi av donor økes.
som det fremgår Av Figur 6.4.2. ladningsoverføringsbåndsenergien kan forventes å øke etter hvert som donor HOMO øker i energi for å bli nærmere i energi til akseptor LUMO. Selv om det bør utvises forsiktighet ved tolkning av løsningsfasespektrene Av I2, bæres denne forventningen ut av en kortfattet og kvalitativ analyse av spektrene i Figur 6.4.2.3. CT overgang energi skifter mot lavere bølgelengder (og dermed høyere energi) som den høyeste okkuperte atom orbital energi for donor atom øker på å gå fra aceton (oksygen, -15.85 eV) til kloroform (klor, -13.67 eV) og til slutt benzen (karbon, -10.66 eV).**
Charge Transfer Bands In Transition Metal Chemistry
Charge Transfer transitions er ansvarlig for den intense fargen på mange overgang metall komplekser. I disse tilfellene innebærer imidlertid den svake Lewis-syrebaseinteraksjonen ufullstendig elektrondonasjon og aksept i en \(p \pi-d\ pi\) (eller\(p\pi-d\pi*\))-binding mellom et metall og ligand. Ladningsoverføringsbåndene i absorpsjonsspektrene til disse kompleksene involverer overføring av elektroner mellom metall og ligand. Spesielt
- Metall til ligand charge transfer (MLCT eller CTTL) band innebære overføring av et elektron fra en fylt eller delvis fylt metall d orbital til en ligand\(\pi*\)-type orbital.

- Ligand til metallladningsoverføring (LMCT eller CTTL) bånd involverer overføring av et elektron fra en fylt eller delvis fylt ligand orbtial til en metall d-orbital.

- overføringsbånd Av metall til metall kan observeres i noen bimetalliske komplekser. Imidlertid er disse vanligvis bare tenkt som en elektronoverføring enn som et skifte i statusen For En Lewis syre-base-interaksjon.
fordi metall-ligand-ladningsoverføringsbånd involverer intermolekylær elektronoverføring mellom metall og ligand for å generere en høy energi redoks-tilstand, ER CT-eksitert tilstand både en bedre oksidant og reduktant enn grunntilstanden. Følgelig har det vært intens forskning på utvikling av metallkomplekser hvis ladningsoverføringsspente tilstander er kraftige oksidanter og reduktanter i forventning om at de vil kunne drive fotokatalytisk oksidasjon og reduksjon av substrater.
* tilsynelatende absorptivitet av i2 i heksaner ble beregnet ut fra absorpsjonsspekteret på 215 µ i2 i heksaner. Alle andre tilsynelatende absorberende egenskaper ble beregnet ut fra absorpsjonsspekter av oppløsninger som var 44 µ i I2.
* * båndposisjonene er ikke CT-båndenergiene, OG HOMO-energiene som er gitt er atomenerginivåer og samsvarer ikke nødvendigvis MED DONORENS HOMO i løsningen. På grunn av dette og andre forenklinger denne analysen er ikke ment å erstatte en streng beregningsanalyse av de faktorer som gir opphav TIL CT band posisjoner.
1. Meyerstein, D.; Treinin, A., Ladningsoverføringskomplekser av jod og uorganiske anioner i oppløsning. Transaksjoner Av Faraday Society 1963, 59 (0), 1114-1120.
2. A. V., A. V., A. V., A. V., A. V., A. V., A. V., A. V., A. V., A. V., A. V., A. V., A. V.; Jaccobb, M.; RoopSingh, D.; Kannappan, V., Eksperimentell og teoretisk analyse av substituent effekt på ladningsoverføringskomplekser av jod og noen alkylbenzener i n-heksanløsning VED 303K. Kjemiske Datainnsamlinger 2017, 7-8, 80-92.
