Læringsmål
- Skriv kjemisk formel for en enkel ionisk forbindelse.
- Gjenkjenne polyatomiske ioner i kjemiske formler.
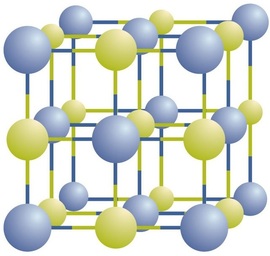
Vi har allerede møtt noen kjemiske formler for enkle ioniske forbindelser. En kjemisk formel er en kortfattet liste over elementene i en forbindelse og forholdene mellom disse elementene. For bedre å forstå hva en kjemisk formel betyr, må vi vurdere hvordan en ionisk forbindelse er konstruert fra dens ioner.Ioniske forbindelser eksisterer som vekslende positive og negative ioner i vanlige, tredimensjonale arrays kalt krystaller(Figur \(\PageIndex{1}\)). Som du kan se, er det ingen individuelle \(\ce{NaCl}\) «partikler» i arrayet; i stedet er det en kontinuerlig gitter av vekslende natrium-og kloridioner. Vi kan imidlertid bruke forholdet mellom natriumioner og kloridioner, uttrykt i lavest mulig hele tall, som en måte å beskrive forbindelsen på. I tilfelle av natriumklorid er forholdet mellom natriumioner og kloridioner, uttrykt i laveste hele tall, 1:1, så vi bruker \(\ce{NaCl}\) (ett \(\ce{Na}\) symbol og ett\ (\ce{Cl}\) symbol) for å representere forbindelsen. Således er \(\ce{NaCl}\) kjemisk formel for natriumklorid, som er en kortfattet måte å beskrive det relative antall forskjellige ioner i forbindelsen. En makroskopisk prøve består av myriader Av nacl-par; hvert enkelt par kalles en formelenhet. Selv om det er praktisk å tro at \(\ce{NaCl}\) krystaller består av individuelle\ (\ce{NaCl}\) enheter, Viser Figur \(\PageIndex{1}\) at ingen enkelt ion er utelukkende forbundet med noen annen enkelt ion. Hver ion er omgitt av ioner med motsatt ladning.
formelen for en ionisk forbindelse følger flere konvensjoner. For det første er kation skrevet før anionen. Fordi de fleste metaller danner kationer og de fleste ikke-metaller danner anioner, lister formler vanligvis metallet først og deretter ikke-metallet. For det andre er kostnader ikke skrevet i en formel. Husk at i en ionisk forbindelse er komponentartene ioner, ikke nøytrale atomer, selv om formelen ikke inneholder ladninger. Endelig har den riktige formelen for en ionisk forbindelse alltid en netto nullladning, noe som betyr at den totale positive ladningen må være lik den totale negative ladningen. For å bestemme riktig formel for enhver kombinasjon av ioner, bestemme hvor mange av hver ion som trengs for å balansere de totale positive og negative ladningene i forbindelsen.
denne regelen er i siste instans basert på det faktum at saken er generelt elektrisk nøytral.
ved konvensjon antar du at det bare er ett atom hvis et abonnement ikke er til stede. Vi bruker ikke 1 som abonnement.
Hvis vi ser på den ioniske forbindelsen som består av litiumioner og bromidioner, ser vi at litiumionet har en 1+ ladning og bromidionet har en 1− ladning. Bare en ion av hver er nødvendig for å balansere disse kostnadene. Formelen for litiumbromid er \(\ce{LiBr}\).
når en ionisk forbindelse dannes fra magnesium og oksygen, har magnesiumionet en 2+ ladning, og oksygenatomet har en 2− ladning. Selv om begge disse ionene har høyere ladninger enn ionene i litiumbromid, balanserer de fortsatt hverandre i et en-til-en-forhold. Derfor er den riktige formelen for denne ioniske forbindelsen \(\ce{MgO}\).
vurder nå den ioniske forbindelsen dannet av magnesium og klor. En magnesiumion har en 2 + ladning, mens en klorion har en 1-ladning:
\
Kombinere en ion av hver balanserer ikke helt de positive og negative ladningene. Den enkleste måten å balansere disse ladningene på er å anta tilstedeværelsen av to kloridioner for hver magnesiumion:
\
nå er de positive og negative ladningene balansert. Vi kunne skrive kjemisk formel for denne ioniske forbindelsen som \(\ce{mgclcl}\), men konvensjonen er å bruke et numerisk abonnement når det er mer enn ett ion av en gitt type – \(\ce{MgCl2}\). Denne kjemiske formelen sier at det er en magnesiumion og to kloridioner i denne formelen. (Ikke les» Cl2 » – delen av formelen som et molekyl av det diatomiske elementære klor. Klor finnes ikke som et diatomisk element i denne forbindelsen. Snarere eksisterer det som to individuelle kloridioner.) Ved konvensjon brukes det laveste hele tallforholdet i formlene av ioniske forbindelser. Formelen \(\ce{Mg2Cl4}\) har balanserte ladninger med ionene i et 1: 2-forhold, men det er ikke det laveste hele tallforholdet.
for forbindelser der forholdet mellom ioner ikke er så åpenbart, kan abonnementene i formelen oppnås ved å krysse ladninger: bruk absoluttverdien av ladningen på en ion som abonnenten for den andre ion. Denne metoden er vist skjematisk I Figur 3.3.2.
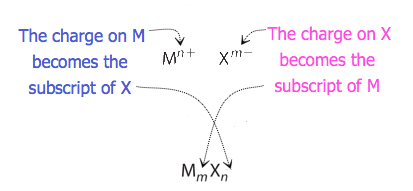
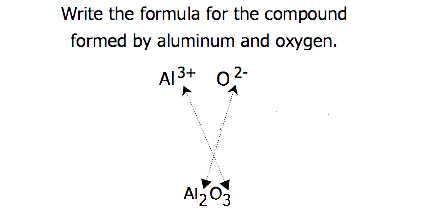
når du krysser kostnader, er det noen ganger nødvendig å redusere abonnementene til deres enkleste forhold for å skrive den empiriske formelen. Tenk for eksempel forbindelsen dannet Av Pb4+ Og O2 -. Ved å bruke de absolutte verdiene av ladningene på ionene som abonnementer, gir formelen Pb2O4. Dette forenkler til sin korrekte empiriske formel PbO2. Den empiriske formelen har en Pb4 + ion og to O2-ioner.
Eksempel \(\PageIndex{1}\)
Skriv kjemisk formel for en ionisk forbindelse sammensatt av hvert par ioner.
- natriumionet og svovelionet
- aluminiumionet og fluoridionet
- 3+ jernionet og oksygenionet
Løsning
- for å oppnå en valensskalloktett, danner natrium en ion med en 1+ ladning, mens svovel ion har en 2− ladning. To natrium 1 + ioner er nødvendig for å balansere 2-ladningen på svoveljonen. I stedet for å skrive formelen som \(\ce{NaNaS}\), forkorter vi den ved konvensjon til \(\ce{Na2S}\).
- aluminium ion har en 3 + ladning, mens fluoridion dannet av fluor har en 1-ladning. Tre fluor 1-ioner er nødvendig for å balansere 3 + ladningen på aluminiumionet. Denne kombinasjonen er skrevet som \(\ce{AlF3}\).
- Jern kan danne to mulige ioner, men ionen med en 3 + ladning er spesifisert her. Oksygenatomet har en 2-ladning som et ion. For å balansere de positive og negative ladningene, ser vi til minst felles flere-6: to jern 3 + ioner vil gi 6+, mens tre 2-oksygenioner vil gi 6 -, og dermed balansere de generelle positive og negative ladningene. Dermed er formelen for denne ioniske forbindelsen \(\ce{Fe2O3}\). Alternativt kan du bruke overgangs kostnader metoden vist I Figur 3.3.2.
Øvelse \(\PageIndex{1}\)
Skriv kjemisk formel For en ionisk forbindelse sammensatt av hvert par ioner.
- kalsiumionet og oksygenionet
- 2+ kobber ion og svovel ion
- 1+ kobber ion og svovel ion
svar a:
CaO
Svar b:
CuS
Svar c:
Cu2S
Polyatomiske Ioner
Noen ioner består av grupper av atomer kovalent bundet sammen og har en samlet elektrisk ladning. Fordi disse ioner inneholder mer enn ett atom, kalles de polyatomiske ioner. Lewis strukturer, navn og formler av noen polyatomiske ioner finnes i Tabell 3.3.1.
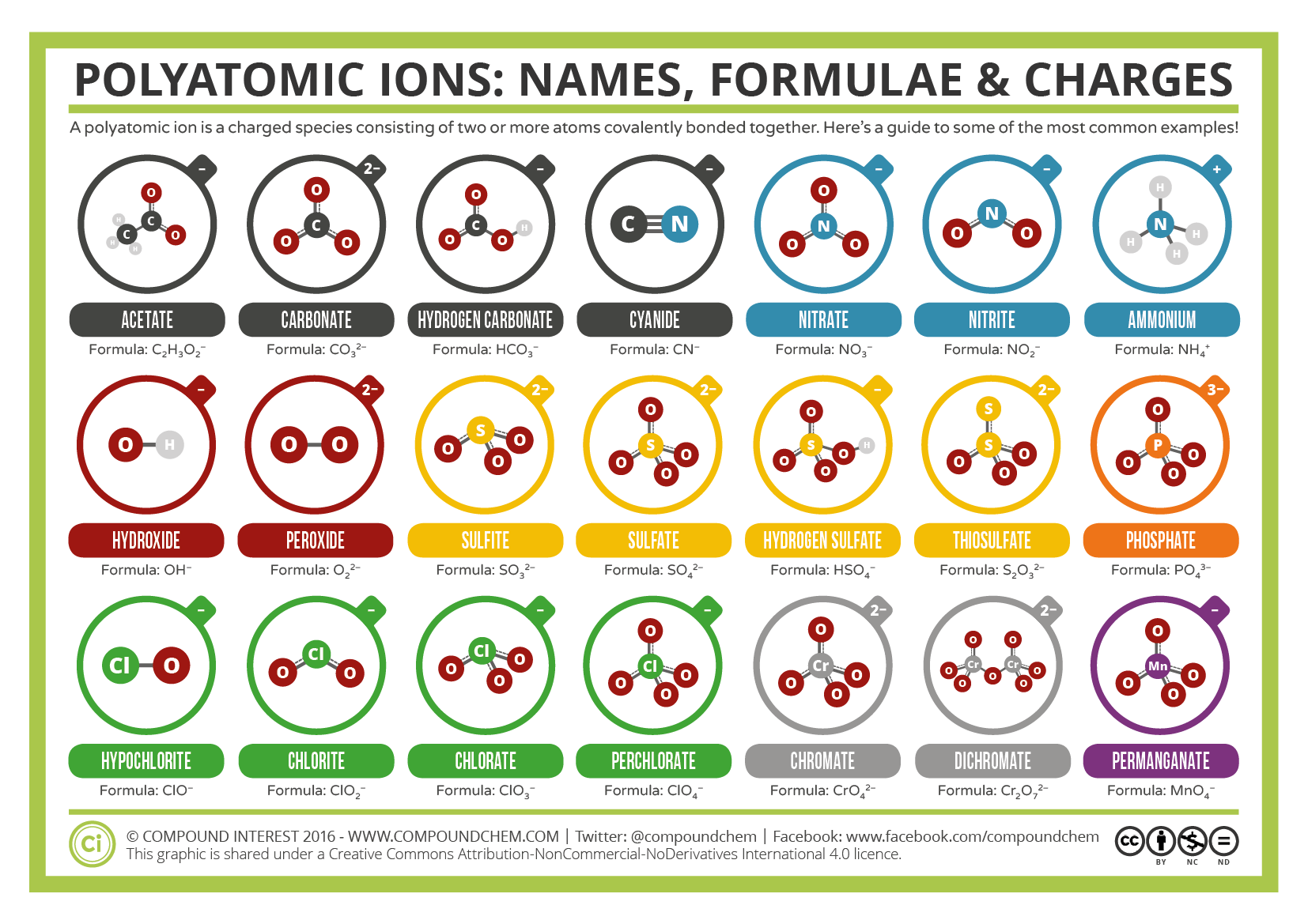
Tabell \(\PageIndex{1}\): Noen Polyatomiske Ioner
Polyatomiske ioner har definerte formler, navn og ladninger som ikke kan endres på noen måte. Tabell \(\PageIndex{2}\) viser ionnavn og ionformler av de vanligste polyatomiske ioner. For eksempel er \(\ce{NO3^ { – }}\) nitrationet; det har ett nitrogenatom og tre oksygenatomer og en samlet 1-ladning. Figur \(\PageIndex{2}\) viser de vanligste polyatomiske ioner.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. De resterende polyatomiske ioner er alle negativt ladet og er derfor klassifisert som anioner. Imidlertid er bare to av disse, hydroksidionet og cyanidionet, navngitt ved hjelp av» – ide » – suffikset som vanligvis indikerer negativt ladede partikler. De resterende polyatomiske anioner, som alle inneholder oksygen, i kombinasjon med et annet ikke-metall, eksisterer som en del av en serie hvor antall oksygen i den polyatomiske enheten kan variere. Som det gjentatte ganger har blitt understreket i flere deler av denne teksten, bør ikke to kjemiske formler dele et felles kjemisk navn. Et enkelt suffiks, «- ide», er utilstrekkelig for å skille navnene på anionene i en relatert polyatomisk serie. Derfor brukes suffikser»- ate «og» – ite » for å betegne at de tilsvarende polyatomiske ioner er en del av en serie. I tillegg angir disse suffiksene også det relative antall oksygen som er inneholdt i de polyatomiske ioner. Merk at alle polyatomiske ioner hvis navn slutter i «- ate «inneholder en mer oksygen enn de polyatomiske anioner hvis navn slutter i» – ite.»Dessverre, i likhet med det vanlige systemet for å navngi overgangsmetaller, indikerer disse suffiksene bare det relative antall oksygen som finnes i de polyatomiske ioner. For eksempel har nitrationen, som er symbolisert SOM NO3-1, en mer oksygen enn nitrittionen, som er symbolisert SOM NO2−1. Imidlertid er sulfationen symbolisert SOM SO4−2. Mens både nitrat ion og sulfat ion dele en» – spiste » suffiks, den tidligere inneholder tre oksygen, men sistnevnte inneholder fire. I tillegg inneholder både nitrat-ion og sulfitt-ion tre oksygener, men disse polyatomiske ioner deler ikke et felles suffiks. Dessverre krever den relative naturen til disse suffiksene at ionformelen / ionnavnkombinasjonene av de polyatomiske ioner bare må huskes.regelen for å konstruere formler for ioniske forbindelser som inneholder polyatomiske ioner er den samme som for formler som inneholder monatomiske (enkeltatom) ioner: de positive og negative ladningene må balansere. Hvis mer enn en av en bestemt polyatomisk ion er nødvendig for å balansere ladningen, må hele formelen for polyatomisk ion være vedlagt i parentes, og det numeriske abonnementet er plassert utenfor parentesene. Dette er for å vise at abonnementet gjelder for hele polyatomisk ion. To eksempler er vist nedenfor:

Eksempel \(\PageIndex{2}\)
Skriv kjemisk formel for en ionisk forbindelse sammensatt av hvert par ioner.
- kaliumionet og sulfationet
- kalsiumionet og nitrat ion
Løsning
- Kaliumioner har en kostnad på 1+, mens sulfationer har en kostnad på 2−. Vi trenger to kaliumioner for å balansere ladningen på sulfationen, så den riktige kjemiske formelen er \(\ce{K_2SO_4}\).
- Kalsiumioner har en kostnad på 2+, mens nitrationer har en kostnad på 1−. Vi trenger to nitrationer for å balansere ladningen på hver kalsiumion. Formelen for nitrat må være vedlagt i parentes. Dermed skriver vi \(\ce{Ca (NO3) 2}\) som formelen for denne ioniske forbindelsen.
Øvelse \(\PageIndex{2}\)
Skriv kjemisk formel For en ionisk forbindelse sammensatt av hvert par ioner.
- magnesium – ion og karbonat – ion
- aluminium-ion og acetat-ion
Svar a:
Mg2+ OG CO32 – = MGCO3
Svar b:
Al3+ Og C2H3O2 – = Al(C2H3O2)3
gjenkjenne ioniske forbindelser
det er to måter å gjenkjenne ioniske forbindelser. For det første er forbindelser mellom metall og ikke-metallelementer vanligvis ioniske. For Eksempel Inneholder CaBr2 et metallisk element (kalsium, en gruppe 2a metall) og et ikke-metallisk element (brom, en gruppe 7A ikke-metall). Derfor er det mest sannsynlig en ionisk forbindelse. (Faktisk er det ionisk.) I kontrast inneholder forbindelsen NO2 to elementer som er både ikke-metaller (nitrogen, fra gruppe 5A og oksygen, fra gruppe 6A). Det er ikke en ionisk forbindelse; det tilhører kategorien kovalente forbindelser diskutere andre steder. Merk også at denne kombinasjonen av nitrogen og oksygen har ingen elektrisk ladning spesifisert, så det er ikke nitritt ion.For Det Andre, hvis du gjenkjenner formelen av et polyatomisk ion i en forbindelse, er forbindelsen ionisk. Hvis du for eksempel ser formelen \(\ce{Ba (NO3) 2}\), kan du gjenkjenne» NO3 » – delen som nitrationet, \(\rm{NO_3^ -}\). (Husk at konvensjonen for å skrive formler for ioniske forbindelser ikke skal inkludere ionisk ladning.) Dette er en anelse om at den andre delen av formelen, \(\ce{Ba}\), faktisk er\ (\ce{Ba^{2+}}\) ion, med 2 + ladningen som balanserer den totale 2-ladningen fra de to nitrationene. Således er denne forbindelsen også ionisk.
Eksempel \(\PageIndex{3}\)
Identifiser hver forbindelse som ionisk eller ikke ionisk.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\Ce{NH4Cl}\)
- \(\ce{OF2}\)
Løsning
- natrium er et metall, og oksygen Er et ikke-metall; derfor Forventes \(\ce{na2o}\) Å være ionisk.
- både fosfor og klor er ikke-metaller. Derfor er \(\ce{PCl3}\) ikke ionisk.
- \(\ce{NH4}\) i formelen representerer ammoniumionet, \(\ce{NH4^ { + }}\), som indikerer at denne forbindelsen er ionisk.
- både oksygen og fluor er ikke-metaller. Derfor er \(\ce{OF2}\) ikke ionisk.
Øvelse \(\PageIndex{3}\)
Identifiser hver forbindelse som ionisk eller ikke ionisk.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3po4}\)
- \(\ce{SOCl2}\)
Svar a:
ikke ionisk
Svar b:
ionisk
Svar c:
ionisk
svar d:
ikke ionisk
Ser Nærmere: Blod og Sjøvann
Vitenskapen har lenge anerkjent at blod og sjøvann har lignende sammensetninger. Tross alt har begge væskene ioniske forbindelser oppløst i dem. Likheten kan være mer enn bare tilfeldighet; mange forskere tror at de første livsformer på Jorden oppsto i havene. En nærmere titt viser imidlertid at blod og sjøvann er ganske forskjellige. En 0,9% løsning av natriumklorid tilnærmer saltkonsentrasjonen som finnes i blod. I motsetning er sjøvann hovedsakelig en 3% natriumkloridløsning, over tre ganger konsentrasjonen i blodet. Her er en sammenligning av mengdene av ioner i blod og sjøvann:
| Prosent I Sjøvann | prosent i blod | na+ | 2.36 | 0.322 |
|---|---|---|
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Denne forskjellen er signifikant fordi hydrogenkarbonationen og noen relaterte ioner har en avgjørende rolle i å kontrollere blodets syrebaseegenskaper. Mengden hydrogenfosfationer – \(\ce{HPO4^{2 -}}\) og \(\ce{H2PO4^{ – }}\) – i sjøvann er svært lav, men de er tilstede i høyere mengder i blod, hvor de også påvirker syrebaseegenskaper. En annen merkbar forskjell er at blod ikke har betydelige mengder sulfationet (\(\ce{SO4^{2−}}\)), men denne ion er tilstede i sjøvann.
Key Takeaways
- Riktige kjemiske formler for ioniske forbindelser balanserer den totale positive ladningen med den totale negative ladningen.
- Grupper av atomer med en samlet ladning, kalt polyatomiske ioner, eksisterer også.
ØVELSER
-
hvilken informasjon finnes i formelen av en ionisk forbindelse?
-
hvorfor inneholder kjemiske formler for noen ioniske forbindelser abonnementer, mens andre ikke gjør det?
3. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- mg2+ Og I−
- Na+ Og O2−
4. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- Na+ Og Br−
- Mg2+ og Br−
- mg2+ og S2−
5. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- K+ Og Cl−
- Mg2+ Og Cl−
- Mg2+ og Se2−
6. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- Na+ Og N3−
- Mg2+ Og N3−
- Al3+ Og S2−
7. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- Li+ Og N3−
- mg2+ Og P3−
- li+ Og P3−
8. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- Fe3+ Og Br−
- Fe2+ Og Br−
- Au3+ Og S2−
- Au+ Og S2−
9. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- Cr3+ Og O2−
- Cr2+ Og O2−
- Pb2+ Og Cl−
- Pb4+ og Cl−
10. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- Cr3+ OG NO3−
- Fe2+ OG PO43−
- Ca2 + Og CrO42−
- Al3 + Og OH –
11. Skriv kjemisk formel for ionisk forbindelse dannet av hvert par ioner.
- NH4+ OG NO3−
- h+ Og Cr2O72−
- Cu+ OG CO32−
- Na+ Og HCO3−
12. For hvert par elementer, bestem ladningen for deres ioner og skriv riktig formel for den resulterende ioniske forbindelsen mellom dem.
- Ba og S
- Cs Og I
13. For hvert par elementer, bestem ladningen for deres ioner og skriv riktig formel for den resulterende ioniske forbindelsen mellom dem.
- K og S
- Sc og Br
14. Hvilke forbindelser vil du forutsi å være ionisk?
- Li2O
- (NH4) 2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Hvilke forbindelser vil du forutsi å være ionisk?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CRO4
- C8H18
- NH3
Svar
1. forholdet mellom hver type ion i forbindelsen
2. Noen ganger er det nødvendig med mer enn ett ion for å balansere ladningen på den andre ion i en ionisk forbindelse.
- Mg2
- Na2O
- aBr
- MgBr2
- MGS
- kcl
- mgcl2
- mgse
- na3n
- MG3N2
- AL2S3
- li3n
- mg3p2
- febr3
- AU2S
- cr2o3
- Cro
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- nh4no3
- h2cr2o7
- cu2co3
- nahco3
- ba2+, S2−, bas
- cs+, i−, csi
- K+, s2−, k2s
- sc3+, br−, scbr3
- ionisk
- ikke ionisk
- ikke ionisk
- ikke ionisk
- ikke ionisk
- ikke ionisk
- ikke ionisk
- ikke ionisk
- ikke ionisk
- ikke IONISK
- ikke IONISK
- ikke IONISK
- ikke IONISK
- ikke IONISK
- ikke ionisk
- div >
- ikke ionisk
- ikke ionisk
ikke ionisk ikke ionisk ikke ionisk
/ li >
