13.5 D: Biotin ER ET CO2-bærende koenzym
Husk fra seksjon 6.5 B at mange enzymer er avhengige av hjelp av koenzymer, som er små (i forhold til protein) organiske molekyler som binder – kovalent eller ikke-koenzym.kovalent – I Et Enzyms Aktive Sted Og Hjelper Det Å Katalysere reaksjonen. S-adenosylmetionin (SAM, avsnitt 9.1 A) og ATP (avsnitt 10.2) er to eksempler som vi har møtt så langt,og vi vil se flere i kapitlene fremover. Selv Om Rubisco (beskrevet i del B i denne delen) er et unntak, er de fleste enzymer som katalyserer karboksyleringsreaksjoner avhengig av et koenzym som kalles biotin, som fungerer som en midlertidig bærer av karbondioksid.
Pyruvatkarboksylase, enzymet som katalyserer det første trinnet i glukoneogensis-banen, er et godt eksempel på en biotinavhengig karboksyleringsreaksjon. Legg merke TIL AT CO2 i denne reaksjonen er avledet fra bikarbonat, i motsetning Til Rubisco-reaksjonen der CO2 er ‘fast’ direkte fra atmosfæren.

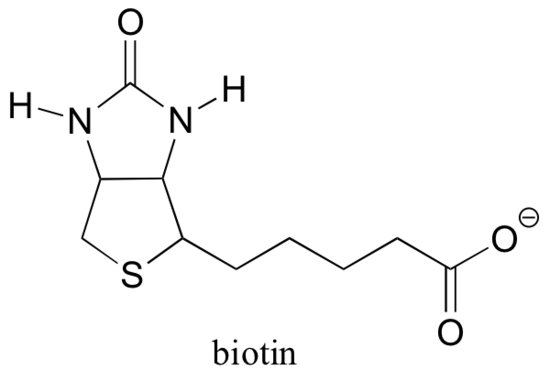
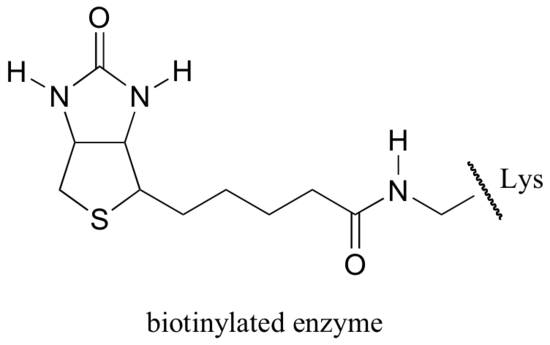
Biotin er kovalent festet til enzymet gjennom en amidbinding til et aktivt sted lysin.
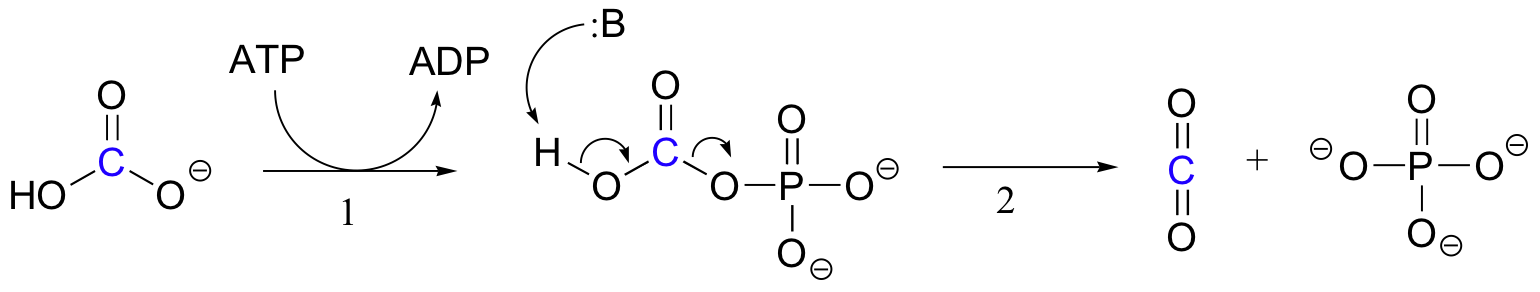
den eksakte mekanismen som biotinavhengige karboksyleringsreaksjoner opererer med, er fortsatt ikke helt forstått, men følgende er et sannsynlig bilde. Først fosforyleres bikarbonationen AV ATP (trinn 1, se avsnitt 10.2), og aktiveres dermed for dekarboksylering, som genererer fri CO2 (trinn 2).
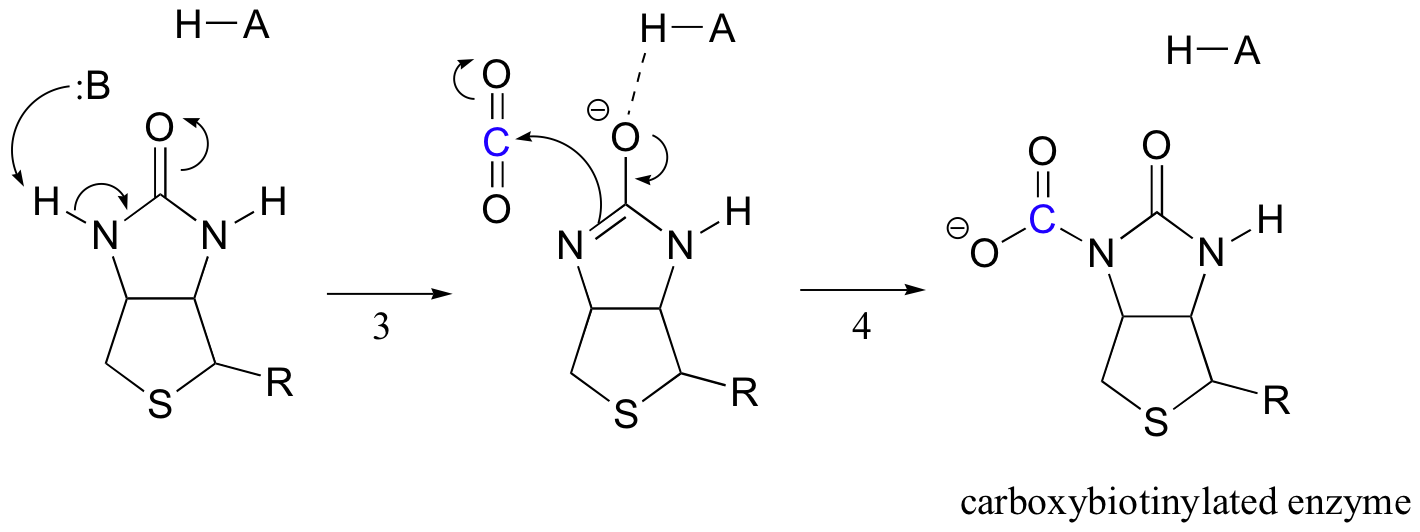
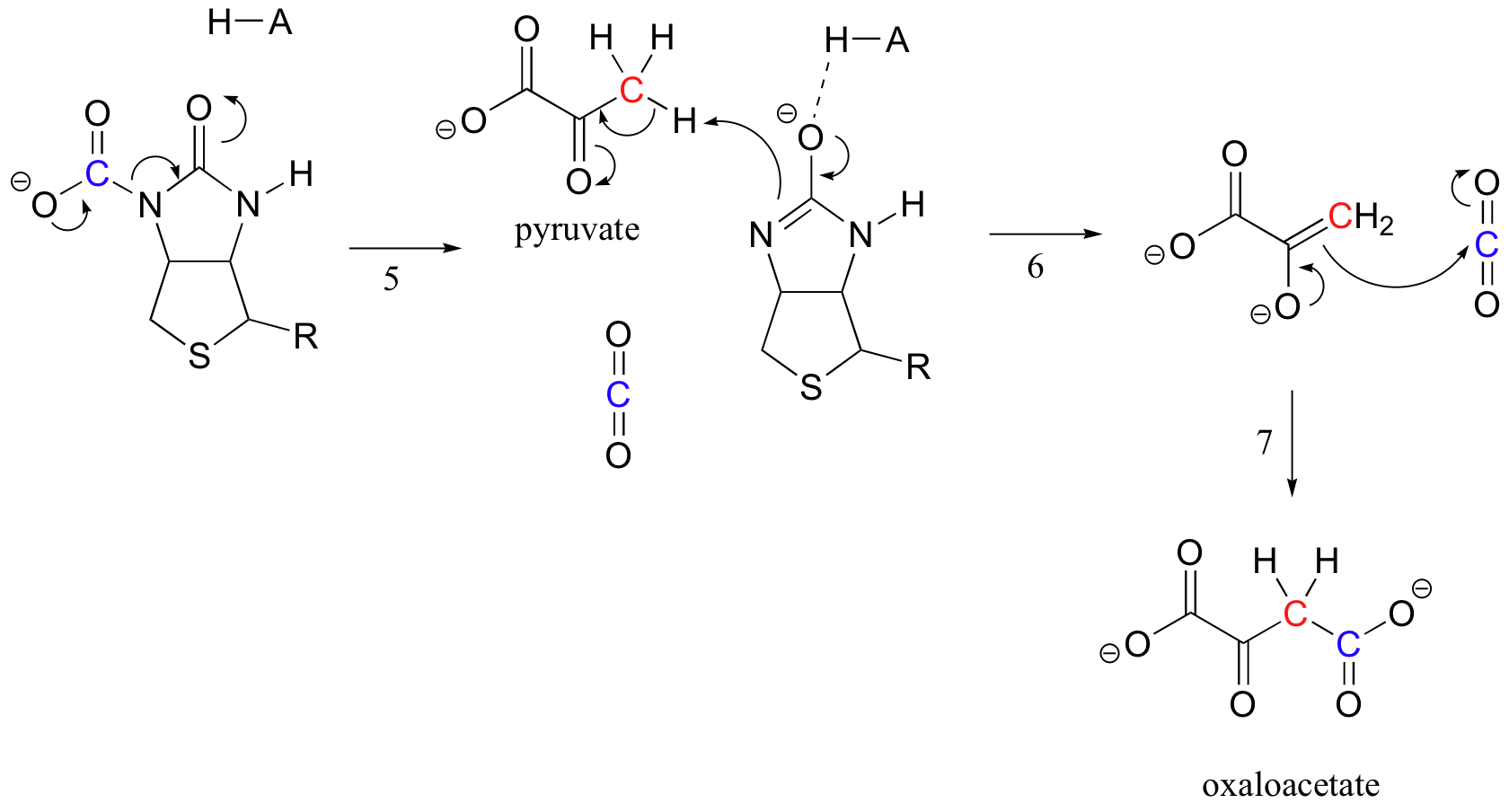
Biotins jobb er å holde på karbondioksidmolekylet til pyruvat kommer inn i det aktive stedet. Karboksylering av biotin innebærer deprotonering av amidnitrogenet for å danne et enolatlignende mellomprodukt (trinn 3 – amider har en pKa på omtrent 17, og dette senkes ved tilstedeværelse av en aktiv sitesyre nær oksygen). Dette trinnet følges av angrep av nukleofilt nitrogen på karbondioksid for å danne karboksybiotinylert enzym (trinn 4).
når et pyruvatmolekyl binder seg, fører omorganisering av den aktive områdearkitekturen til at det forrige trinnet går i revers (trinn 5), frigjør CO2 og genererer en biotinbase for å deprotonere alfa-karbonet av det aktive området.pyruvat slik at det kan kondensere, på en aldol-lignende måte, med co2 for å danne oksaloacetat (trinn 6-7).
hvis du har studert noe biokjemi, har du kanskje hørt om biotin i en noe annen sammenheng enn det som diskuteres i denne delen. Et protein kalt avidin, funnet i overflod i egghvite, binder ikke-kovalent og ekstremt tett til biotin (faktisk er avidin-biotin det tetteste protein-ligandbindende paret kjent for vitenskapen). Biokjemikere gjør ofte bruk av denne egenskapen ved kovalent å knytte en biomolekyl av interesse for biotin. Den biotinylerte arten kan da lett isoleres fra en kompleks blanding ved å kjøre blandingen gjennom en affinitetskolonne som er belagt med avidin.
