det finnes en rekke måter som en celle kan flytte fra ett punkt i rommet til et annet. I et flytende medium, kan denne metoden være en slags svømming, utnytte ciliary eller flagellar bevegelse for å drive cellen. På faste overflater vil disse mekanismene tydeligvis ikke fungere effektivt, og cellen gjennomgår en krypeprosess. I denne delen begynner vi med en diskusjon av ciliary / flagellar bevegelse, og deretter vurdere de mer kompliserte kravene til cellulær gjennomsøking.Cilia og flagella, som hovedsakelig varierer i lengde i stedet for konstruksjon, er mikrotubulebaserte organeller som beveger seg frem og tilbake. Dette oversetter til «roing» av den relativt korte cilia, men i lengre flagella fører fleksibiliteten til strukturen til at frem og tilbake bevegelsen blir forplantet som en bølge, så flagellarbevegelsen er mer bølgende eller whiplike (vurder hva som skjer når du svinger en hageslange raskt fra side til side sammenlignet med et kort stykke av samme slange). Kjernen i begge strukturer kalles aksonemet, som består av 9 mikrotubuli som er koblet til hverandre av ciliary dynein motorproteiner, og omgir en sentral kjerne av to separate mikrotubuli.
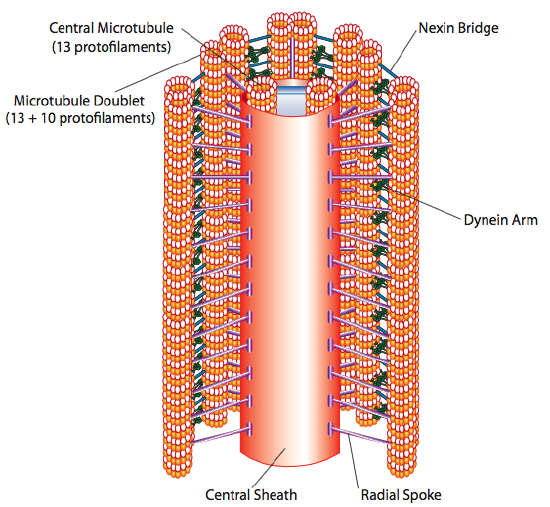
dette er kjent som «9+2» – formasjonen, selv om de ni dublettene ikke er de samme som de to sentrale mikrotubuli. A-tubulen er en full 13-protofilamenter, Men b-tubulen smeltet til den inneholder bare 10 protofilamenter. Hver av de sentrale mikrotubuli er en full 13 protofilamenter. 9 + 2 axoneme strekker lengden av cilium eller flagellum fra spissen til den når basen, og kobles til cellekroppen gjennom en basal kropp, som består av 9 mikrotubuli triplets ordne i en kort fat, mye som sentriolene hvorfra de er avledet.
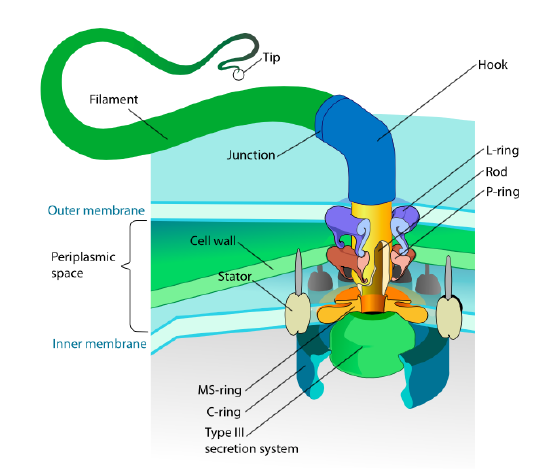
denne delen refererer bare til eukaryoter. Noen prokaryoter har også motile vedlegg kalt flagella, men de er helt forskjellige i både struktur og mekanisme. Flagellaen selv er lange spiralformede polymerer av proteinet flagellin, og basen av flagellinfibrene er koblet til et rotasjonsmotorprotein, ikke en translasjonsmotor. Denne motoren (Figur \(\PageIndex{18}\)) benytter ion (H+ eller Na+ avhengig av art) ned en elektrokjemisk gradient for å gi energi til å rotere så mange som 100000 omdreininger per minutt. Det antas at rotasjonen drives av konformasjonsendringer i statorringen, som ligger i cellemembranen.
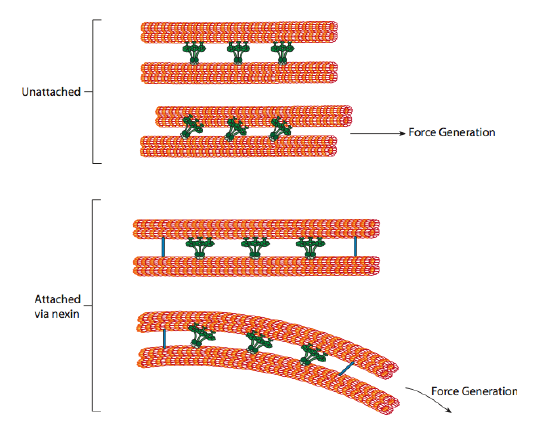
de ciliære dyneinene gir motorens evne, men det er også to andre koblingsproteiner i axonemet. Det er nexins som forbinder A-tubulen til en dublett Til b-tubulen i sin tilstøtende dublett, og forbinder dermed den ytre ringen. Og det er radiale eiker som strekker Seg Fra A-tubulen til hver dublett til det sentrale paret av mikrotubuli i kjernen av axonemet. Ingen av disse har noen motoraktivitet. Imidlertid er de avgjørende for bevegelsen av cilia og flagella fordi de bidrar til å forvandle en glidende bevegelse til en bøyebevegelse. Når ciliary dynein (veldig lik cytoplasmatiske dyneins, men har tre hoder i stedet for to) er engasjert, binder det en mikrotubule På den ene siden, En b mikrotubule fra den tilstøtende dubletten, og beveger seg i forhold til den andre. En linje av disse dyneinene som beveger seg i konsert, vil dermed skyve en dublett i forhold til den andre, hvis (og det er en stor «hvis») de to dublettene hadde full bevegelsesfrihet. Men siden dublettene er sammenkoblet av nexin-proteinene, skjer det som en dublett forsøker å glide, at den bøyer den tilkoblede strukturen i stedet(Figur \(\PageIndex{17}\)). Denne bøyningen står for roingbevegelsen til cilia, som er relativt korte, samt piskebevegelsen til den lange flagellaen, som forplanter bøyebevegelsen ned i axonemet.
selv om vi tenker på ciliary og flagellær bevegelse som metoder for fremdrift av en celle, som flagellær svømming av sæd mot et egg, er det også en rekke viktige steder hvor cellen er stasjonær, og cilia brukes til å flytte væske forbi cellen. Faktisk er det celler med cilia i de fleste store organer i kroppen. Flere ciliary dyskinesier har blitt rapportert, hvorav den mest fremtredende, primære ciliary dyskinesi( PCD), som inkluderer Kartagener syndrom (KS), skyldes mutasjon AV DNAI1 genet, som koder for en underenhet (mellomkjede 1) av axonemal (ciliary) dynein. PCD er preget av respiratorisk nød på grunn av tilbakevendende infeksjon, og diagnosen KS gjøres hvis det også er situs inversus, en tilstand der kroppens normale venstre-høyre asymmetri (f. eks. mage til venstre, lever til høyre) reverseres. Det første symptomet skyldes inaktivitet av de mange cilia av epitelceller i lungene. Deres normale funksjon er å holde slim i luftveiene konstant i bevegelse. Normalt bidrar slimet til å holde lungene fuktige for å lette funksjonen, men hvis slimet blir stasjonært, blir det et avlsmiljø for bakterier, samt å bli en irriterende og hindring for riktig gassutveksling.Situs inversus Er en interessant misdannelse fordi den oppstår i embryonisk utvikling, og påvirker bare 50% AV PCD-pasientene fordi den svekkede ciliaryfunksjonen forårsaker randomisering av venstre-høyre asymmetri, ikke reversering. I svært enkle termer, under tidlig embryonal utvikling, er venstre-høyre asymmetri delvis skyldes bevegelse av molekylære signaler i en venstre ow gjennom embryonale node. Denne strømmen skyldes koordinert slag av cilia, så når de ikke virker, blir strømmen forstyrret og randomisering oppstår.
Andre symptomer PÅ PCD-pasienter peker også på arbeidet med cilia og flagella i kroppen. Mannlig infertilitet er vanlig på grunn av immotil sperm. Kvinnelig infertilitet, men mindre vanlig, kan også forekomme, på grunn av dysfunksjon av cilia i ovidukten og egglederen som normalt beveger egget langs fra eggstokk til livmor. Interessant er det også en lav forening av hydrocephalus internus (overfylling av hjernens ventrikler med cerebrospinalvæske, forårsaker utvidelsen som komprimerer hjernevævet rundt DEM) MED PCD. Dette skyldes sannsynligvis dysfunksjon av cilia i ependymale celler som forer ventriklene, og som bidrar til å sirkulere CSF, men er tilsynelatende ikke helt nødvendig. SIDEN csf bulk flyt er antatt å være drevet primært av systole / diastole endring i blodtrykk i hjernen, noen hypoteser at cilia kan være involvert primært i ow gjennom noen av de strammere kanaler i hjernen.
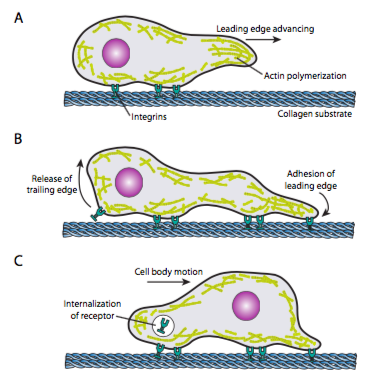
cell crawling (Figur \(\PageIndex{19}\)) krever koordinert omorganisering av det ledende mikrofilamentnettverket, som strekker seg (ved både polymerisering og glidende filamenter)og deretter danner adhesjoner på det nye fremoverpunktet. Dette kan ta form av filopodia eller lamellipodia, og ofte begge samtidig. Filopodi er lange og svært tynne fremspring med kjernebunter av parallelle mikrofilamenter og høye konsentrasjoner av celleoverflatereseptorer. Deres formål er først og fremst å fornemme miljøet. Lamellipadia strekker seg ofte mellom to lopodia og er mer av en bred ruffle enn en finger. Internt actin danner mer i masker enn bunter, og den bredere kanten gjør det mulig for flere adhesjoner til underlaget. Mikrofilamentnettet omarrangerer deretter igjen, denne gangen åpner et rom i cytoplasma som fungerer som en kanal for bevegelsen av mikrotubuli mot forsiden av cellen. Dette setter transportnettverket på plass for å bidra til å flytte intracellulært bulkmateriale fremover. Når dette skjer, frigjøres de gamle adhesjonene på haleenden av cellen. Denne frigjøringen kan skje gjennom to primære mekanismer: endocytose av reseptoren eller deaktivering av reseptoren ved signalering / konformasjonsendring. Selvfølgelig er denne forenklingen i motsetning til kompleksiteten i å koordinere og kontrollere alle disse handlingene for å oppnå rettet bevegelse av en celle.En modell av mikrofilamentkraftgenerering, Den Elastiske Bruniske Ratchet-Modellen (Mogilner og Oster, 1996), foreslår at på Grunn Av Brunisk bevegelse av cellemembranen som følge av kontinuerlig minutt termisk svingning, blir aktinfilamentene som skyver ut mot membranets kanter bøyd i varierende grad. Hvis flexen er stor nok, kan en ny aktinmonomer passe inn mellom membranen og spissen av filamentet, og når det nå lengre filamentet bøyer seg tilbake, kan det utøve et større trykk på membranen. Åpenbart genererer en enkelt filament ikke mye kraft, men den koordinerte forlengelsen av mange filamenter kan skyve membranen fremover.Når en celle mottar et signal for å bevege seg, er den første cytoskeletal responsen å polymerisere aktin, og bygge flere mikrofilamenter for å innlemme i forkanten. Avhengig av signalet (attraktivt eller repulsivt), kan polymerisasjonen forekomme på samme eller motsatt side av cellen fra signalreseptoraktiveringspunktet. Signifikant kan polymeriseringen av ny f-actin alene generere tilstrekkelig kraft til å bevege membranen fremover, selv uten involvering av myosinmotorer! Modeller av kraftgenerering blir diskutert, men begynner vanligvis med inkorporering av ny g-aktin i en filament på spissen; det vil si ved filament-membrangrensesnittet. Selv om det teknisk sett kan være nok, i en levende celle, er myosiner involvert, og bidrar til å presse og ordne filamenter retningsbestemt for å sette opp den nye forkanten. I tillegg må noen filamenter og nettverk raskt kuttes, og nye forbindelser gjøres, både mellom filamenter og mellom filamenter og andre proteiner som adhesjonsmolekyler eller mikrotubuli.
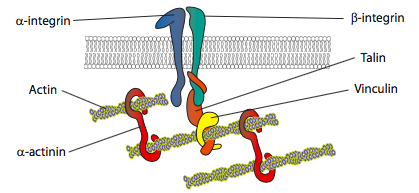
hvordan styres polymerisasjonen og aktinomleggingen? Reseptorene som signaliserer celle locomotion kan initiere noe forskjellige veier, men mange deler noen fellestrekk i å aktivere en eller flere medlemmer Av Ras-familien av små GTPases. Disse signalmolekylene, Som Rac, Rho og cdc42, kan aktiveres av reseptortyrosinkinaser (SE RTK – ras aktiveringsveier, Chap. 14). Hver av disse har en litt annen rolle i cellemotilitet: cdc42-aktivering fører til filopodi-dannelse, rac aktiverer en vei som inkluderer Arp2 / 3 og kofilin til lamellipodi-dannelse, Og Rho aktiverer myosin II for å kontrollere fokal adhesjon og stressfiberdannelse. En annen type reseptorkaskade, G-proteinsignalkaskaden (Også Kapittel 14), kan føre TIL aktivering AV PLC og påfølgende spaltning AV PIP2 og økning i cytosolisk Ca2+. Disse endringene, som nevnt tidligere, kan også aktivere myosin II, samt remodelleringsenzymer gelsolin, kofilin og profilin. Dette bryter ned eksisterende aktinstrukturer for å gjøre cellen mer væske, samtidig som det bidrar til mer g-actin for å danne det nye ledende cytoskelettet.in vitro-eksperimenter viser at når membranen skyver fremover, blir nye klebemiddelkontakter laget gjennom adhesjonsmolekyler eller reseptorer som binder substratet (ofte cellekulturglass eller retter er belagt med kollagen, filaminin eller andre ekstracellulære matriksproteiner). Kontaktene rekrutterer deretter cytoskeletal elementer for større stabilitet for å danne en fokal adhesjon (Figur \(\PageIndex{20}\)). Imidlertid synes dannelsen av fokale adhesjoner å være en artefakt av cellekultur, og det er uklart om typer adhesjoner som danner in vivo rekrutterer de samme typer cytoskeletale komponenter.
det tredje trinnet til cellelokomotion er massebevegelsen av det cellulære innholdet fremover. Mekanismene for denne fasen er uklare, men det er noen bevis på at bruk av koblinger mellom actin cytoskelettet i forkant og fremover deler av mikrotubule cytoskelettet, blir mikrotubuli omorganisert for å danne en effektiv transportbane for bulkbevegelse. Et annet aspekt til dette kan være en» corralling » effekt av actin nettverk, som retningsbestemt åpne opp plass mot forkanten. Mikrotubuli deretter inn at plass lettere enn å arbeide gjennom en tett actin mesh, tvinge flyt i riktig retning.Mye av arbeidet med mikrotubule-actin-interaksjoner i cellemotilitet har blitt gjort gjennom forskning på nevronvekstkeglen, som noen ganger refereres til som en celle i bånd, fordi den virker nesten uavhengig som en krypende celle, og søker etter riktig vei for å lede sin axon fra cellekroppen til sin rette synaptiske forbindelse (A. W. Schaefer et al, Dev. Celle 15: 146-62, 2008).
endelig må cellen angre sine gamle adhesjoner på bakkanten. Dette kan skje på en rekke forskjellige måter. In vitro har krypende celler blitt observert å rive seg av substratet, og etterlate små biter av membran og tilhørende adhesjonsproteiner i prosessen. Kraften som genereres antas å komme fra aktin-myosin stressfibre som fører fra de mer fremoverfokale adhesjonene. Det er imidlertid mindre destruktive mekanismer tilgjengelig for cellene. I noen tilfeller kan adhesiviteten til den cellulære reseptoren for det ekstracellulære substratet reguleres internt, kanskje ved fosforylering eller defosforylering av en reseptor. En annen mulighet er endocytose av reseptoren, og tar den av celleoverflaten. Det kan bare resirkulere opp til forkanten der det trengs (dvs. transcytose), eller hvis det ikke lenger er nødvendig eller skadet, kan det brytes ned i et lysosom.
