Introduction
細胞傷害性細胞は、ウイルス感染および癌細胞 これらの細胞は、3つの異なる経路、溶解顆粒の放出、Fas受容体−リガンド経路、またはTRAIL−TRAIL受容体経路を介して死滅する。 本稿の目的のために,脱か粒に焦点を当てた。 細胞傷害性細胞が標的細胞に遭遇すると、それはそれにしっかりと付着して免疫シナプスを形成する。 溶解顆粒は、次いで、免疫学的シナプスに向かって偏光され、標的に向けられた細胞傷害性細胞から放出される(1)。 これらのか粒はパーフォリンおよびgranzymesのようなさまざまな細胞毒性メディエーターを含んでいます。 放出されたパーフォリンは、標的細胞膜内に一時的な細孔を形成し、granzymesが標的細胞に入ることを可能にする。 エントリーはおそらく不完全な細孔(アーク)を形成するパーフォリンオリゴマーによっても媒介され(2)、グランザイムとパーフォリンはエンドソーム経路を介して標的細胞に取り込まれることが示唆されている(3、4)。 これらの提案されたメカニズムの背後にあるデータは、最近詳細に議論されている(5)。 Granzymesが標的細胞に入ると、カスパーゼ経路が活性化され、アポトーシスが起こります(6、7)。 これらの細胞傷害性顆粒の膜は、Cd107Aとしても知られているリソソーム関連膜糖タンパク質-1(LAMP1)を含む(8)。 ラットCd107Aの管腔部は、脱顆粒後に細胞膜の細胞外側に一過性に曝され、その後再び内在化される。 したがって、Cd1 0 7a染色は、脱顆粒事象が発生したことを示す(9)。 Cd107Aの役割はまだ決定されているが、cd107Aに対するsiRNA研究は、cd107Aの非存在下では溶解顆粒へのパーフォリンの送達が阻害されるため、小胞内のパーフォリン輸送に不可欠であることを示している(10)。 CD1 0 7aはまた、パーフォリンに結合し、細胞膜への挿入を防止することによって細胞傷害性細胞を死から保護する役割を有することが示されている(1 1)。
細胞傷害性リンパ球には、ナチュラルキラー細胞(NK)とCD8T細胞の二つの主なタイプがあります。 両方の細胞型は、溶解顆粒、Fas受容体/Fasリガンド経路およびTRAIL/TRAIL受容体経路の放出によって死滅するが、これら2つの細胞群を活性化するために必要な刺激は異なっている。 T細胞はmhcクラスi分子によって提示される抗原を活性化t細胞受容体(TCR)を介して認識し,NK細胞は様々な阻害性および活性化受容体を介して標的細胞抗原を認識する。 阻害受容体は、活性化受容体がNK細胞の細胞毒性を誘導しながら、健康な細胞を殺すからNK細胞を防止するために重要です。
Nk細胞における脱顆粒のマーカーとしてCd107Aを同定する前(12)、細胞傷害性能力を測定するための出力は、標的細胞の死であった。 フローサイトメトリーによるCd107Aの検出は、研究者が細胞傷害性能力を有する特定のエフェクター細胞を同定することを可能にした。 その発見以来、マウスおよびヒトの研究からのデータの出版物の広い配列は、抗Cd107a抗体を使用する利点を示す完了しています。 ラットは、白血病や移植片などの疾患を研究するための貴重な免疫学的動物モデルである。 宿主病(13)が、機能的な読み出しは、フローサイトメトリーのための高品質の特異的な抗ラットCd107A抗体の欠如によって妨げられている。 本稿では、ラットCd107Aに対する抗体の作成とラットNKおよびCD8+T細胞における脱顆粒応答の特性評価について説明します。
材料および方法
動物
アルメニア近交系ハムスター(Cytogen Research and Development Inc.(米国、マサチューセッツ州)は、制度的ガイドラインに同意して、オスロ大学病院のRikshospitaletの比較医学部門に収容されました。 ラット株PVG−RT1U、PVG−Rt7B、PVG−RT1N、およびPVG−R2 3は、交換可能に使用され、2 0世代以上維持され、Norwayの農業省の下で、およびEuropean Conventation for the Protection o f Vertebrate Animals used For Experimental And Other Scientific Purpositionによって設定された指針に従って飼育された。 ラットは8-12週の年齢で使用された。 実験動物施設は定期的な健康監視プログラムに服従し、ヨーロッパの実験動物科学連合の推薦の連合の修正に従って伝染性の有機体のためにテス 動物実験は、ノルウェーがEUの実験室の方向と欧州実験室条約に従う動物福祉法によって定められた実験室規則によって規制されました。
Absおよび試薬
Nkp46、NKR-P1Aに対する抗体3.2。結合)、CD8(OX8−ビオチン)、CD2(ox3 4、非結合)、TCR(R7 3−Alexa6 4 7)、マウスIgd bアロタイプ(TIB9 6−非結合、マウスIggアイソタイプとして使用)、およびCD4 5. CD3(IF4、非抱合)およびそのアイソタイプマウスIgm(MM−3 0、非抱合)およびアルメニアハムスター Iggアイソタイプ対照(HTK8 8−FITC)に対する抗体を、Biolegend(San Diego,C A,USA)か 市販の抗Cd1 0 7A抗体は、Abcam(Cambridge,UK)(H4A3−FITC)、Ebiosciens(San Diego,C A,USA)(ID4 8−Percp−EFluor)、およびLisfance(Seattle,W A,USA)(ls−c8 5 8 0非抱合)から購入した。 Louis,MO,USA)と結合させ、機能アッセイに使用した。 Louis,MO,USA)から購入した抗FLAG抗体(m2、非抱合)および抗マウスIgg(ヤギポリクローナル−FITC)を、Sigma−Aldrich(St. IL-2は、ラットIL-2発現構築物で安定にトランスフェクトチャイニーズハムスター卵巣(CHO)細胞株の透析細胞培養上清から得られた。 Peridinin Chlorophyl−a Protein(Percp)共役ストレプトアビジン、FITC h amster Iggポリクローナルisotype control、FITC mouse Igg1isotype control(MOPC−FITC)、およびGolgistopを、B D biosciences(Franklin Lakes,NJ,USA)から購入した。 ヤギ抗アルメニアハムスター(ポリクローナル−FITC)は、Jackson Immunoresearch(West Grove,PA,USA)から購入した。 ハイブリドーマOX4 1、Cd1 7 2A(Sirpa)、R7 3(抗ラットTcra Β)、OX1 9(抗CD5)、OX1 2(抗Igk鎖)、およびOX3 3(抗CD4 5R A)からの上清を社内で作製した。 対照ハムスター血清は、非免疫アルメニアハムスターから誘導された。
ラットCd107Aのクローニング
ラットCd107Aは、PVGラット脾細胞から生成されたcDNAからPCR増幅され、ピューロマイシン耐性遺伝子(Dr.Michael R.Dawsからの寛大な贈り物)(14)を含むpMX発現ベクターにサブクローニングされた(14)。 ラットCd1 0 7A(LAMP1)cDNA配列(Genbank:NM_0 1 2 8 5 7)に基づいてCD1 0 7プライマーを設計した。 フォワードプライマー: 5’−GCCCCAGCACTGTTCGAGGT−3’;リバースプライマー:5’−GTTGTTACCGTCCTGTACACACT−3’。 アニオン性トリプシン-1リーダーペプチド(MSALLILALVGAAVA)は、発現ベクターで使用され、元のCD107膜貫通領域は、高い表面発現を容易にするためにCD8膜貫通フラグメントに置 表面発現を検出可能にするために、FLAGタグ(DYKDDDDK)をCD1 0 7タンパク質のN末端に連結した。 最終的なキメラプラスミド構築物中のすべての挿入された配列および開いた読み取りフレームを、Sanger DNA配列決定によって調べ、確認した。
トランスフェクションBWZ。5μ lのFugene6試薬(Roche、製造業者のプロトコール)でトランスフェクトし、5%CO2で3 7℃でインキュベートした。</h3><p>2 9 3t細胞を、4mlのRPMI1 6 4 0培地で6ウェル Fugene6試薬をOpti−Mem(Gibco)で予め希釈し、1. トランスフェクションの2 4時間後に、上清を脱カントし、2%FBSを含むRPMI1 6 4 0培地で置換し、レトロウイルス産生のために3 2℃に移した。 2μ m Filtropur Sフィルター(Sarstedt)で濾過し、レトロウイルス形質導入のために−8 0℃で保存した。
105BWZ。3 6個の細胞を1ウェル当たり2 4ウェルの細胞培養プレート(Corning)に播種し、1 0%FBSを含む新鮮なRPMI1 6 4 0培地で一晩培養した。 上清を除去し、1 0%FBSを含有するRPMI1 6 4 0、1 6μ gポリブレン(最終濃度8μ g/mlまで)、および1. 次いで、細胞を3 2℃で1時間インキュベートした後、上清を除去し、1 0%FBSを含む新鮮なRPMI1 6 4 0培地と交換し、5%CO2を含む3 7℃で3日間培養した(2日目に、1ng/ml 拡大されたBWZ.Cd107A-FLAGトランスフェクタントは、FLAG-タグの表面発現について調べた後、抗体免疫または抗体スクリーニングのために使用された。
Cd107A発現トランスフェクタントの生成
キメララットCd107AプラスミドをCHO細胞にトランスフェクションした。
CD107A発現トランスフェクタントの生成
簡単に説明すると、CHO細胞を、完全なRPMI1 6 4 0培地(CRPMI;1 0%FBS、1m M N Aピルビン酸塩、5 0μ Mの2−メルカプトエタノールを含むRPMI1 6 4 0培地)中で、それらが3 0%コンフルエ 2.5μ gのプラスミドを7.5μ lのFugene6試薬(Roche)と混合し、細胞上に滴下した。 二日後、CHO細胞は、2mm EDTAを補充RPMI1640培地で剥離し、安定なトランスフェクタントのクローニングのための選択培地(cRPMIは20μ g/mlのピューロマイシンを補充)と96ウェル平底細胞培養プレート(25細胞/ウェル)に播種した。 10-12日培養した後、成長したクローンを抗FLAG抗体(M2)でスクリーニングした。 FLAGおよびCd107Aの最高表面レベルを発現するクローンの一つは、免疫のために使用されました。
免疫および細胞融合
3-10週齢の男性アルメニア近交系ハムスターは、2×106CHO.Cd107A-FLAG細胞と腹腔内注射(i.p.)によって週に一度3週間免疫した。 4×106安定にトランスフェクトされたBWZ.Cd107A-FLAG細胞を用いたブーストを、最初の免疫化の32日後にi.p.に与え、血清をCHO.Cd107A-FLAGおよびBWZの両方の表面染色Cd107a-FLAGトランスフェクタント。 三つの動物のうち二つは陽性であり、昇圧の3日後、脾臓細胞を採取し、そのうちの一つは脾腫を有していた二つの動物からプールした。 約2.0×108脾臓細胞および1.4×108ns0骨髄腫細胞を、添加剤(1mMピルビン酸ナトリウム、0.05mM2-メルカプトエタノールおよび抗生物質/抗真菌)を含むDMEM中で3回洗浄し、90gで10分間遠心分離した。 この時点から3 7℃で全てを保持し、ペレットをチューブをタップして溶解し、1分間穏やかに撹拌しながら1滴ずつ加温したポリエチレングリコール1 5 0 0(Roche)を添加した。 ペレットを、添加物を含むDMEMおよび2 0%FBS(DMEM−2 0)による注意深い洗浄(再懸濁なし)によって洗浄し、一晩培養した。 細胞を翌日に回収し、2×Hypoxanthine−aminopterin−thymidine(SIGMA)および1 0%h ybridoma cloning supplement(H CS)(PAA)を加えた1 0 0ml DMEM−2 0を添加した。 細胞懸濁液を9 6ウェルプレートに移した。 12日後、成長しているクローンからの上清は、BWZ.Cd107A-FLAGおよびCHO.Cd107A-FLAG上に存在する表面抗原の染色についてフローサイトメトリーによって試験されたが、BWZ上には存在しなかった。陰性対照として無関係なフラグタグ抗原をトランスフェクト36細胞。 特異的抗体を産生する9の12陽性クローンは、さらにヒポキサンチン-チミジンとHCSを補充DMEM-20を使用してサブクローニングされました。 唯一のクローン(SIM1)はまだサブクローニング後に抗体を生産し、これはさらにもう一度サブクローニングされました。 CD1 0 7a特異的ハムスター Igg抗体はfitc抗アルメニアハムスター Igg(Jackson Immunoresearch)によって検出された。 SIM1ハイブリドーマ由来の抗Cd1 0 7Aを、Hitrap Protein G HP(GE H Ealthcare,Life Sciences)および標準手順に従ってfitc結合、または製造業者のプロトコールに従ってAlexa4 8 8結合により精製した。
エフェクター細胞の生成
脾臓から単細胞懸濁液を調製した。 リンパ球をLymphoprep勾配を用いて単離し、ナイロンウールカラム上で実行してB細胞およびマクロファージを除去した。 IL−2活性化NK細胞(LAK)の生成のために、残りの細胞をIL−2中で一晩培養した。 翌日、非付着性細胞をPBSで洗浄することによって除去し、付着性NK細胞をIL-2、10%熱不活性化FBS、1%ストレプトマイシン/ペニシリン、1mmピルビン酸ナトリウムナトリウムピルビン酸、および50μ m2-メルカプトエタノールを補充したRPMIに維持した。 細胞を8-10日間培養した。 濃縮されたNK細胞または選別されたT細胞およびNK細胞の生成のために、ナイロンウール工程の後の陰性選択によって細胞を濃縮した。 NK細胞の濃縮のために、pan−マウスIgg Dynabeads(Invitrogen Dynal)を、マクロファージ(OX4 1)、T細胞(R7 3およびOX1 9)、およびB細胞(OX1 2およびOX3 3)に対する抗体で被覆した。 T細胞の濃縮のために、pan−マウスIggダイナビードを、マクロファージ(OX4 1)およびB細胞(OX1 2およびOX3 3)に対する抗体で染色した。 細胞は、4℃で30分間染色ビーズを用いた陰性選択の2つのステップによって濃縮された。 濃縮されたNK細胞は、約50-60%の純度を有し、脱顆粒研究のために使用された。 濃縮されたT細胞(純度7 9〜8 5%)を、FACS Aria(B D Biosciences)を使用してTCR+細胞についてさらに選別した。
脱顆粒アッセイ
標的細胞刺激中に抗ラットCd107A(SIM1)で染色することにより脱顆粒応答を測定するために、NKエフェクターおよびYAC標的細胞 NK細胞からの抗体刺激に対する脱顆粒応答を測定するために、我々は、抗Nkp46(Wen23)、抗NKR-P1A(3.2.3)、およびマウスIgg1アイソタイプコントロール(TIB96)の様々な濃度 翌日、プレートをPBSで洗浄し、CRPMIで遮断した後、sim1を含有するCRPMI中に懸濁した3×1 0 5個の濃縮NK細胞をウェル当たり添加した。 T細胞からの脱顆粒を測定するために、それらを選別し、IL−2と共にCRPMI中で2〜3日間培養した。 96ウェルの平底プレートを、CD3(IF4)、CD2(OX34)、またはIgMアイソタイプ対照(MM-30)に対する抗体で一晩コーティングした。 約3×1 0 5個のT細胞を、sim1を含有するCRPMI中にウェル当たり添加した。 次いで、細胞を洗浄し、適切な表面受容体に向かって抗体で染色し、FACS CantoまたはLSR II(B D Biosciences)を用いて分析した。
クロムリリースアッセイ
YAC-1標的細胞(5×106細胞/ml cRPMI)を3つ添加した。7Mbq51Crを37℃で1時間インキュベートし、15分ごとに攪拌した。 次いで、細胞を2%FBSを含むPBSで3回洗浄し、CRPMI中で1×1 0 5細胞/mlに再懸濁した。 LAKエフェクター細胞および標的細胞を、2 0 0μ lの最終体積中に指定された比率で播種した。 細胞を遠心分離し、3 7℃で4時間インキュベートした。5 1Crの特異的放出を、Cobra auto−gamma(Packard)を用いて測定した。
結果
Cd107Aに対する抗体を作成するために、ラットCd107Aの細胞外膜領域、ラットCD8の膜貫通領域、および表面発現を検出するための3’末端FLAGタグを含む発現ベクターを作製した(図1A)。 ベクターをCHO細胞およびBWZにトランスフェクトした。36T細胞株および抗FLAG抗体(M2)を用いてCd107A発現についてスクリーニングした(図1B)。 安定的に形質移入されたCD1 0 7A CHO細胞を、ns0骨髄腫細胞株との融合の3日前に、安定的に形質移入されたCd1 0 7A BWZ細胞の最終的な増強と共に、週に1回 異なるクローンからの上清は、BWZ.Cd107A-FLAGに対する特異性について試験したが、無関係なFLAGタグ付きBWZではなかった。36件の口コミ 一つのクローン、SIM1は、Cd107A発現トランスフェクタントに特異的に結合するが、FLAGトランスフェクション対照には結合しないことが見出された(図1C)。

図1. 抗ラットCd107Aモノクローナル抗体(SIM1)の生成。 (A)リーダーペプチド、FLAG−tag、Cd1 0 7a挿入物、およびCD8の膜貫通ドメインを有するPM X発現ベクターの概略的なベクターマップ。 (B)チャイニーズハムスター卵巣とBWZを安定的にトランスフェクトした。3 6個の細胞を、抗FLAG抗体(M2)(陰影ヒストグラム)を用いて、FLAGタグ付きCd1 0 7Aの細胞表面発現について試験した。 陰性対照は二次抗体単独である(透明ヒストグラム)。 (C)Cd1 0 7A−FLAGまたは無関係な抗原(NKR−P1F−FLAG)をトランスフェクトしたBWZ細胞を、ハムスター対照血清、SIM1上清、または抗FLAG抗体(M2)で染色した。
クローンSIM1は、さらに潜在的にフローサイトメトリーでラットCd107Aと交差反応する可能性が二つの市販のCd107a抗体と並行して機能アッセイでテス 試験した抗体クローンは、Abcam(フローサイトメトリーでヒト、ラット、マウス、および霊長類と交差反応する)からのH4A3およびLiffance Biosciencesからの抗体クローンLS−C8 5 8 0(製造業者のウェブサイトによると、免疫組織化学およびウェスタンブロットでマウス、ヒトおよびラットからのCd1 0 7Aと交差反応する)であった。 私たちのSIM1抗体クローンは、標的細胞の存在下で脱顆粒細胞を同定し、標的の非存在下ではほとんど背景染色を示さなかった(上のパネル図2A)。 クローンH4A3は、標的細胞刺激後のNK細胞の最も高い割合を染色した(中央パネル)。 しかし、標的細胞の非存在下でも高レベルの背景染色があり、非特異的結合を示していた。 もしあれば、非常に低いレベルの脱顆粒を、LS−C8 5 8 0mAbクローン(下のパネル)によって測定した。 これらの抗体の特異性は、Bwz.Cd107A-FLAGトランスフェクタントの陽性染色によって確認されたが、BWZは確認されなかった。NKR-P1F-フラグ制御(図2B)。 ヒトCd107Aに結合することが示されている抗体クローンH4A3(16)は、ラットCd107AトランスフェクションBWZ細胞を染色せず、ラットCd107Aとの交差反応がないことを示している。抗マウスCd107AクローンID48もラットCd107Aトランスフェクタントを染色することができなかった。 一方、非結合のLS−C8 5 8 0は、Cd1 0 7a形質移入細胞の特異的染色を示した(データは示さない)。 しかしながら、LS−C8 5 8 0クローンは非結合抗体としてのみ利用可能であり、これは脱顆粒試験には適さない。 Ls-C8580をAlexa488に共役させるために私たちの研究室で繰り返し試みは、LS-C8580の小さなサンプルサイズと濃度が悪い共役の原因である可能性がありますが、残念ながら、任意の強力な染色コンジュゲートを提供していません。 コンジュゲートLS-C8580は、Cd107Aトランスフェクト細胞の減少したが特異的な染色を示す(図2B)が、図2Aに示すように、我々は、このコンジュゲートを用いた機能的アッセイ中に脱顆粒細胞を検出することができませんでした。 結論として、SIM1mAbは、標的細胞での刺激後に脱顆粒ラットNK細胞を特異的に染色する。

SIM1はナチュラルキラー(NK)およびCD8t細胞からの脱顆粒を測定します。 (A)脱顆粒細胞百分率を、YAC−1標的細胞を刺激として、または刺激なしで、抗Cd1 0 7a抗体SIM1、H4A3、およびLS−C8 5 8 0を用いて測定した。 4つの代表的な実験の1つを示す(B)。 BWZ.Cd1 0 7A−FLAG細胞株をSIM1、H4A3、LS−C8 5 8 0、またはID4 8抗体クローンで染色した。 BWZ.無関係なフラグタグ抗原でトランスフェクトされた36細胞(BWZ.Nkr−P1G−FLAG)を陰性対照として含め、(C)濃縮NK細胞を、プレート結合抗Nkp4 6、抗nkr−P1A、またはマウスIgg1をアイソタイプ対照として刺激し、SIM1を使用して、脱顆粒細胞の百分率を測定した。 NKP4 6+(Wen2 3)またはNKR−P1Abright(3. (D)TCR+細胞を選別し(純度9 9%)、IL−2中で2〜3日間培養した。 次いで、細胞を、プレート結合抗CD3および抗CD2または抗CD3のためのマウスIgmアイソタイプ対照で刺激した。 下のパネルは、抗CD3および抗CD2による刺激およびSIM1アイソタイプ対照(FITC h amster Iggポリクローナル)による染色を示す。 T細胞を、R73-Alexa647および3.2.3-PB抗体を用いて選別し、R73+/3.2.3−細胞上でゲーティングした。 示されたデータは、三つの別々の独立した実験の一つの代表的な実験からのものである。
プレート結合抗体を介したNK受容体の活性化の直接刺激は、脱顆粒を誘導するための別の強力な方法です。 この機能アッセイでSIM1クローンをテストするために、我々は活性化受容体Nkp46とNKR-P1Aに向かって抗体でコーティングされたプレート上に濃縮NK細胞を 陰性対照として、プレートは、マウスIgg1アイソタイプ対照で被覆された。 SIM1抗体による染色は、それぞれ5μ g/ml抗Nkp46または抗NKR-P1Aでコーティングされたプレート内のNK細胞刺激後に25.5または44%脱顆粒細胞を同定した。 脱顆粒細胞の割合は、プレートがより高い濃度の刺激抗体(10μ g/ml)で被覆されたときにさらに増加した。 脱顆粒は、マウスIgg1アイソタイプコントロールでコーティングされたウェルで誘導されませんでした。
我々は明らかに我々のSIM1抗体を用いて、標的細胞または活性化受容体に対する抗体のいずれかで刺激されたNK細胞における脱顆粒を見た。 また、細胞傷害性T細胞でもこれを確認したかったのです。 T細胞を脾臓細胞から選別し、IL−2中で2〜3日間培養した。 次いで、t細胞をプレート結合抗CD3および抗CD2で刺激した(図2D)。 脱顆粒は、2日目および3日目の両方で抗CD3および抗CD2で刺激したときに培養CD8+T細胞から測定した。 脱顆粒は、非細胞傷害性CD4T細胞から、またはアイソタイプ対照抗体による刺激後に測定されず、さらに、我々のSIM1抗体の特異性を実証した。
リンホカイン活性化キラー(LAK)細胞は、IL-2中のNK細胞を7-10日間培養することによって作成され、一般的に細胞毒性を研究するためのクロム放出アッセイで非常に強力なエフェクター細胞として使用されているため、高レベルの脱顆粒を生成することができるはずである。 LAK細胞からの脱顆粒を測定するために、我々は最初に1を使用しました:標的に対するエフェクターの比が、予想外に低いレベルの脱顆粒を見出した(データは示されていない)。 しかし、最適なエフェクター対ターゲット比を見つけるために滴定を行うと、エフェクター対ターゲット比が1を下回ると脱顆粒レベルが増加することが したがって、脱顆粒アッセイの最適な比は、細胞毒性のレベルがより高いエフェクター:標的比とともに増加する細胞毒性アッセイとは対照的である(図3B)。
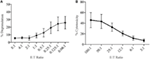
図3. ローエフェクター:標的比は、ラットNK細胞を用いた脱顆粒アッセイにおける適切な感度を確保するために重要である。 (A)異なるエフェクター:標的比でYAC−1標的に対してIL−2中で8〜1 0日間培養したLAK細胞の脱顆粒。 (B)YAC-1標的細胞に対するIL-2培養LAKの細胞毒性は、8-10日目に完了したクロム放出アッセイで確認した。 すべてのグラフは、SDを示すバーを持つ三つ以上の別々の実験の累積です。
ディスカッション
ラットの脱顆粒アッセイにおけるSIM1と異なる市販のCd107A抗体の初期試験では、我々は現在の文献(12、16、17)に基づいて、標的よりも多くのエフェクター細胞に向かってスキューとの比をターゲットにエフェクターの小さな範囲を選択しました。 エフェクター対標的細胞比は紙ごとに異なるが、エフェクター対標的比を滴定した以前の研究では、マウスNK細胞からの最適な脱顆粒はYAC-1標的細胞(18)と4.5:1:1 (12). しかし、より広い範囲のエフェクター対ターゲット比を使用する場合、我々は、ラットLAK細胞を使用した脱顆粒が、エフェクター細胞あたり四つ以上のターゲットを使 ラットと他の種との間の最適エフェクター:標的比のこの差は、上記の研究におけるヒトおよびマウスエフェクター対標的比滴定は、同じ種に由来する標的細胞を使用したため、使用される標的細胞のタイプによるものである可能性がある。 エフェクター細胞は、同じ種からの標的細胞に対してより敏感であり、したがって、活性化されるために必要な標的細胞の数が少ない。 我々の研究で使用されるYAC-1細胞株は、ラットNK細胞からの細胞毒性を刺激するために長年にわたって標準となっているマウスT細胞リンパ腫である。 我々は、ラット標的細胞を使用すると、NK細胞の強い刺激をもたらし、その後、脱顆粒を誘導するために必要とされる可能性があることを排除することは
また、この研究から、細胞毒性アッセイに使用されるエフェクター対標的比は、エフェクター細胞における最適な脱顆粒応答を測定するために必要な比 これは、これらの2つのアッセイの読み取りが異なるため、細胞毒性が標的細胞死を測定し、脱顆粒が標的に対するNK応答を測定するため、驚くべきこ
結論として、我々はラットCd107A(SIM1)に対する抗体を調達し、ラットの細胞傷害性リンパ球における脱顆粒を検出する能力を特徴としている。 我々は、SIM1は脱顆粒細胞に特異的であることを示しており、脱顆粒プロトコルの最適化を通じて、我々はエフェクターを使用していることを決定した:1:4 抗ラットCd107A(SIM1)の開発は、より良い分析とラットリンパ球の細胞傷害性応答の特性評価を可能にし、ラットの多くの疾患モデルで貴重なツールとなこの研究は、ノルウェーの国立動物研究局(FDU)によって承認されています(許可番号:ID-1698)。
著者の貢献
asは、発現分析、機能的アッセイ、および原稿の執筆を担当しています。 K-ZDは、cDNAクローニングとトランスフェクタントの生成を行っています。 JTVは、プロジェクトの計画と監督、原稿の執筆に携わってきました。 LKは、予防接種、ハイブリドーマ技術、原稿の執筆、およびプロジェクトの監督を担当しています。
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
謝辞
著者は、実験室での技術支援のためのUlla HeggelundとStine Martinsen、および予防接種の助けのためのオスロ大学病院Rikshospitaletの比較医学部門の動物施設のスタッフに感謝 科学的な議論のためのMarit Inngjerdingenに感謝します。
資金調達
この研究は、オスロ大学、南東ノルウェー地域保健(2009104)、およびLegatet til Henrik Homans Mindeによって資金提供されました。
1. オレンジ色のJS。 溶解性NK細胞免疫シナプスの形成および機能。 ナト-レヴンオール(2008) 8(9):713-25. doi:10.1038/nri2381
PubMed Abstract|CrossRef Full Text/Google Scholar
2. Metkar SS,Marchioretto M,Antonini V,Lunelli L,Wang B,Gilbert RJ,et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J,Keefe D,Boulant S,Boucrot E,Walch M,Martinvalet D,et al. エンドソーム膜のパーフォリン細孔は、エンドサイトーシスされたグランザイムBの標的細胞のサイトゾルへの放出を誘発する。 ナト-イムノール(2011) 12(8):770-7. 土井:10.1038/ni.2050
PubMed Abstract|CrossRef Full Text|Google Scholar
5. Voskoboinik I,Whisstock JC,Trapani JA. Perforinおよびgranzymes:機能、機能障害および人間の病理学。 ナト-レヴンオール(2015) 15(6):388-400. 土井:10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM,Omdal BK,Dai KZ,Martens A,Benestad HB,Vaage JT,et al. 第二の予防的MHCミスマッチ骨髄移植は、致命的な移植片対宿主疾患なしでラット急性骨髄性白血病(BNML)から保護します。 移植(2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1f
PubMed Abstract|CrossRef Full Text|Google Scholar
14. 大西M,木下S,森川Y,渋谷A,Phillips J,Lanier LL,et al. レトロウイルスを介した発現クローニングの応用。 Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. 頻繁に繰り返されるヘルペスの患者のNK細胞の減らされた脱顆粒。 クリンワクチン-イムノール(2011) 18(9):1410-5. ドイ:10.1128/CVI。05084-11
PubMed Abstract|CrossRef Full Text|Google Scholar
17。 Bryceson YT,Fauriat C,Nunes JM,Wood SM,Björkström NK,Long EO,et al. フローサイトメトリーによるヒトNK細胞の機能解析。 Methods Mol Biol(2 0 1 0)6 1 2:3 3 5−5 2. 土井:10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
