はじめに
細胞または組織の再生と再生は、成体生物の二つの主要な開発要件です。 両方のプロセスは、幹細胞の集団を出発点として持ち、通常は”ニッチ”と呼ばれる特定の環境に位置し、幹特性を維持するために必要なシグナルを提供し、または必要な異なる細胞タイプに分化する(図1)。 幹細胞の増殖および分化は、置換する必要がある細胞の死と調整されなければならない。 また、適切な細胞再生のためには、細胞遊走、エピジェネティクス、細胞通信などのプロセスも必要です。 速い更新組織は、より高い有糸分裂活性によって認識することができる。 逆に、遅い更新のティッシュはより少ない有糸分裂を含み、またsomemitosisを示すかもしれない非更新区域からeasilyrecognizedできないかもしれません。 増殖中の幹細胞の運命の決定組織の再生および恒常性に直接影響する。 したがって、バランスのとれた細胞分裂と分化を維持する調節機構を理解することが重要です。 細胞外シグナル(例えば、組織微小環境、細胞内ROS、およびサイトカイン)だけでなく、細胞内因子(例えば、エピジェネティックな機械、transcriptionfactorsおよびDNA損傷応答)は、幹細胞分裂の調節に関与している。
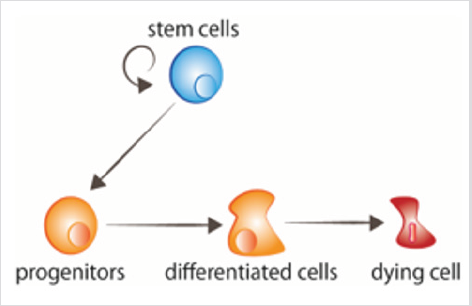
図1:細胞ターンオーバー幹細胞が増殖し、その後にシグナルを受け取る前駆細胞に分化する。 老化した細胞は死ぬための信号を受け取る。
幹細胞は、一つの幹細胞と一つのコミットされた娘細胞が起源である非対称分裂、二つのコミットされた娘細胞を起源とする対称コミットメント、および幹細胞の特性を維持する二つの娘細胞をもたらす対称分裂の2つの可能な選択肢を示す図2。 非対称分裂は幹細胞の安定した集団の維持を可能にする唯一のメカニズムであると予測できたが、lineagetracingexperimentsからの現在のデータは、ほとんどの組織で、幹細胞の増殖と分化したオフスプリングの生成との間のバランスが幹細胞集団全体のレベルで達成されることを示した。分化または細胞の損傷による幹細胞の損失は、このギャップを埋めるために対称分裂を誘導する。 幹細胞分裂後、分化プロセスに従う細胞は、転写因子の組み合わせによって定義される異なる段階を通過し、遺伝子の適切なレパートリーの活性を制御し、それらのコミットメントと末端分化を可能にする。 各celllineageの決定の順序の最終生成物はspecificdifferentiated細胞のタイプ図3aである。ほとんどの状況の下で、細胞同一性-正常な微分のプロダクト-はstablewithinティッシュであり、維持は正常なtissuefunctionのために重大である。 このような安定性は、エピジェネティックな調節(例えば、ヒストン脱メチル化およびアセチル化)によって達成され、組織特異的遺伝子発現の遺伝的パターンをもたらす。
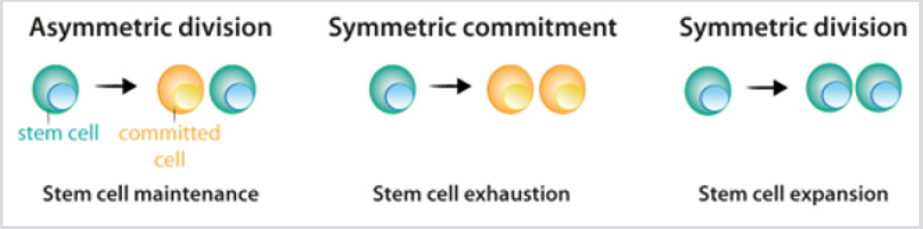
図2:幹細胞の分裂パターン。
a)非対称分裂の間、幹細胞は1つの幹細胞を生じさせ、幹細胞集団を維持し、1つの細胞は分化に関与するようになる。
a)非対称分裂の間、幹細胞は1つの幹細胞を生じさせ、幹細胞集団を維持する。
b)対称的なコミットメントの間に、幹細胞分裂は二つの娘細胞を生じさせ、分裂にコミットされた。
c)対称分裂の間、幹細胞分裂は二つの幹細胞を生じる。 テキストで説明されているように、現在の実験データは、幹細胞集団を維持しながら三つの分裂様式が起こり得ることを示している。しかし、セルの同一性の損失が発生する可能性があります。
しかし、セルの同一性の損失が発生する可能性が 実際に、細胞fromDrosophilaのimaginalディスクはtransdetermineおよびacquireaの移植の後の新しい大人の運命にできます。 この状況では、細胞外の手がかりは、より多くのstemstateまたは新しい分化状態のいずれかの特性を取得するために、いくつかの前駆体または分化細胞を再プ 細胞がその同一性を変化させることができる二つのメカニズムがある:脱分化、および転移。 脱分化とは、分化またはコミットされた細胞が成熟していない細胞図3bの特徴を獲得するプロセスを指す。 脱分化の最も劇的な例は、限られた数の翻訳因子の過剰発現による多能性細胞(誘導多能性幹細胞、iPSC)への最終分化細胞のin vitro変換である。 対照的に、分化した細胞が転写プログラムを変化させ、別の分化した細胞型に変換すると、分化が起こる。 このプロセスは、新しいdifferentiatedcellへの変換の前にアレス成熟段階に向かって脱分化の中間段階を介して、または直接、中間段階なし図3c-d.MyoDの異所性発現によ
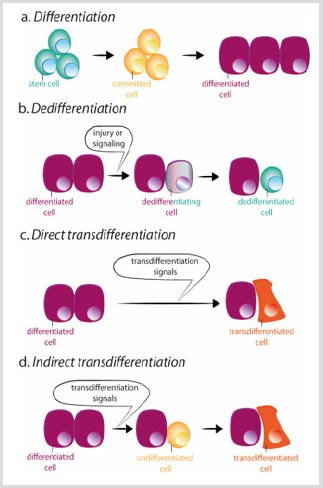
図3:分化、脱分化およびトランス分化のスキーム。
a)正常な分化の間に、幹細胞はコミットされた細胞を生じさせ、それは順番に異なる細胞型で分化する。
b)脱分化は、分化した細胞による幹細胞の特性の獲得からなる。
b)脱分化は、分化した細胞による幹細胞の特性の獲得からなる。 トランス分化は、直接的または間接的な方法で起こり得る。
c)直接トランス分化の間、分化した細胞は、通常、例えば外分泌と内分泌膵臓細胞とのように相互に関連する別の細胞型の転写プログラムを獲得し、別の分化した細胞になる。
d)間接トランス分化中に、分化した細胞は、他の細胞型の新しい転写プログラムを採用する前に脱分化する。
脱分化および移行分化もまた、傷害または組織の喪失に応答して自然な方法で起こる。例えば、脱分化は、urodele両生類における四肢形成の間に自然に起こる。 四肢切断後、創傷に隣接する細胞は脱分化し、増殖し、最終的には同じ細胞型に再分化して失われた四肢のすべての成分を生成する未分化細胞のblastema thatconsistsを 自然なtransdifferentiationは間接的に起こります:最初に、細胞は脱分化します;そして次に自然なdevelopmentalprogramは活動化させ、thenew系統に区別するように細胞がします。 Tsonisと共同研究者は、自然イモリにおける形質転換のメカニズム。 彼らは、レンズが除去されると、背側虹彩から色素上皮細胞が分化し、欠けている組織を再生することを発見した。 これを達成するためには、彩色された上皮細胞は新しいレンズの細胞を作成するために最初に脱分化し、proliferateなければなり次にレンズのthematureの細胞に分化 両方の状況で–同じ細胞型または新しい細胞型への脱分化と再分化–シグナル伝達経路の複雑なネットワークは、完璧な時点で各細胞によって取得された転写プログラムを制御することができる。
hus、遺伝子発現の時空間的制御は、動物の恒常性の間、およびaregenerativeプロセスの間に継続的に必要とされる。
hus、遺伝子発現の時空間的制御は、動物の恒常性 しかし、再生中に、細胞は、多くの場合、homeostasisare中に希少なofdedifferentiationとtransdifferentiationプロセスを含む、細胞レベルでmoreprofound決定を行う必要があり、新しい状況にmustre-調整します。
- Clevers H,Loh KM,Nusse R(2014)幹細胞シグナル伝達。 組織の再生と再生Wntシグナル伝達とステムセル制御のためのintegralprogram。 科学346(6205):1-9. Leblond C P、Walker B(1956)Renewal of cell population36(2):255-276。
- Roostaee A,Benoit YD,Boudjadi S,Beaulieu JF(2016)epigenetics in intestinal Epithelial Cell Renewal. J Cell Physiol2 3 1(1 1):2 3 6 1−2 3 6 7。
- Ito K、Ito K(2016)代謝と細胞の運命の決定と細胞の再生の制御。 Annu Rev Cell Dev Biol32:399-409.
- Simons BD,Clevers H(2011)恒常性幹細胞selfrenewalin成人組織のための戦略. セル145(6):851-862。
- Yang Y,Akinci E,Dutton JR,Banga A,Slack JM W,et al. ら(2 0 1 3)マウス胚肝細胞のβ細胞様表現型への段階特異的再プログラミング。 Mech Dev130(11-12):602-612。
- Merrell AJ、Stanger BZ(2016)成人細胞の可塑性in vivo:脱分化とトランス分化はスタイルに戻っています。 Nat Rev MolCell Biol17(7):413-425.
- Worley MI,Setiawan L,Hariharan IK(2012)ショウジョウバエ成虫ディスクにおける再生と変換。 Annu Rev Genet46:289-310.
- Raff M(2003)成体幹細胞の可塑性:事実またはアーティファクト? 平成19年1月22日に廃止された。
- Takahashi K,Yamanaka S(2006)DefinedFactorsによるマウス胚および成人線維芽細胞培養からの多能性幹細胞の誘導。 セル126(4):663-676。
- Tapscotr SJ,Davis RL,Thayer MJ,Cheng PF,Weintraub H,et al. (1988)MyoDi:A Nuclear Phosphoprotein Reqiring a Myc Homology Region toConvert Fibroblasts to Myoblasts. Science2 4 2(4 8 7 7):4 0 5−4 1 1.
- Jopling C,Boue S,Izpisua Belmonte JC(2011)脱分化、トランス分化およびリプログラミング:再生への三つのルート。Nat Rev Mol Cell Biol1 2(2):7 9−8 9。
- Tsonis PA,Madhavan M,Tancous EE,Del Rio-Tsonis K(2004)Del Rio-Tsonis,K.レンズ再生のイモリsアイビュー。 Int J Dev Biol48(8-9):975-980.
