学習目標
- 単純なイオン性化合物の化学式を書きます。
- 化学式で多原子イオンを認識します。
私たちはすでに単純なイオン化合物のためのいくつかの化学式に遭遇しました。 化学式は、化合物中の元素とこれらの元素の比率の簡潔なリストです。 化学式が何を意味するのかをよりよく理解するためには、イオン化合物がそのイオンからどのように構築されるかを考慮する必要があります。イオン性化合物は、結晶と呼ばれる規則的な三次元配列に正イオンと負イオンが交互に存在する(図\(\PageIndex{1}\))。 あなたが見ることができるように、配列内には個々の\(\ce{NaCl}\)”粒子”はありません。 しかし、化合物を記述する方法として、可能な限り低い整数で表される塩化物イオンに対するナトリウムイオンの比を使用することができる。 塩化ナトリウムの場合、ナトリウムイオンと塩化物イオンの比率は、最も低い整数で表され、1です:したがって、化合物を表すために\(\ce{NaCl}\)(1\(\ce{Na}\)記号と1\(\ce{Cl}\)記号)を使用します。 したがって、\(\ce{NaCl}\)は塩化ナトリウムの化学式であり、これは化合物中の異なるイオンの相対数を簡潔に記述する方法です。 巨視的なサンプルはNaClの組の無数で構成されます;各々の個々の組は方式の単位と呼ばれます。 \(\Ce{NaCl}\)結晶は個々の\(\ce{NaCl}\)単位で構成されていると考えるのは便利ですが、図\(\PageIndex{1}\)は、単一のイオンが他の単一のイオンと排他的に関連していないことを示 各イオンは反対の電荷のイオンに囲まれています。P>
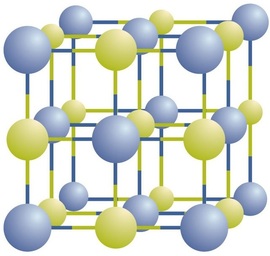
イオン性化合物の式は、いくつかの規則に従います。 最初に、陽イオンは陰イオンの前に書かれています。 ほとんどの金属は陽イオンを形成し、ほとんどの非金属は陰イオンを形成するため、式は通常、最初に金属をリストし、次に非金属をリストします。 第二に、電荷は式に書かれていません。 イオン性化合物では、式に電荷が含まれていないにもかかわらず、成分種はイオンであり、中性原子ではないことを覚えておいてください。 最後に、イオン性化合物の適切な式は常に正味のゼロ電荷を持ち、総正電荷は総負電荷と等しくなければならないことを意味する。 イオンの任意の組み合わせの適切な式を決定するには、化合物中の総正電荷と負電荷のバランスをとるために必要な各イオンの数を決定します。このルールは、最終的には、物質が全体的に電気的に中立であるという事実に基づいています。
慣例により、添字が存在しない場合は1つの原子しか存在しないと仮定します。 下付き文字として1は使用しません。リチウムイオンと臭化物イオンからなるイオン化合物を見ると、リチウムイオンは1+電荷を持ち、臭化物イオンは1−電荷を持つことがわかります。 これらの電荷のバランスをとるために必要なのは、それぞれの1つのイオンだけです。 臭化リチウムの式は\(\ce{LiBr}\)である。
マグネシウムと酸素からイオン性化合物が形成されると、マグネシウムイオンは2+電荷を有し、酸素原子は2−電荷を有する。 これらのイオンの両方が臭化リチウム中のイオンよりも高い電荷を有するが、それらは依然として一対一の比率で互いにバランスをとる。 したがって、このイオン性化合物の適切な式は\(\ce{MgO}\)です。
マグネシウムと塩素によって形成されるイオン性化合物を考えてみましょう。 マグネシウムイオンは2+電荷を持ち、塩素イオンは1−電荷を持つ:
\
それぞれの1つのイオンを組み合わせることは、正と負の電荷の完全なバラン これらの電荷のバランスをとる最も簡単な方法は、各マグネシウムイオンに2つの塩化物イオンが存在すると仮定することです。
\
正と負の電荷のバランスが取れています。 このイオン性化合物の化学式は\(\ce{MgClCl}\)と書くことができますが、特定のタイプのイオンが複数ある場合は数値の添字を使用するのが慣例です—\(\ce{Mgcl2}\)。 この化学式は、この式にはマグネシウムイオンが1つ、塩化物イオンが2つあることを示しています。 (二原子元素塩素の分子として式の「Cl2」部分を読まないでください。 この化合物には二原子元素として塩素は存在しない。 むしろ、それは2つの個々の塩化物イオンとして存在する。)慣例により、最も低い整数比がイオン性化合物の式で使用される。 化学式\(\ce{Mg2Cl4}\)はイオンと電荷を1:2の比率で平衡させていますが、最小の整数比ではありません。
イオンの比がそれほど明白でない化合物の場合、式の添字は電荷を交差させることによって得ることができる:一方のイオンの電荷の絶対値を他のイオンの添字として使用する。 この方法は、図3.3.2に概略的に示されています。
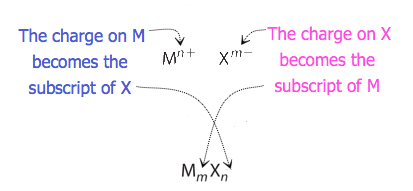
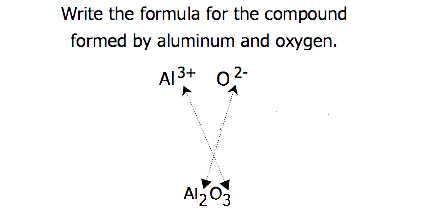
電荷を交差させるとき、経験式を書くために添字を最も単純な比率に減らす必要があることがあります。 例えば、Pb4+およびO2−によって形成される化合物を考える。 イオン上の電荷の絶対値を添字として使用すると、式Pb2O4が得られます。 これは、その正しい経験式Pbo2に簡素化します。 経験式は、一つのPb4+イオンと二つのO2−イオンを持っています。 例\(\PageIndex{1}\)
イオンの各ペアで構成されるイオン化合物の化学式を記述します。
例\(\PageIndex{1}\)
例\(\PageIndex{1}\)
例\(
- ナトリウムイオンと硫黄イオン
- アルミニウムイオンとフッ化物イオン
- 3+鉄イオンと酸素イオン
ソリューション
- 価電子シェルオクテットを得るために、ナトリウムは1+電荷を持つイオンを形成し、硫黄イオンは1+電荷を持つイオンを形成する。2チャージがあります。 硫黄イオン上の2電荷のバランスをとるためには、ナトリウム1+イオンが必要である。 式を\(\ce{NaNaS}\)と書くのではなく、慣習的に\(\ce{Na2S}\)に短縮します。
- アルミニウムイオンは3+電荷を持ち、フッ素によって形成されるフッ化物イオンは1−電荷を有する。 アルミニウムイオン上の3+電荷のバランスをとるためには、三つのフッ素1−イオンが必要である。 この組み合わせは\(\ce{Alf3}\)と書かれています。
- 鉄は二つの可能なイオンを形成することができますが、3+電荷を持つイオンはここで指定されています。 酸素原子はイオンとして2電荷を有する。 正と負の電荷のバランスをとるために、我々は最小公倍数—6を見て:二つの鉄3+イオンは6+を与え、三つの2−酸素イオンは6−を与え、それによって全体的な正と負の電荷のバランスをとる。 したがって、このイオン性化合物の式は\(\ce{Fe2O3}\)です。 または、図3.3.2に示すcrossing chargesメソッドを使用します。P>P>イオンの各ペアで構成されるイオン化合物の化学式を記述します。
運動\(\PageIndex{1}\)
イオンの各ペアで構成されるイオン化合物の化学式を書/li>
回答a:
CaO
回答b:
CuS
回答c:
Cu2S
多原子イオン
いくつかのイオンは、共有結合して一緒に結合した原子のグループからなり、全体の電荷を持っています。 これらのイオンは複数の原子を含んでいるので、多原子イオンと呼ばれます。 いくつかの多原子イオンのルイス構造、名前および式は、表3.3.1に記載されています。表\(\PageIndex{1}\):いくつかの多原子イオン
多原子イオンは、どのような方法で変更することはできません式、名前、および電荷を定義しています。
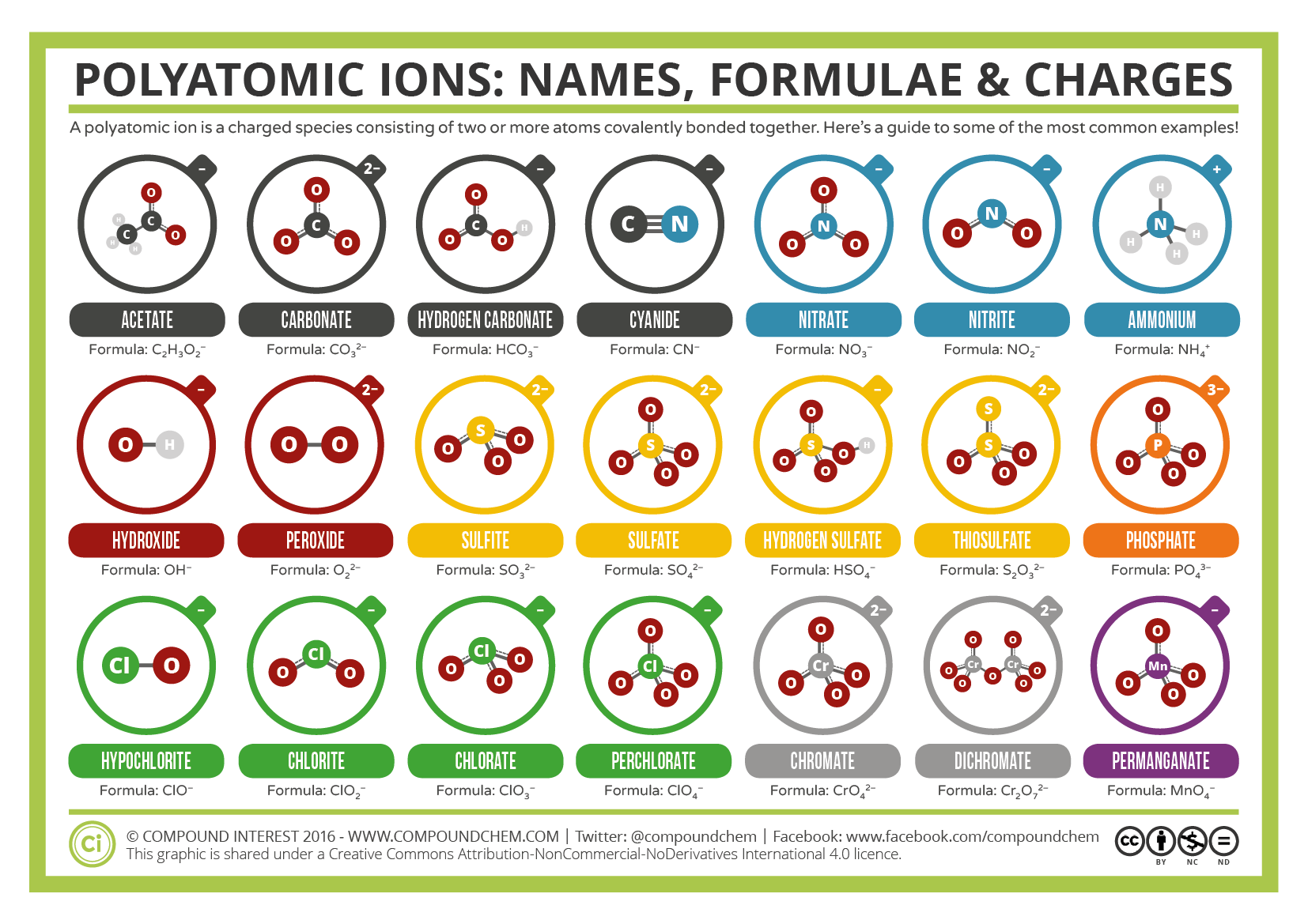
表\(\PageIndex{1}\):いくつかの多原子イオン
多原子イオンは、どのような方法で変更することはできません式、名前、および電荷を定義しています。 表\(\PageIndex{2}\)は、最も一般的な多原子イオンのイオン名とイオン式を示しています。 例えば、\(\ce{NO3^{-}}\)は硝酸イオンであり、1つの窒素原子と3つの酸素原子と全体の1電荷を持っています。 図\(\PageIndex{2}\)は、最も一般的な多原子イオンを示しています。
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. 残りの多原子イオンはすべて負に帯電しているため、アニオンとして分類されます。 しかし、これらのうちの2つ、水酸化物イオンとシアン化物イオンのみが、典型的には負に荷電した粒子を示す接尾辞「-ide」を使用して命名される。 すべてが酸素を含む残りの多原子アニオンは、別の非金属と組み合わせて、多原子単位内の酸素の数が変化し得る一連の一部として存在する。 このテキストのいくつかのセクションで繰り返し強調されているように、二つの化学式が共通の化学名を共有すべきではありません。 単一の接尾辞”-ide”は、関連する多原子系列のアニオンの名前を区別するには不十分です。 したがって、対応する多原子イオンが系列の一部であることを示すために、”-ate”および”-ite”接尾辞が使用される。 さらに、これらの接尾辞はまた多原子イオンの内で含まれている酸素の相対的な数を示します。 名前が”-ate”で終わるすべての多原子イオンには、名前が”-ite”で終わる多原子アニオンよりも多くの酸素が含まれていることに注意してください。「残念なことに、遷移金属を命名するための一般的なシステムと同様に、これらの接尾辞は、多原子イオン内に含まれる酸素の相対的な数を示すだけで 例えば、NO3−1と記号化された硝酸イオンは、NO2−1と記号化された亜硝酸塩イオンよりも1つ多くの酸素を有する。 しかし、硫酸イオンはSO4−2として象徴されている。 硝酸イオンと硫酸イオンの両方が”-ate”接尾辞を共有しているが、前者は三つの酸素を含むが、後者は四つを含む。 さらに、硝酸イオンと亜硫酸イオンの両方に3つの酸素が含まれていますが、これらの多原子イオンは共通の接尾辞を共有していません。 残念ながら、これらの接尾辞の相対的な性質は、多原子イオンのイオン式/イオン名の組み合わせを単に記憶する必要があることを義務付けています。
多原子イオンを含むイオン化合物の式を構築するためのルールは、単原子(単原子)イオンを含む式の場合と同じです:正と負の電荷はバランスを取らな 電荷のバランスをとるために特定の多原子イオンの複数が必要な場合は、多原子イオンの式全体を括弧で囲む必要があり、数値の添字は括弧の外に これは、添字が多原子イオン全体に適用されることを示すためである。 二つの例を以下に示します。

例\(\PageIndex{2}\)
イオンの各ペアで構成されるイオン化合物の化学式を書きます。p>
- カリウムイオンと硫酸イオン
- カルシウムイオンと硝酸イオン
溶液
- カリウムイオンは1+の電荷を持ち、硫酸イオンは2−の電荷を持つ。 硫酸イオンの電荷のバランスをとるには2つのカリウムイオンが必要なので、適切な化学式は\(\ce{K_2SO_4}\)です。
- カルシウムイオンは2+の電荷を持ち、硝酸塩イオンは1−の電荷を持つ。 各カルシウムイオンの電荷のバランスをとるには、二つの硝酸塩イオンが必要です。 硝酸塩の式は括弧で囲まれていなければなりません。 したがって、このイオン性化合物の式として\(\ce{Ca(NO3)2}\)と書きます。P>P>イオンの各ペアで構成されるイオン化合物の化学式を記述します。
運動\(\PageIndex{2}\)
イオンの各ペアで構成されるイオン化合物の化学式を書
- マグネシウムイオンと炭酸イオン
- アルミニウムイオンと酢酸イオン
回答a:
Mg2+とCO32-=Mgco3
回答b:
Al3+とC2H3O2-=Al(C2H3O2)3
認識イオン性化合物
イオン性化合物を認識するには二つの方法があります。 第一に、金属元素と非金属元素との間の化合物は通常イオン性である。 例えば、Cabr2は、金属元素(カルシウム、2A族金属)および非金属元素(臭素、7A族非金属)を含む。 したがって、それはイオン性化合物である可能性が最も高い。 (実際には、それはイオンです。 対照的に、化合物NO2は、両方とも非金属である2つの元素(第5a族の窒素および第6A族の酸素)を含む。 イオン性化合物ではなく、共有結合性化合物の範疇に属する。 また、窒素と酸素のこの組み合わせは、指定された電荷を持っていないので、亜硝酸塩イオンではないことに注意してください。あなたが化合物中の多原子イオンの式を認識している場合、第二に、化合物はイオン性です。
第二に、化合物中の多原子イオンの式を認識している場 たとえば、式\(\ce{Ba(NO3)2}\)が表示されている場合、「NO3」の部分を硝酸イオン\(\rm{NO_3^-}\)と認識することができます。 (イオン化合物の式を書くための規則は、イオン電荷を含めることではないことに注意してください。 これは、式の他の部分、\(\ce{Ba}\)が実際には\(\ce{Ba^{2+}}\)イオンであり、2+電荷は2つの硝酸塩イオンからの全体的な2電荷のバランスをとるという手掛かり したがって、この化合物もイオン性である。例\(\PageIndex{3}\)
各化合物をイオン性またはイオン性ではないと識別します。ce{NA2O}\)
溶液
- \(\ce{Na2O}\)
- \(\ce{Pcl3}\)
- \(\ce{NH4Cl}\)
溶液
溶液
溶液
溶液したがって、\(\ce{Na2O}\)はイオン性であると予想されます。
各化合物をイオン性またはイオン性ではないと識別します。
各化合物をイオン性またはイオン性ではないと識別します。
各化合物をイオン性またはイオン性ではないと識別します。ce{(NH4)3PO4}\)
イオン
答えc:
イオン
答えd:
イオンではない
よく見る:血液と海水
科学は長い間、血液と海水が類似した組成を持っていることを認識してきました。 結局のところ、両方の液体にはイオン性化合物が溶解しています。 多くの科学者は、地球上の生命の最初の形態が海で起こったと考えています。 しかし、よく見ると、血液と海水はかなり異なっていることが示されています。 塩化ナトリウムの0.9%の解決は血で見つけられる塩の集中を近似します。 対照的に、海水は主に3%塩化ナトリウム溶液であり、血液中の濃度の3倍以上である。 ここでは、血液と海水中のイオンの量の比較です:
| イオン | 海水中のパーセント | 海水中のパーセント | 海水中のパーセント | 2.36 | |
|---|---|---|---|---|---|
| 0.322 | |||||
| Cl− | 1.94 | 0.366 | |||
| Mg2+ | 0.13 | 0.002 | |||
| SO42− | 0.09 | — | |||
| K+ | 0.04 | 0.016 | |||
| Ca2+ | 0.04 | 0.0096 | |||
| HCO3− | 0.002 | 0.165 | |||
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. この違いは、炭酸水素イオンおよびいくつかの関連イオンが血液の酸-塩基特性を制御する上で重要な役割を果たすため、重要である。 海水中のリン酸水素イオンの量—\(\ce{HPO4^{2−}}\)および\(\ce{H2PO4^{−}}\)は非常に低いですが、血液中にはより多く存在し、酸—塩基特性にも影響します。 別の顕著な違いは、血液には硫酸イオン(\(\ce{SO4}))が有意に存在しないことである。^{2−}}\)), しかし、このイオンは海水中に存在しています。
主要な注意事項
- イオン性化合物の適切な化学式は、総正電荷と総負電荷のバランスをとります。
- 多原子イオンと呼ばれる全体的な電荷を持つ原子のグループも存在します。
演習
-
イオン化合物の式にはどのような情報が含まれていますか?なぜいくつかのイオン性化合物の化学式には添字が含まれていますが、他の化合物には添字が含まれていないのですか?
3. イオンの各ペアによって形成されたイオン化合物の化学式を書く。
4. イオンの各ペアによって形成されたイオン化合物の化学式を書く。/li>
5. イオンの各ペアによって形成されたイオン化合物の化学式を書く。
6. イオンの各ペアによって形成されたイオン化合物の化学式を書く。
7。 イオンの各ペアによって形成されたイオン化合物の化学式を書く。
- Li+とN3−
- Mg2+とP3−
- Li+とP3−
8。 イオンの各ペアによって形成されたイオン化合物の化学式を書く。
- Fe3+とBr−
- Fe2+とBr−
- Au3+とS2−
- Au+とS2−
9。 イオンの各ペアによって形成されたイオン化合物の化学式を書く。
- Cr3+とO2−
- Cr2+とO2−
- Pb2+とCl−
- Pb4+とCl−
10。 イオンの各ペアによって形成されたイオン化合物の化学式を書く。
- Cr3+とNO3−
- Fe2+とPO43−
- Ca2+とCro42−
- Al3+とOH−
11。 イオンの各ペアによって形成されたイオン化合物の化学式を書く。
- NH4+とNO3−
- H+とCr2O72−
- Cu+とCO32−
- Na+とHCO3−
12。 要素の各ペアについて、それらのイオンの電荷を決定し、それらの間に得られるイオン化合物の適切な式を書く。
- BaとS
- CsとI
13。 要素の各ペアについて、それらのイオンの電荷を決定し、それらの間に得られるイオン化合物の適切な式を書く。p>
- KとS
- ScとBr
14。 あなたはどの化合物がイオン性であると予測しますか?
- Li2O
- (NH4)2O
- CO2
- Feso3
- C6H6
- C2H6O
15。 あなたはどの化合物がイオン性であると予測しますか?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2cro4
- C8H18
- NH3
回答
1。 化合物中の各種類のイオンの比
2。 イオン化合物中の他のイオンの電荷のバランスをとるために、複数のイオンが必要になることがあります。/li>
- Mgi2
- Na2O
- NaBr
- Mgbr2
- MGS
- Mgi2
- Na2O
- /li>
- Kcl
- mgcl2
- MgSe
- na3n
- Mg3N2
- Al2S3
- li3n
- mg3p2
- li3p
- febr3
- febr2
- au2s3
- au2s
- cr2o3
- cro
- Pbcl2
- Pbcl4
- Cr(No3)3
- Fe3(PO4)2
- Cacro4
- Al(OH)3
- NH4NO3
- NH4NO3
- NH4NO3
- NH4NO3
- NH4NO3
- NH4NO3
- NH4NO3
- NH4NO3
- NH4NO3
- NH4NO3
- Nh4NO3
- /li>
- h2cr2o7
- cu2co3
- nahco3
- ba2+、s2−、Bas
- Cs+、i−、csi
- K+、S2−、Bas
- K+、S2−、bas
- K+、S2-/li>
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
- イオンではない
-
