13.5D:ビオチンはCO2を運ぶ補酵素です
セクション6.5Bから、多くの酵素が補酵素の助けに依存していることを思い出してください。共有結合-酵素の活性部位で、その反応を触媒するのに役立ちます。 S-アデノシルメチオニン(SAM、セクション9.1A)とATP(セクション10.2)は、これまでに遭遇した二つの例であり、我々は先の章でいくつかの詳細が表示されます。 Rubisco(このセクションのパートBに記載されている)は例外ですが、カルボキシル化反応を触媒するほとんどの酵素は、二酸化炭素の一時的なキャリアとし
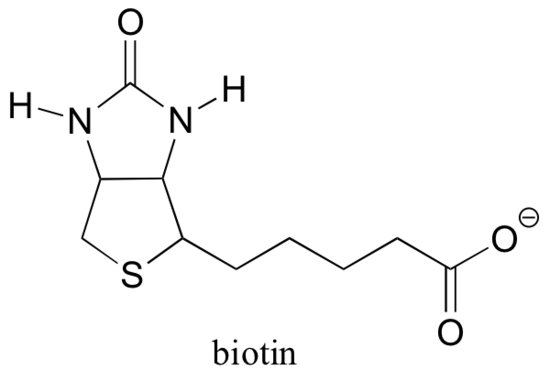
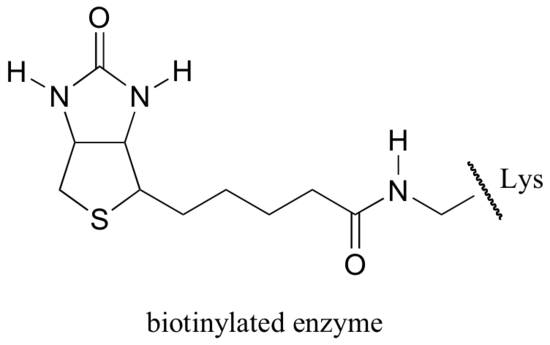
ピルビン酸カルボキシラーゼ、gluconeogensis経路の最初のステップを触媒する酵素は、ビオチン依存性カルボキシ この反応のCO2は、CO2が大気から直接「固定」されるRubisco反応とは異なり、重炭酸塩に由来することに注意してください。ビオチンは、活性部位リジンへのアミド結合を介して酵素に共有結合的に結合される。

ビオチンは、活性部位リジンへのアミド結合を介して酵素に共有結合される。
ビオチン依存性カルボキシル化反応が動作する正確なメカニズムはまだ完全には理解されてい まず、重炭酸イオンはATPによってリン酸化され(ステップ1、セクション10.2を参照)、脱炭酸のために活性化され、遊離CO2を生成する(ステップ2)。ビオチンの仕事は、ピルビン酸塩が活性部位に入るまで二酸化炭素分子を保持することです。 ビオチンのカルボキシル化は、アミド窒素の脱プロトン化を伴い、エノラート様中間体を形成する(ステップ3-アミドは約17のpKaを有し、これは酸素の近くの活性部位酸の存在によって低下する)。 このステップに続いて、カルボキシビオチニル化酵素を形成するために、二酸化炭素上の求核性窒素の攻撃が行われる(ステップ4)。
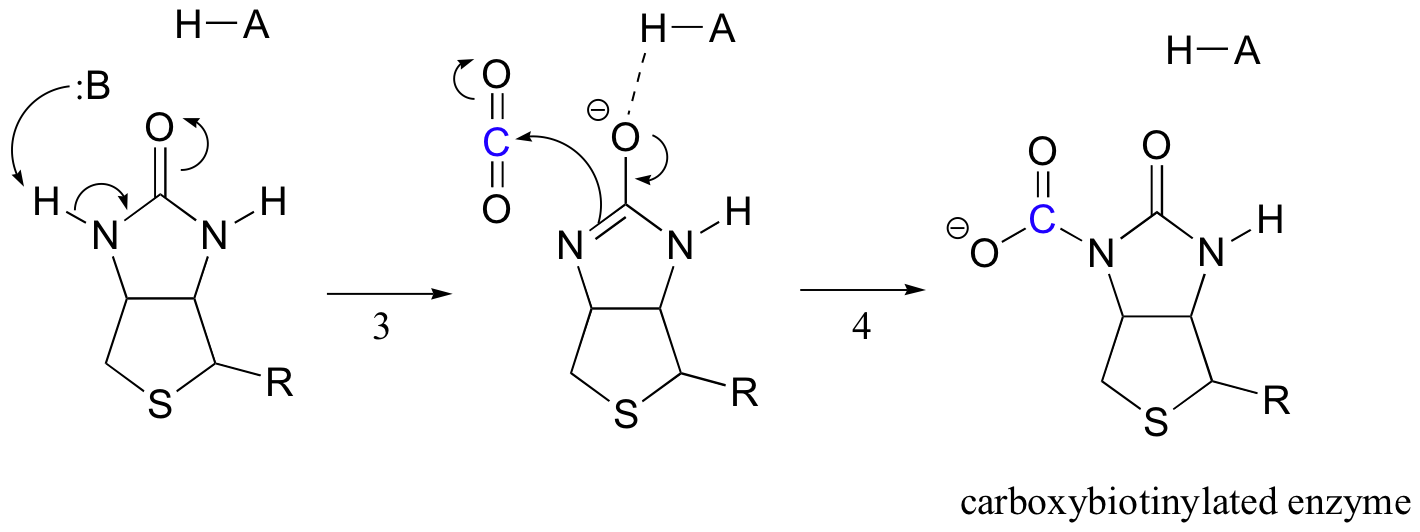
ピルビン酸分子が結合すると、活性部位アーキテクチャの再配列により、前のステップが逆になり(ステップ5)、CO2を解放し、ビオチン塩基を生成してピルビン酸のα炭素を脱プロトン化し、凝縮できるようにする。、アルドール様の方法で、co2とオキサロ酢酸を形成する(ステップ6-7)。あなたはいくつかの生化学を研究している場合は、このセクションで議論されていることをやや異なる文脈でビオチンについて聞いたことがあ 卵白に豊富に含まれるアビジンと呼ばれるタンパク質は、ビオチンに非共有結合的かつ非常に緊密に結合する(実際、アビジン-ビオチンは科学に知られている最もタイトなタンパク質-リガンド結合対である)。 生化学者は、多くの場合、ビオチンに関心のある生体分子を共有結合することによって、この特性を利用しています。 次いで、「ビオチン化」種は、混合物をアビジンで被覆された「親和性カラム」を通して流すことによって、複雑な混合物から容易に単離することができる。
