細胞が空間内のある点から別の点に移動する方法はいくつかあります。 液体培地では、その方法は、細胞を推進するために毛様体または鞭毛運動を利用して、ある種の水泳であり得る。 固体表面では、これらの機構は明らかに効率的に機能せず、細胞はクロールプロセスを受ける。 このセクションでは、毛様体/鞭毛運動の議論から始め、その後、細胞クロールのより複雑な要件を検討します。
繊毛と鞭毛は、構造ではなく長さが主に異なり、前後の動きで移動する微小管ベースのオルガネラです。
繊毛と鞭毛は、構造ではなく長さが主に異な これは比較的短い繊毛によって”漕ぐ”ことに変換されますが、長い鞭毛では、構造の柔軟性により前後の動きが波として伝播されるため、鞭毛の動きはより起伏があります(同じホースの短い部分に比べて左右に素早く庭のホースを振るとどうなるかを考えてみてください)。 いずれかの構造のコアは軸索と呼ばれ、毛様体ダイニンモータータンパク質によって互いに接続された9つの微小管二重項から構成され、二つの別々の微小管の中心コアを取り囲んでいる。
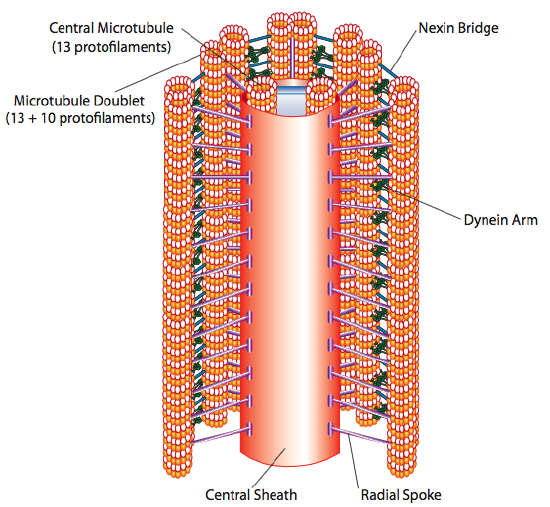
これは”9+2″形成として知られていますが、九つの二重項は二つの中心微小管と同じではありません。 A尿細管は完全な13-プロトフィラメントであるが、それに融合したB尿細管は10個のプロトフィラメントしか含まない。 中心微小管のそれぞれは、完全な13のプロトフィラメントである。 9+2軸索は、繊毛または鞭毛の長さを先端から基部に達するまで延長し、9個の微小管三重項からなる基底体を介して細胞体に接続し、それらが由来する中心小体と同様に短いバレルに配置される。
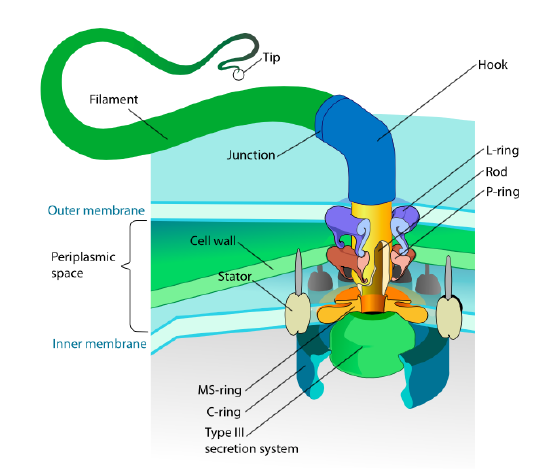
この節は真核生物のみを指します。 いくつかの原核生物はまた、鞭毛と呼ばれる運動性付属器を有するが、それらは構造および機構の両方において完全に異なっている。 鞭毛自体は蛋白質の鞭毛の長い螺旋形ポリマーであり、鞭毛繊維の基盤は回転モーター蛋白質、ない翻訳モーターに接続されます。 このモーター(図\(\PageIndex{18}\))は、イオン(種に応じてH+またはNa+)を電気化学的勾配下に利用して、毎分100000回転も回転するエネルギーを提供します。 回転は、細胞膜に囲まれた固定子リングの立体配座変化によって駆動されると考えられている。
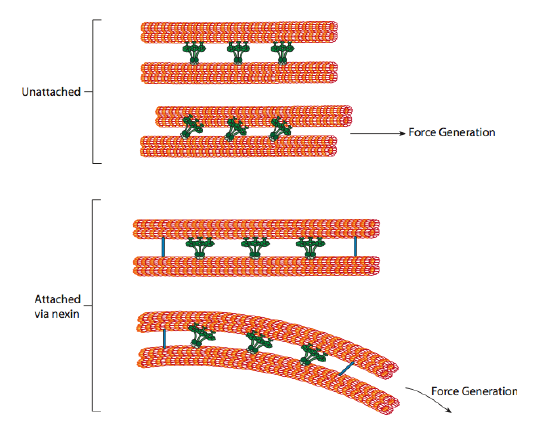
毛様体ダイニンはモーター能力を提供しますが、軸索にも他の二つのリンケージタンパク質があります。 一つの二重項のA-尿細管を隣接する二重項のB-尿細管に結合し、外輪を接続するネクシンがある。 また,軸索核の中心には,各二重項のa細管から微小管の中心対まで延びる放射状のスポークがある。 これらのどちらも運動活動を持っていません。 しかし、それらは滑り運動を曲げ運動に変換するのに役立つので、繊毛および鞭毛の動きにとって重要である。 毛様体ダイニン(細胞質ダイニンに非常に類似しているが、二つではなく三つの頭部を有する)が係合すると、一方の側のA微小管、隣接する二重項からのB微小管に結合し、他方に対して一方を移動させる。 これらのdyneinsのラインが協調して移動すると、二つのダブレットが完全な移動の自由を持っていれば(そしてそれは大きな”if”です)、一方のダブレットを他方 しかし、二重項はネクシンタンパク質によって相互接続されているので、一つの二重項がスライドしようとすると何が起こるかは、代わりに接続された構造を曲げることである(図\(\PageIndex{17}\))。 この曲がりは、比較的短い繊毛の漕ぎ運動と、軸索の下に曲げ運動を伝播する長い鞭毛の鞭打ち運動を説明する。p>
我々は、このような卵に向かって精子の鞭毛水泳など、細胞の推進のための方法として毛様体と鞭毛運動を考えていますが、細胞が静止して 実際には、体のほとんどの主要な器官に繊毛を持つ細胞があります。 いくつかの毛様体ジスキネジーが報告されており、そのうち最も顕著な原発性毛様体ジスキネジー(PCD)は、カルタゲナー症候群(KS)を含むが、軸索(毛様体)ダイニンのサブユニット(中間鎖1)をコードするDNAI1遺伝子の変異によるものである。 PCDは再発感染による呼吸困難を特徴とし,体の正常な左右非対称性(例えば左が胃,右が肝臓)が逆転した状態である逆坐がある場合にKSの診断が行われる。 最初の症状は、肺の上皮細胞の多数の繊毛の不活性によるものである。 それらの正常な機能は、呼吸器内の粘液を常に運動させることである。 通常、粘液は機能を促進するために肺を湿った状態に保つのに役立ちますが、粘液が静止すると、細菌の繁殖地になり、刺激物や適切なガス交換の障害になります。
Situs inversusは、胚発生時に発生するため興味深い奇形であり、毛様体機能の障害が左右非対称性のランダム化を引き起こし、逆転ではないため、PCD患者の50% 非常に簡単に言えば、初期の胚発生の間に、左右の非対称性は、胚節を通る左方向のowにおける分子信号の動きに部分的に起因する。 この流れは、繊毛の協調的な鼓動によって引き起こされるので、それらが機能しないとき、流れは中断され、無作為化が起こる。
PCD患者の他の症状は、体内の繊毛と鞭毛の働きも指摘しています。 男性の不妊はimmotile精液が共通原因です。 女性の不妊症は、あまり一般的ではありませんが、卵管および卵管の繊毛の機能不全のために、通常卵巣から子宮に卵を移動させることもあります。 興味深いことに、水頭症(脳の心室を脳脊髄液で過充填し、周囲の脳組織を圧縮する拡大を引き起こす)とPCDとの関連性も低い。 これはおそらく、心室を裏打ちする上衣細胞における繊毛の機能不全に起因し、CSFの循環を助けるが、明らかに完全には必要ではない。 CSFバルクフローは、脳内の血圧の収縮期/拡張期の変化によって主に駆動されると考えられているので、いくつかは、繊毛が脳内のより厳しいチャネルのい
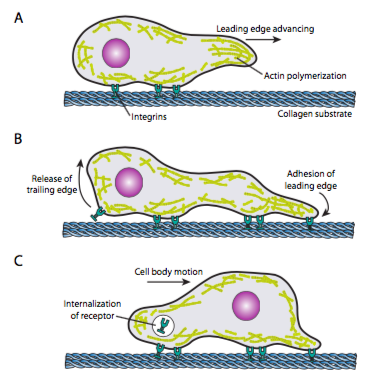
細胞クロール(図\(\PageIndex{19}\))は、(重合とスライディングフィラメントの両方によって)拡張し、新しい最前方の点で癒着を形成する、リーディングエッジマイクロフィラメントネットワークの協調再配列を必要とする。 これは、filopodiaまたはlamellipodiaの形をとることができ、しばしば両方を同時に行うことができます。 Filopodiaは平行microfilamentsおよび細胞の表面の受容器の高い濃度の中心の束が付いている長く、非常に薄い投射です。 彼らの目的は、主に環境を感知することです。 ラメリポディアはしばしば二つのロポディアの間に延びており、指よりも広いフリルの多くです。 内部的にアクチンは束より網に多くを形作り、より広い端はより多くの付着が基質になされることができるように可能にします。 その後、マイクロフィラメントネットワークは再び再配置され、今度は細胞の前部に向かって微小管の移動のためのチャネルとして機能する細胞質内の空間を開く。 これは細胞内の第一次製品を先に動かすのを助けるために輸送ネットワークを置く。 これが起こると、細胞の尾端の古い癒着が放出される。 この解放は2つの第一次メカニズムによって起こることができます:受容器のendocytosisかシグナリング/conformational変更による受容器の不活性化。 もちろん、この過度の単純化は、細胞の指示された動きを達成するために、これらの行動のすべてを調整し、制御することの複雑さを偽ります。
マイクロフィラメント力発生の一つのモデル、弾性ブラウンラチェットモデル(MogilnerとOster、1996)は、連続的な微細な熱ゆらぎに起因する細胞膜のブラウン運動のために、膜の縁に向かって押し出されるアクチンフィラメントが様々な程度に屈曲することを提案している。 屈曲が十分に大きければ、新しいアクチンの単量体はフィラメントの膜と先端の間で合うことができ今より長いフィラメントが曲がるとき、膜のよ 明らかに単一のフィラメントは多くの力を発生させないが、多くのフィラメントの調整された延長は膜を前方に押すことができる。
細胞が移動する信号を受信すると、最初の細胞骨格応答は、前縁に組み込むために、より多くのマイクロフィラメントを構築し、アクチンを重合 シグナル(誘引性または反発性)に応じて、重合はシグナル受容体活性化の点から細胞の同じ側または反対側で起こり得る。 重要なことに、新しいf-アクチン単独の重合は、ミオシンモーターの関与なしでも、膜を前方に移動させるのに十分な力を生成することができる! 力発生のモデルは議論されているが、一般的には、その先端、すなわちフィラメント-膜界面でのフィラメントへの新しいg-アクチンの取り込みから始ま それが技術的に十分かもしれないとしても、生細胞では、ミオシンが関与しており、新しいリーディングエッジを設定するためにフィラメントを方向的に押して配置するのに役立ちます。 さらに、いくつかのフィラメントおよびネットワークは、フィラメント間およびフィラメントと接着分子または微小管などの他のタンパク質との間の両方で、迅速に切断され、新しい接続が行われなければならない。
重合とアクチン転位はどのように制御されていますか? 細胞の移動を知らせる受容体は、多少異なる経路を開始することができるが、多くは、小さなGtpアーゼのRasファミリーの一つ以上のメンバーを活性化するには、いくつかの共通点を共有しています。 Rac、Rho、およびcdc4 2などのこれらのシグナル伝達分子は、受容体チロシンキナーゼによって活性化され得る(RTK−Ras活性化経路、Chap. 14). これらのそれぞれは、細胞の運動性においてわずかに異なる役割を有する: cdc42活性化は糸状虫形成につながり、Racはarp2/3とコフィリンを含む経路をラメリポディア形成に活性化し、RhoはミオシンIIを活性化して焦点接着とストレス繊維形成を制御する。 異なるタイプの受容体カスケード、Gタンパク質シグナル伝達カスケード(第14章も)は、PLCの活性化およびその後のPIP2の切断およびサイトゾルCa2+の増 これらの変化は、前述したように、ミオシンII、ならびにリモデリング酵素gelsolin、cofilin、およびprofilinを活性化することもできる。 これは、既存のアクチン構造を分解して細胞をより流動的にし、より多くのg-アクチンを寄与して新しい前縁細胞骨格を形成する。
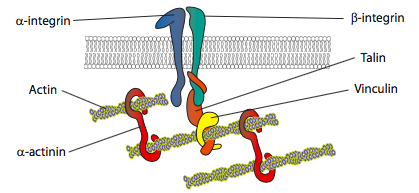
In vitro実験では、膜が前進するにつれて、基質に結合する接着分子または受容体を介して新しい接着接触が行われることが示されている(多くの場合、細胞培養スライドまたはディッシュはコラーゲン、フィラミン、または他の細胞外マトリックスタンパク質でコーティングされている)。 次に、接触は、より大きな安定性のために細胞骨格要素を動員して、焦点接着を形成する(図\(\PageIndex{20}\))。 しかし、局所癒着の形成は細胞培養のアーティファクトであると思われ、in vivoで形成される癒着のタイプが同じタイプの細胞骨格成分を動員するかどうかは不明である。
細胞の移動への第三のステップは、前方に細胞の内容物の一括移動です。 この段階のメカニズムは不明であるが、微小管細胞骨格の前縁部と前方部のアクチン細胞骨格との間の結合を用いて、微小管が再配置され、バルク運動のための効率的な輸送経路を形成するという証拠がいくつかある。 これに対する別の態様は、前縁に向かって方向的に空間を開放するアクチンネットワークによる”corralling”効果であり得る。 微小管は、タイトなアクチンメッシュを介して作業するよりも簡単にその空間に入り、適切な方向に流れを強制します。
細胞運動における微小管-アクチン相互作用に関する研究の多くは、神経成長円錐の研究を通じて行われている(A.W.Schaefer et al,Dev. Cell1 5:1 4 6−6 2,2 0 0 8)。
最後に、セルは後縁の古い癒着を元に戻す必要があります。 これは、さまざまな方法で発生する可能性があります。 In vitroでは、クロール細胞は、プロセス内の膜と関連する接着タンパク質の小さなビットを残して、基板から自分自身をリッピングすることが観察され 発生する力はより前方焦点癒着から導くアクチン-ミオシン応力繊維から来ると推定される。 しかし、細胞に利用可能な破壊的なメカニズムはあまりありません。 いくつかの場合において、細胞外基質に対する細胞受容体の接着性は、おそらく受容体のリン酸化または脱リン酸化によって、内部的に調節され得る。 別の可能性は、受容体のエンドサイトーシスであり、それを細胞表面から取り除く。 それは必要とされるリーディングエッジ(すなわちtranscytosis)まで単にリサイクルできます、またはもはや必要とされないか、または傷つけられれば、lysosomeで破壊される
