患者の提示
患者は、胸部の不快感としびれを訴えて救急部に提示した薄い40歳の喫煙者です。 彼は最後の3ヶ月にわたって徐々に大きく成長していた彼の左胸壁に新しい塊に気づいた。 最近では,腫りゅうの上にある皮膚に知覚異常を発症し,胸部の圧迫から左肩の運動範囲が減少していた。 患者はアルコール依存症の既往があり,再発性の歯科膿瘍を含む歯列不良であり,最新のものは二ヶ月であり,自発的に排出された。 彼は彼が前年のための乾燥した、非生産的な咳を有したことを示す。 彼は最近の15-20ポンドを報告しています。 減量と寝汗の4週間の歴史。 彼の過去の医学および外科歴史は幼年期の喘息を除いて他では目立たないです。 システムの追加レビューは明らかにされていませんでした。
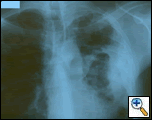
図1: PA胸部フィルムは、胸膜肥厚と上葉の瘢痕を伴う左胸膜ベースの塊を明らかにする。
身体検査では、患者は安定したバイタルサインで不安定であった。 彼は彼の記載された年齢よりも年上のように見えた薄い男性でした。 頭頚部検査では触知可能な頚部リンパ節腫ようや鎖骨上リンパ節腫ようを伴わない歯列が不良であった。 左胸壁には直径約6cmの左乳頭があり、これはしっかりしており、非可動性であり、触診には非柔らかいものであった。 皮膚の変色、紅斑、変動、または排水洞は認められなかった。 患者は左肩の運動の完全な受動的範囲を有していた。 肺検査は両側に明瞭であり,rales,ronchiまたは有意な喘鳴はなかった。 彼の心臓血管および残りの検査は肉眼的異常なしであった。 彼の化学実験室の値は正常範囲内であった。 患者は9,800の白血球数、正常な差があり、彼のHIV血清学は陰性であった。
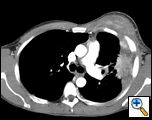
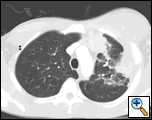
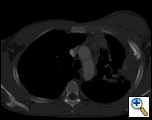
PAおよび側胸部フィルムは、大きな胸膜ベースの塊、左頂部胸膜肥厚、および右上葉の瘢痕を伴う左肺の斑状の圧密を明らかにした(図1)。 胸部、腹部、および骨盤のコントラストを有するヘリカルCTスキャンは、胸壁および左乳房に延びる大きな10.8×4.1cmの左胸膜ベースの塊を示す(図2)。 骨膜肥厚と隣接する肋骨の不規則性があった。 複数の拡大縦隔、左肺門、および鎖骨上ノードが認められ、APウィンドウまたはステーションファイブ領域で最大の1.5×2.6cmであった。 左右の上葉に斑状の圧密が認められた。 胸部mriで左鎖骨上腺腫と肋骨を含む胸壁への拡張,胸筋の浸潤,左肺実質への拡張を伴う増強腫りゅうの存在を確認した。 この時点での主な鑑別診断は、新生物(肉腫、進行肺癌、中皮腫、リンパ腫、骨肉腫)であった。
 |
 |
 |
 |
 |
/div> | |||||||||||||||||||||
| 図2a:ctスキャン胸郭軟部組織ウィンドウは、胸壁と左乳房に浸潤する左胸膜ベースの塊を示しています。 | 図2b:肺ウィンドウは同じことを示し、縦隔リンパ節腫脹および肺の圧密も強調している。 | 図2c:骨ウィンドウは同じことを示し、また、肋骨の骨膜反応を示しています。 |
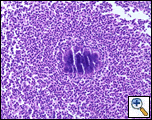
Truカット針生検をベッドサイドで行い、非特異的な病理学的所見を明らかにしたが、サンプリングを増加させた反復は、周期的酸シフト(PAS)、ゴモリのメタミンシルバー(GMS)、および修正されたグラム染色によって確認された放線菌を含む肉芽組織を伴う急性および慢性の炎症を明らかにした(図3)。 治療は、静脈内ペニシリンG(4週間のコースで4時間ごとに6万単位)から始まり、その後6-12ヶ月間経口アモキシシリンが続く。 放線菌症は悪性組織にコロニーを形成することが知られているので、4週間で繰り返しCTスキャンが計画された。 患者は肺の観点から良好であり,胸壁腫りゅうの退縮を有していた。
 |
 |
| 図3a:(H | |
| 図3a:(H | |
| 図3a:(H | |
| 図3a:(H | |
| &e)好中球浸潤は、硫黄顆粒を形成する放線菌の塊を取り囲んでいます。 | 図3b: (GMS)生物は、分岐、糸状細菌として表示されます。 結節の周囲では、いわゆる”Splendore-Hoeppli”現象のクラブ化が明らかである。 |
ディスカッション
放線菌症は、放線菌種、最も一般的にA.israeliiによって引き起こされる慢性化膿性肉芽腫性感染症 放線菌症の多くの症例は、実際には多菌性であり、隣接する組織への直接の拡張によって広がる。 ヒトにおける最初の症例報告は1857年であり、続いて1882年に胸部放線菌症の最初の症例報告があった。 放線菌症の最も一般的なプレゼンテーション(>50%)は、一般的に顎の塊として提示し、胸部放線菌症は、シリーズに応じてケースの15-50%の間を占め この疾患は、おそらく口腔衛生が悪く、男性の顔面外傷の発生率が高いため、男性と女性の比率が3:1で発生します。 発生には二峰性の年齢分布もあります:11-20およびこの患者が適合する人生の第4-第5の数十年。 基礎疾患を有する患者は感染の素因があるが、それ以外の場合は健康な人に起こり得る。 興味深いことに、HIV、臓器移植、またはステロイドを含む免疫が損なわれている患者の増加はないようです。 英国では、COPD、気管支炎、アルコール依存症の患者は放線菌症の素因があり、日本では虫歯(19%)、糖尿病(13%)、歯槽膿漏(6%)との関連が認められています。 英国における肺放線菌症の最も一般的な提示は、咳、発熱、および胸痛である。 日本の95例のレビューでは、最も一般的なプレゼンテーションは、喀血(42%)、咳または痰(37%)、発熱(28%)であった。 進行性または播種性疾患は、体重減少、倦怠感、高熱、および副鼻腔の排出に関連し得る。
放線菌症は、口腔咽頭の細菌叢、特に歯垢および消化管に見出すことができる。 肺放線菌症の機序として吸引とエアロゾル化が提案されている。 このメカニズムは、ここで提示された患者のように、アルコール依存症および口腔衛生の悪い患者におけるより高い発生率と相関する可能性がある。 この病因はまた、肺放線菌症の下葉および末梢肺の関与の頻繁な発見と一致している。 しかし、明らかに正常な個体が肺放線菌症に罹患する可能性があり、上葉の放射線学的異常がある程度の頻度で認められているため、血管びらんからの敗血症性塞栓の血行性広がりのような他の病因が提案されている。 全体的に、放線菌症は非常にまれであり、発生率および病原性が減少しており、おそらく口腔衛生が改善され、他の状態を治療するための抗生物質の
診断の難しさは、疾患の希少性、悪性疾患との放射線学的類似性、および生物の同定または培養の難しさ(<50%成功)にあります。 “分岐フィラメント”の観察は植民地化と感染を区別するには不十分であるが、実際に放線菌のコロニーである”硫黄か粒”の存在は感染性放線菌症を示唆している。 検査所見は非特異的であり,軽度の白血球増加および赤血球沈降速度(ESR)およびC反応性蛋白質(CRP)を含む炎症性マーカーの上昇が見られる。 胸部放線菌症の一般的なx線所見には、波状骨膜炎、肺線維症、キャビテーション、および胸膜肥厚、および肺変形性関節症が含まれる。 これらの特徴の多くは、現在のケースでは放射線学的に見られ、悪性腫瘍と混同することができます。 正常な気管支は大きな腫瘍ではほとんど見られないので、塊状病変に入るのが見られる正常な気管支は、放線菌症と悪性腫瘍とを区別するのに役立 微細針吸引(FNA)またはTru-cut生検は、組織診断に使用することができるが、現在の症例では適切な試料を得ることが困難であることから見られるように、高い偽陰性率を有する。 ビデオ補助胸腔鏡検査(VATS)は,末梢肺または胸部放線菌症の診断に特に有用である可能性がある。 それは直接視覚化の利点を提供し、能力はより大きい組織サンプルを取る。 残念ながら、胸部または肺放線菌症の診断のほとんどは、日本と台湾の症例の半分以上を含む、まだ開胸時に行われています。
放線菌症の最初のライン治療は、2-6週間の静脈内ペニシリンの延長コースと6-12ヶ月の経口ペニシリンまたはアモキシシリンに続いて医 Doxycyclineはペニシリンのアレルギーの患者で代理として使用することができますです。 外科に膿瘍、empyema、fistulaおよび喀血を含む放線菌症の複雑化の、管理の役割があります。 放線菌症による喀血は36であることが判明している。医学的に扱われた患者のための病院の排出の6か月以内の再出血の4%の率、および再出血するそれらの患者間の50%の死亡率。 早期治療は、死亡率が低い優れた結果をもたらすが、全体的に、肺放線菌症は、他の場所での疾患よりも予後が悪い。
