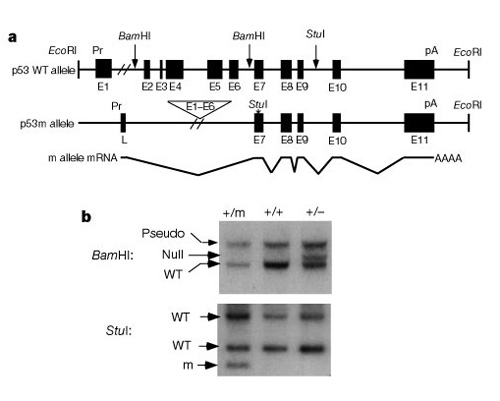
これらのシステムが細胞分裂を制御する方法を理解する上で重要な部分は、p53が癌と老化の両方に影響を与えることを発見したことでした。 Tyner et al. (2002)は、正常なp53タンパク質よりもp53またはasmallerの不在の効果を比較するために、マウスにおける無遺伝的戦略を考案した。 二つの変異型トランスジェニックマウス株は、p53遺伝子の完全な欠失(p53-)またはp53遺伝子の最初の六つのエクソンを持っていなかったp53(p53m、変異体)の切り捨てられた形態のいずれかを持っていた(図2)。 図2:変異体p53m対立遺伝子の構造と発現
| 表1。 Experimental results from genetic mousestudies with p53 mutants | |||
| Genotype | Cancer phenotype | Agingphenotype | |
| Group 1 | p53+/p53- (complete deletion) | 80%had tumors | Muchshorter life span |
| Group 2 | p53+/p53m (partial mutant) | None | Shorterlife span |
| Group 3 | p53+/p53+ (wild type) | 45%had tumors | Normallife span |
| Tyner etalから適応されました。 2002 | |||
著者らはまた、グループ2マウスは、骨格の変化による遅い発毛とhunchbacked棘など、古いマウスの特徴的な表現型を開発したことを指摘した。図3)。

研究の後半では、Tynerとcolleaguesasked p53変異が正常なp53の存在下で異なって機能するかどうか。 彼らはp53-/p53m mutantallelesと追加のトランスジェニックマウスラインを飼育し、これらのマウスは強力な腫瘍保護を持っていないし、はるかに少ない寿命 そのため、変異体p53は何らかの形で正常なp53と連携して効果を発揮する必要がありました。 一般的な観察として、theresearchersは、p53+/p53mヘテロ接合体からの細胞が野生型細胞の約三倍のハードトランスフォームであることが判明したことを報告しました。 したがって、これらの細胞は癌に対して耐性であったが、このp53+/p53mbackgroundも早期の老化を引き起こした。 確かに、これらのヘテロ接合体におけるp53の活性は、野生でのその活性よりも顕著に高いように見えたtype.It このような変化は、aprioriながら、癌と老化の両方に対して良いだろうと思われたが、その結果はそうではない。
後で、Mooreet al。 切断されたp53タンパク質を引き起こす同じ変異を有する培養細胞では、この切断されたタンパク質が核に入り、正常なp53と共局在することを示 彼らはまた、細胞内のp53タンパク質の半減期を研究し、変異体p53のコピーを持つヘテロ接合体は、野生型単独での安定性と比較して、正常なp53タンパク質の安定性が約三倍増加しており、タンパク質の安定性が正常に改善されていることを見出した。 培養細胞におけるこれらの結果は、拡張され、Tynerらによって行われた研究を確認した。 マウスで。 さらに、これはp53を介して機能し、癌と老化の両方を明らかに調節することが発見された最初の細胞分裂応答経路であった。
細胞分裂サイクルから出るシグナルを送ることができるRb経路では、DNA損傷や染色体末端の短いテロメアへの複製不足などのイベントがCDKシグナ これは、Inturn、Rbプロテインキナーゼ活性を増加させ、その結果、転写因子E2Fの活性を増加させる。E2Fの意義は何ですか? この転写因子は、S期が始まるのに必要なRNAポリメラーゼサブユニットおよび他のタンパク質のプロモーターに結合し、細胞分裂を開始するのに役立つ(Campisi2003;Weinberg1995)。 したがって、p53経路とRb経路の両方が同じ細胞周期制御機構に衝突するようである。
