細胞周期阻害剤の導入
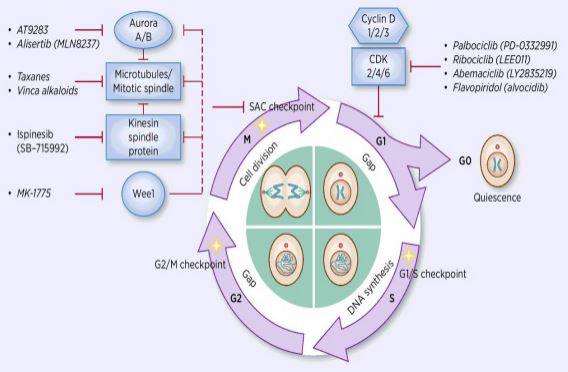
細胞周期調節のプロセスは、それによって二つの娘細胞に細胞DNA複製 多くの細胞周期調節因子の中で、サイクリン依存性キナーゼ(CDK)が中核であり、サイクリンおよびサイクリン依存性キナーゼ阻害剤(CKIs)で細胞周期を調節するネットワー Cdkはセリン/スレオニンキナーゼのクラスであり、現在、Cdkの細胞周期調節およびCdkの転写調節に役割を果たすCDK1-13を含む13種が見出されている。 細胞周期の調節は、実際にはチェックポイントの調節であり、G1/S調節点が最も重要である。 細胞周期が成長因子などの外部シグナルによって刺激されると、触媒サブユニットCDK4/CDK6は調節サブユニットCyclinDに結合し、CDKs残基はリン酸化/脱リン Cdkの活性化後、Rbタンパク質はリン酸化される。 また、網膜芽細胞腫遺伝子として知られているrb遺伝子は、最初のクローン化された腫瘍抑制遺伝子であり、タンパク質のリン酸化が失われた後に転写因子(E2Fなど)と複合体を形成する能力である。 E2Fは細胞周期の調節に重要な役割を果たし、サイクリンとCDK2の発現を誘導し、さらにRbタンパク質をリン酸化し、E2Fを完全に放出するサイクリン/CDK2複合体を形成し、その後、e2Fは核に入り、一連の細胞周期をS期に活性化する。 S期のDNA複製の後期には、CDK2はサイクリンによって活性化され、転写因子E2Fを時間内に不活性化し、持続的に活性化されたE2Fによって引き起こされるアポトーシスを防止する。研究統計は、ヒト癌の90%以上がCDK、サイクリン、CKI、およびRb経路の関連遺伝子に変異を有し、CDKおよびそれに対応する調節サブユニットサイクリンが最も頻繁に機能不全であることを示している。 さらに、細胞周期の変動は化学療法抵抗性を促進し、化学療法の効果を減少させる。 したがって、正常な細胞周期を回復させるCDK/サイクリン活性の調節は、腫瘍を治療するための戦略の一つである。
細胞周期阻害剤は現在臨床的に使用されています
薬物研究者は、最先端の抗癌薬としてCDKおよびサイクリン阻害剤の異なるタイプを見つ 現在、CDK阻害剤は、主に内因性および外因性に分けられる。 内因性小分子阻害剤の最大のクラスは、構造機能の違いに応じて二つの広いカテゴリに分類される低分子量タンパク質であり、一つのクラスは、プロ シクリンド関連キナーゼの阻害依存性タンパク質は、対応する遊離CDK4に結合し、それによって対応するシクリンドへのCDK4の結合を遮断して触媒二量体複合体を形成する。 他のクラスはP21、P27、P57を含むKipファミリーと呼ばれています。 このタンパク質ファミリーは、二量体の触媒活性中心をブロックすることによって、サイクリンE/CDK2とcyclinA/CDK1からなる二量体複合体と三量体を形成す これらの内因性阻害剤の阻害は、キナーゼ複合体と組み合わせると、その活性を特異的に調節し、それによってG1からS期への細胞の形質転換を正確 研究では、複数の腫瘍の発生および発生は、cdks/サイクリンの発現の減少またはp16の欠失などの内因性阻害剤の発現の減少と関連しており、黒色腫、肺癌、乳癌、および結腸直腸癌の発症と関連していることが示されている。 P27蛋白質の欠失は乳癌、前立腺癌、結腸癌および胃腸癌で共通です。 したがって、内因性Cdks阻害剤または遺伝子変異の欠失は、腫瘍診断のための重要な基準である。 内因性小分子阻害剤はまた、近年発見された重要な非コードRnaの一種である。 標的部位領域は互いに結合して、迅速かつ効率的にmRNAを分解したり、タンパク質の翻訳を阻害したりして、より低いレベルまたは最適なレベルでタンパク質を制御し、生命活動を必要とする。 10以上のマイクロrnaが細胞周期調節に関与していることが発見されている。 これらの中で、miR1-2およびmiR3-4はそれぞれCDK4を標的とし、細胞周期はg1期で停止され、腫瘍細胞増殖を阻害する;miR-22はCDK6細胞を標的とする。 周期は乳癌の細胞の老化を引き起こすG1段階で停滞しています。 異なる生物学的プロセスでは、これらのmirnaは、E2F、CDK、サイクリン、P21、P27、DNAポリメラーゼαなどを標的とすることによって細胞周期の進行を調節する。 細胞周期の主調整装置を促進するか、または妨げるため。 外因性阻害剤には、アンチセンス核酸、抗体、低分子干渉RNA干渉(siRNA)および低分子化合物が含まれる。 小分子化合物は、外因性CDK阻害剤の最も重要なクラスである。 近年、結晶構造の理解により分子シミュレーション研究が可能になることから、Cdkの化学阻害剤に関する高効率かつ選択的な研究の設計-開発にブレークスルーが行われている。 そのような化合物は毎日新しいメンバーを持っていると言えるでしょう。 現在、小分子CDK阻害剤は、以下の13のカテゴリ、ロスコビチンおよびオロモウツ、ピリミジン(PD-033299)、フラボノイド(フラボピリドール)、チアゾール(SNS03)、アントラセンおよびそブチロラクトン-1)、スコーピオニン(ucn-01)および他の二つの種。 13の低分子阻害剤が臨床試験に入っています。 それらはすべて、CDKキナーゼのATP結合部位への結合のためにATPと競合する平面複素環の小分子化学物質である。 In vivo実験では、CYC202は良好な薬物耐性および良好な経口生理学的活性を有し、ヒト結腸癌および子宮癌細胞によって接種されたヌードマウスの固形腫瘍に明らかな阻害効果を有することを示した。 第Ib相試験では、卵巣癌患者10人がCYCを20ヶ月以上服用しており、腫瘍の増加や重度の治療関連副作用はなく、そのうち腫瘍が30%以上縮小しており、一年以上治療されている患者も安定した状態を示している。 第II相臨床試験では、CYC202単独ではわずかに貧弱な効果があり、他の化学療法薬と組み合わせて有効であることが判明している。 乳癌の治療のためのカペシタビンと組み合わせたCYC202の第IIb相臨床試験、肺癌および鼻咽頭癌の治療のための2,2-ジフルオロデオキシシチジンまたはシスプラチンと組み合わせた臨床試験も進行中である。 低分子RNA干渉技術の開発と応用により、特定の介入標的分子の遺伝子発現の研究が可能になり、多くの科学者がcdk/サイクリンの遺伝子レベルでの合成に介入し始めている。 リマエト-アル… サイクリン標的siRNAをHep3B、Hepg2、SNU4 4 9(サイクリン過剰発現)およびHuh7(サイクリン過剰発現)にトランスフェクトし、サイクリン発現が細胞中で9 0%減少するこ DNA合成は著しく減少し、細胞はアポトーシスを受ける。 Galimberti et al. サイクリン、CDK2、およびCDK1を標的とするsiRNAをマウス肺癌細胞HOP-62、H-522およびH-23にそれぞれトランスフェクトし、サイクリン/CDK2がアポトーシスを誘導し、肺癌細胞の増殖を阻害することができることを見出した。 CDK1siRNA干渉によって引き起こされるcdk1発現の減少は、細胞期の停止を引き起こし、細胞増殖を遅くする;CDK1とCDK2siRNA共干渉は、細胞周期SおよびG2/M相 停滞は細胞のアポトーシスも誘導した。 Cao YinfangとHepg2細胞へのCDK2/サイクリンsiRNA組換え発現ベクターの他の成功したトランスフェクションは、CDK2とサイクリンmRNA発現が有意に減少し、細胞周期がS期に逮捕されたことを示した、G1相細胞が有意に増加し、カスパーゼ-3活性が強化され、Hepg2細胞はアポトーシスを受け、細胞周期の変化は、トランスフェクション後のHepg2セルシンビトロの増殖の減少と一致していた。
細胞周期阻害剤の機能
腫瘍形成およびアポトーシスにおける細胞周期調節の重要な役割の理解の深化に伴い、細胞周期調節は、腫瘍化学 細胞周期の間に細胞エンジンを駆動する役割を果たすサイクリン依存性キナーゼ(Cdk)は、腫瘍治療のための理想的な標的である。 癌細胞の大部分は、活性化、細胞分裂周期(cdk)遺伝子の過剰発現、およびCdkis機能の欠陥を有する。 CDK阻害剤は、細胞周期を阻害する遮断作用を発揮する。 近年、CDKIsは、細胞周期におけるCdkの活性を阻害する癌治療の主要なハイライトとなっている。 一連の臨床調査はまた単一の適用が適当な効果をもたらすことができることを示しました。 しかしながら、伝統的な細胞傷害性化学療法薬と組み合わせて、Cdkiは、伝統的な化学療法薬の抗腫瘍効果を有意に増強することができる。 したがって、CDKIs薬および他の化学療法薬の抗癌効果に関する研究は、腫瘍抵抗性の現在の治療におけるホットスポットとなっている。
参考文献
- Bendris N,Lemmers B,Blanchard J M.Cell cycle,cytoskeleton dynamics and beyond:サイクリンとCDK阻害剤の多くの機能。 細胞周期。 2015, 14(12):1786-1798.
- Pitts T M,Davis S L,Eckhardt S G,et al. 癌における核キナーゼを標的とする:細胞周期キナーゼ阻害剤の開発。 薬理学&治療薬。 2014, 142(2):258-269.
- Stone A,Sutherland R L,Musgrove E A.Inhibitors of cell cycle kinases:recent advances and future prospects as cancer therapeutics. クリティカルリヴァージョン。 2012, 17(2):175-198.
- Xu W、Mcarthur G.細胞周期調節および黒色腫。 現在の腫瘍学のレポート。 2016, 18(6):34.
- Malumbres M、Barbacid M.細胞周期、CDKsおよび癌:変化するパラダイム。 自然は癌をレビューします。 2009, 9(3):153-166.
