学習目標
- アミノ酸の基本構造を記述する
- タンパク質の化学構造を記述する
- タンパク質のユニークな特性を要約する
この章の冒頭で、科学者が生命の進化のずっと前に地球上に存在するものをシミュレートする条件下でアミノ酸を合成する有名な実験が記述されていた。 これらの化合物は、本質的に任意の数で一緒に結合することができ、物理的および化学的特性の広い配列を所有し、すべての生物に不可欠な多数の機 アミノ酸由来の分子は、細胞および細胞内実体の構造成分として、栄養素の供給源として、原子およびエネルギー貯蔵貯蔵所として、およびホルモン、酵素、受容体、および輸送分子のような機能的種として機能することができる。P>
アミノ酸とペプチド結合

図1.アミノ酸は、水素原子、カルボキシル基(-COOH)、およびアミノ基(-NH2)がすべて同じ炭素原子、いわゆるα炭素に結合している有機分子である。 Α炭素に結合した第四の基は、異なるアミノ酸の間で変化し、文字R.a残基によって構造式で表される残基または側鎖と呼ばれ、二つ以上のアミノ酸が結合し、水分子を除去するときに生じる単量体である。 蛋白質、ペプチッド鎖の第一次構造はアミノ酸の残余から、成っています。 官能基およびR基の独特な特徴はアミノ酸のこれらの部品が二次、三次、および四級蛋白質の構造を形作るのに必要とされる北極/非極性相互作用と共に水素、イオン、およびジスルフィドの結束を、形作るようにします。 これらの基は、炭化水素、酸、アミド、アルコール、およびアミンの形で、主に炭素、水素、酸素、窒素、および硫黄から構成されています。 これらの可能性を示すいくつかの例を図1に示します。
アミノ酸は、ある分子のカルボン酸基と別の分子のアミン基との反応によって化学的に結合することができる。
アミノ酸は、ある分子のカルボン酸基 この反応はペプチド結合と水分子を形成し、脱水合成の別の例です(図2)。 比較的少量のアミノ酸(約50以下)を化学的に連結して形成される分子はペプチドと呼ばれ、ジペプチド(二つのアミノ酸)、トリペプチド(三つのアミノ酸)などを指定するために接頭辞が使用されることが多い。 より一般的には、アミノ酸のおおよその数が指定されています: オリゴペプチドは、約2 0個までのアミノ酸を結合することによって形成され、一方、ポリペプチドは、約5 0個までのアミノ酸から合成される。 結合したアミノ酸の数が非常に多くなったり、複数のポリペプチドを構築サブユニットとして使用したりすると、その結果生じる高分子はタンパク質と呼ばれます。 これらの生体高分子の連続的に可変長(モノマーの数)は、各アミノ酸上の可能なR基の様々なとともに、形成され得るタンパク質の種類のほぼ無制限の多様性を可能にする。アラニンは3炭素鎖を持っています。

ペプチド結合形成は脱水合成反応である。 第一のアミノ酸(アラニン)のカルボキシル基は、入ってくる第二のアミノ酸(アラニン)のアミノ基に結合している。 このプロセスでは、水の分子が放出される。
それについて考えてみてください
- ポリペプチドにはいくつのアミノ酸がありますか?
タンパク質構造
タンパク質のサイズ(長さ)と特定のアミノ酸配列は、その形状の主要な決定要因であり、タンパク質の形状は、その機 例えば、生物学的窒素固定(生物地球化学サイクルを参照)の過程で、総称してrhizobiaとして知られている土壌微生物は、大豆、ピーナッツ、または豆などのマメ科植物の根と共生的に相互作用して、植物の根に結節と呼ばれる新しい構造を形成する。 植物はそれからleghemoglobin、窒素か酸素を運ぶ蛋白質と呼出されるキャリア蛋白質を作り出します。 Leghemoglobinは形およびアミノ酸順序が適切である蛋白質の特定の地域(活動的な場所)で基質の酸素に非常に高い類縁と結合します。 活性部位の形状または化学的環境がわずかであっても変化した場合、基質は強く結合することができないか、または全く結合しないことがある。 したがって、タンパク質が完全に活性であるためには、その機能のために適切な形状を有していなければならない。
タンパク質の構造は、一次、二次、三次、四次の四つのレベルで分類されます。 一次構造は、単にポリペプチド鎖を構成するアミノ酸の配列である。 図3は、タンパク質の一次構造を示しています。p>
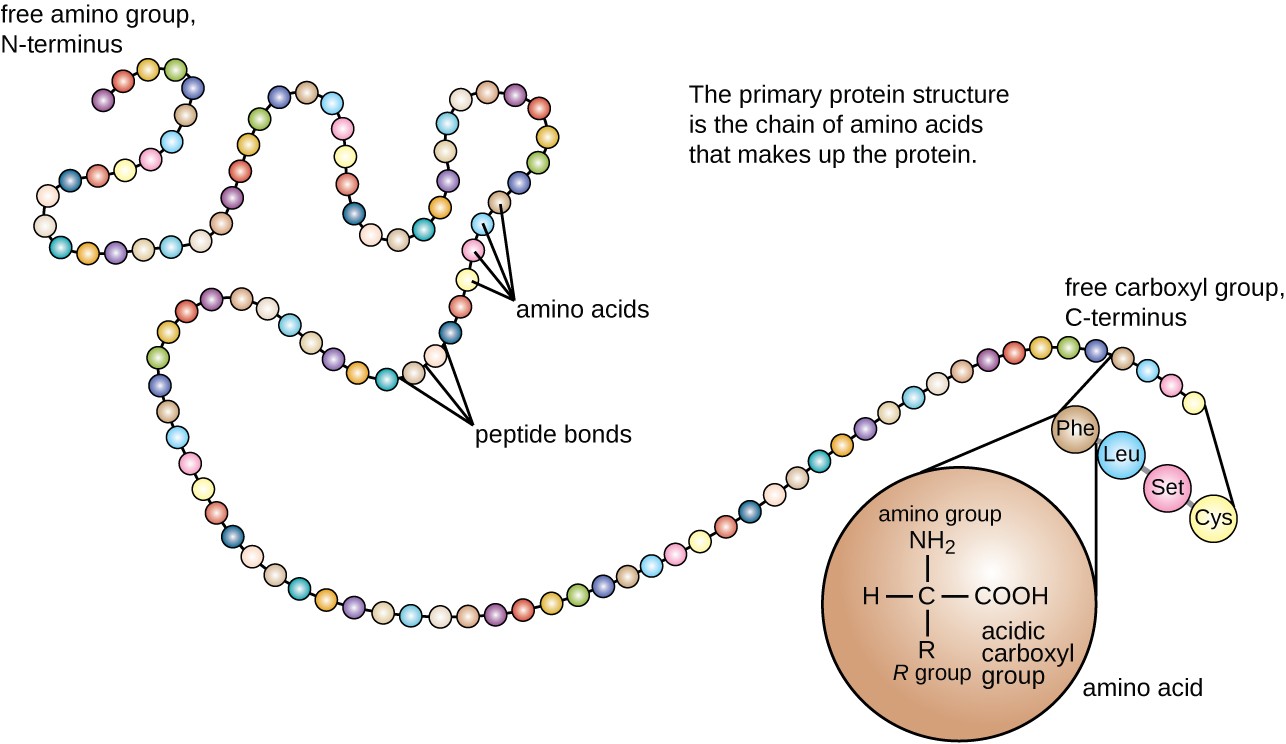
図3. クリックすると拡大画像が表示されます。 タンパク質の一次構造はアミノ酸の配列である。 (credit:modification of work by National Human Genome Research Institute)
タンパク質の一次構造を定義するアミノ酸の鎖は剛性ではなく、アミノ酸を一緒に保持する結合の性質のために柔軟で 鎖が十分に長い場合、ペプチド骨格内のアミンとカルボニル官能基(R側基を除く)の間に水素結合が起こり、ポリペプチド鎖がヘリックスとシートに局在 これらの形状は、タンパク質の二次構造を構成する。 最も一般的な二次構造は、αヘリックスおよびβプリーツシートである。 Αヘリックス構造では、ヘリックスは、一つのアミノ酸のカルボニル基中の酸素原子と鎖に沿って遠いわずか四つのアミノ酸単位であるアミノ基の水素原子との間の水素結合によって保持されている。 Β-プリーツシートでは、ポリペプチド鎖の骨格上でさらに分離されたカルボニル基とアミノ基の連続配列間の同様の水素結合によってプリーツが形成される(図4)。

図4. タンパク質の二次構造は、αヘリックスまたはβプリーツシート、またはその両方であり得る。
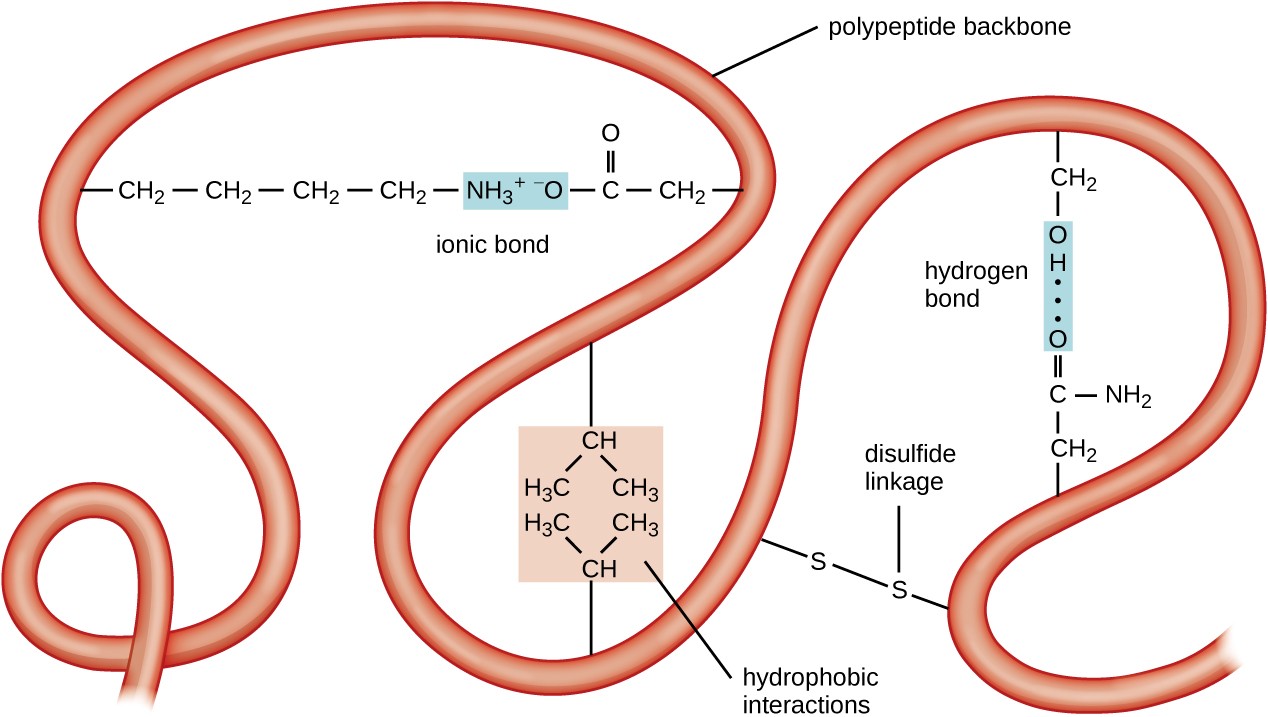
図5. クリックすると拡大画像が表示されます。 タンパク質の三次構造は、疎水性相互作用、イオン結合、水素結合、およびジスルフィド結合を含む様々な引力によって決定される。タンパク質組織の次のレベルは、単一のポリペプチド鎖の大規模な三次元形状である三次構造である。
タンパク質組織の次のレベルは、単一のポリ 三次構造は、鎖内で遠く離れているアミノ酸残基間の相互作用によって決定される。 アミノ酸側基上のスルフヒドリル(–S h)官能基間の結合であるジスルフィド橋、水素結合、イオン結合、非極性側鎖間の疎水性相互作用など、様々な相互作用がタンパク質三次構造を引き起こす。 弱い相互作用と強い相互作用のすべてが結合して、タンパク質の最終的な三次元形状とその機能を決定します(図5)。
ポリペプチド鎖が大規模な三次元形状をとるプロセスは、タンパク質折りたたみと呼ばれます。 それらの正常な生物学的役割において完全に機能する折り畳まれたタンパク質は、天然の構造を有すると言われている。 タンパク質がその三次元形状を失うと、それはもはや機能的ではないかもしれない。 これらの展開されたタンパク質は変性される。 変性は、一次構造の損失なしに二次構造および三次構造(および存在する場合、四次構造)の損失を意味する。
いくつかのタンパク質は、タンパク質サブユニットとしても知られているいくつかの別々のポリペプチドアセンブリです。
これらのタンパク質は、すべてのサブユニットが存在し、適切に構成されている場合にのみ適切に機能する。 これらのサブユニットを一緒に保持する相互作用は、タンパク質の四次構造を構成する。 全体の四元構造は比較的弱い相互作用によって安定化される。 例えば、ヘモグロビンは、4つの球状タンパク質サブユニット、すなわち2つのαおよび2つのβポリペプチドの四次構造を有し、それぞれが鉄ベースのヘムを含む(図6)。

図6. ヘモグロビン分子は二つのαおよび二つのβポリペプチドを四つのヘム基とともに有する。タンパク質の別の重要なクラスは、非タンパク質部分を有する共役タンパク質である。
タンパク質の別の重要なクラスは、非タンパク質部分を有 共役タンパク質が結合した炭水化物を有する場合、それは糖タンパク質と呼ばれる。 それが結合した脂質を有する場合、それはリポタンパク質と呼ばれる。 これらのタンパク質は膜の重要な構成要素である。 図7は、4つのレベルのタンパク質構造をまとめたものです。P>

図7. タンパク質の構造は、組織の四つのレベルを持っています。 (クレジット:国立ヒトゲノム研究所による作業の修正)
それについて考える
- タンパク質の一次、二次、三次、または四次構造が変
一次構造、機能不全タンパク質、および嚢胞性線維症

図8. クリックすると拡大画像が表示されます。 正常なCFTRタンパク質は、塩(塩化ナトリウム)が細胞の内外を移動するのを助けるチャネルタンパク質である。
生体膜に関連するタンパク質は、外因性または内因性に分類されます。
生体膜に関連するタンパク質は、外因 また、末梢タンパク質と呼ばれる外因性タンパク質は、緩く膜の片側に関連付けられています。 内因性タンパク質、または積分タンパク質は、膜に埋め込まれており、多くの場合、膜貫通タンパク質として輸送系の一部として機能します。 嚢胞性線維症(CF)は、膜貫通タンパク質の変化によって引き起こされるヒト遺伝性疾患である。 それは主に肺に影響を与えますが、膵臓、肝臓、腎臓、および腸にも影響を与える可能性があります。 CFは嚢胞性線維症のtransmembrane蛋白質(CFTR)のアミノ酸のフェニルアラニンの損失によって引き起こされます。 1つのアミノ酸が失われると、タンパク質の一次構造が変化し、通常は塩と水を細胞の内外に輸送するのに役立ちます(図8)。
一次構造の変化は、タンパク質が適切に機能するのを妨げ、体が肺を詰まらせ、粘着性の粘液の蓄積をもたらす異常に厚い粘液を産生する。 粘液は膵臓を妨害し、ボディが食糧を破壊し、重大な栄養素を吸収するのを助けることから自然な酵素を停止します。嚢胞性線維症を有する個体の肺では、変化した粘液は細菌が繁栄することができる環境を提供する。
嚢胞性線維症を有する個体の肺では、変化し この植民地化は、肺の小気道におけるバイオフィルムの形成をもたらす。 嚢胞性線維症患者の肺に見られる最も一般的な病原体は、緑膿菌(図9a)およびburkholderia cepaciaである。 Pseudomonasは肺のbiofilmの内で区別し、”mucoid”Pseudomonasと呼ばれる大きいコロニーを形作ります。 コロニーに実験室試験で示す独特な色素形成があり(図9b)、患者がCFを持っていること最初の糸口を医者に与える(そのようなコロニーは健康な個人でp>

図9. (a)走査型電子顕微鏡写真は、日和見細菌緑膿菌を示す。 (b)色素産生P. セトリミド寒天上の緑膿菌は、ピオシアニンと呼ばれる緑色の色素を示しています。 (クレジットa:疾病管理予防センターによる作業の変更)
主要な概念と概要
- アミノ酸は、すべての生命に不可欠な小分子です。 それぞれ、水素原子、カルボキシル基、アミン基が結合したα炭素を有する。 Rによって表される第4の結合基は、異なるアミノ酸間で化学組成、大きさ、極性、および電荷が変化し、特性の変化を提供する。
- ペプチドは、脱水合成を介してアミノ酸の結合によって形成されるポリマーである。 連結されたアミノ酸間の結束はペプチッド結束と呼ばれます。 一緒にリンクされているアミノ酸の数は、いくつかから多くに変化してもよいです。
- タンパク質は、非常に多数のアミノ酸の結合によって形成されるポリマーである。 それらは細胞内で多くの重要な機能を果たし、栄養素や酵素として機能します; 炭素、窒素、およびエネルギーのための貯蔵分子;および構造成分。
- タンパク質の構造は、その機能の重要な決定要因であり、一次、二次、三次、四次の段階的な分類によって記述されます。 タンパク質の天然の構造は、変性によって破壊され、その高次構造およびその生物学的機能が失われる可能性がある。
- いくつかのタンパク質は、いくつかの別々のタンパク質サブユニットによって形成され、これらのサブユニットの相互作用は、タンパク質複合体
- 共役タンパク質は、炭水化物(糖タンパク質を形成する)または脂質画分(リポタンパク質を形成する)であり得る非ポリペプチド部分を有する。 これらのタンパク質は膜の重要な構成要素である。
複数の選択肢
以下のグループのどれが異なるアミノ酸の間で変化しますか?
- 水素原子
- カルボキシル基
- R基
- アミノ基
タンパク質に存在するアミノ酸は、以下のどれが異なりますか?p>
- サイズ
- 形状
- サイドグループ
- 上記のすべて
- ペプチド結合
- イオン結合
- 疎水性相互作用
- 水素結合
空白を埋める
タンパク質中のアミノ酸の配列は、そのアミノ酸と呼ばれています__________.p>
変性を示唆損失の__________ や__________ 構造物の損失の__________ 構造。
True/False
タンパク質配列の1つのアミノ酸の変化は、常に機能の喪失をもたらします。p>
それについて考える
- タンパク質を十分に加熱すると、変性する可能性があります。 変性の定義を考慮すると、この声明は水素結合と比較してペプチド結合の強さについて何を言っていますか?
- 示された画像はテトラペプチドを表す。

- この分子にはいくつのペプチド結合がありますか?
- このペプチドを構成する四つのアミノ酸の側基を同定する。
div
