改良された小規模連続栽培システム
本研究では、Kleinらによって以前に開発された小規模連続栽培システムのさらなる進歩と応用可能性を示している。 、個々のリアクターの監視と同様、並列化および改善された処理の高められたある程度のため。 システムに加えられた変更の重要な側面は、平行培養容器のセットを8から24の反応器に増加させ、作業量を10から6.5mLに減少させることである。 本システムはさらに、曝気、培地供給、ブロス除去、接種またはサンプリングに使用される四つの固定ポートを収容するカスタムメイドの蓋からなる(Fig. 1). 四つのポートのほかに、光学棒状のDOプローブが栽培プロセスを妨害することなくDO監視のための蓋を通して挿入され、このように前のセットアップの酸素蛍光センサスポットを交換する。 前の組み立てで一定した耕作の温度を維持した水浴はmicroplateのスターラーの単位に溶ける顧客用アルミニウム暖房のブロックによって取り替えられた。 小規模バイオリアクターシステムの以前のバージョンは、分裂酵母Schizosaccharomyces pombeを使用して検証されたように、我々はここでS.cerevisiae栽培のための改良された栽培セットアップ
基本的な操作手順、ならびに媒体流入ポンプの適切な管径およびポンプ速度を選択することによる希釈速度の調整は、前述のように行った。 ここで、各バイオリアクターの液体含有量の重量は、培養の終了時に重量測定的に決定され、それぞれの希釈速度を5で正確に計算することができる。偏差値1% 培養液および反応器の気相は、両方とも流出ポンプを使用して反応器蓋の同じポートを通して除去された(図2)。 1). 7.5mL分−1の流出ポンプ速度は、すべての培養実験のために使用されました。 流出ポンプ速度は給餌ポンプ速度をはるかに超えており,培養容器内にわずかな負圧を発生させた。 この圧力差は、曝気ポートを介して空気の流入をもたらした。 達成された平均酸素物質移動係数kLaは110h−1であり、これは培養プロセス全体で30%の飽和をはるかに上回るレベルを行うことを可能にした。 培地は先験的に6.0のpHに調整され、最終的なpHは培養液中で5.5になったので、pHはオンラインで監視されず、栽培中に制御されなかった。 反応器の流出からおよび収穫後に、pHを毎日ラインで測定した。 PHは、定常状態が達成されるとすぐに一定のままであり、反応器流出液は、0.
C制限条件下で異なる希釈速度で小規模ケモスタットにおける3HP生産を探索
最大比成長速度(μ max)を決定するために、S.cerevisiae ST938は、過剰な栄養 炭素源としてグルコースを用いたμ maxは0.265h−1であり、バイオマス収率は24.9g mol−1であり、グルコース上の3HP炭素収率は0.6%C-molであった(表1)。 この栽培モードでは、炭素のほとんどは、野生型Sの高解糖フラックスとして、エタノールとCO2に代謝されました。 cerevisiaeはアルコール発酵に強くリンクされています。 Chemostatの耕作は成長制限基質の供給によって制御されます。 定常状態では、野生型S.cerevisiaeは、炭素源の蓄積の欠如のために臨界希釈率(Dcrit(h-1))をマークし、特定の成長速度以下のオーバーフロー代謝産物の有意な量を生成しません。 この臨界希釈速度以上では、炭素源が反応器に蓄積し、オーバーフロー代謝が誘発され、エタノール、酢酸および少量の有機酸などの様々な副生成物が生成される。 したがって、連続培養は、成長速度とS.cerevisiae ST938におけるバイオマス特異的3HP生成物形成との関係を調査するために使用されました。 4つの異なる希釈率D(h−1):0.04、0.09、0.17および0.21は、バッチ培養で決定されたS.cerevisiae株ST938のμ max以下になるように選択されました。 グルコース上のバイオマス収率、ならびに3-HP収率、特定の3-HP生産速度、および特定の基質取り込み速度を調べた(図。 図2a–d、表1)。 すべての関連する栽培パラメータ、すなわちそれぞれの標準偏差を有する収量および速度を表1に要約する。

Selected rates and yields for C-limited aerobic chemostat cultivations of S. cerevisiae ST938 a 3-HP yield (C-mol C-mol−1) on glucose, b biomass yield on glucose (g mol−1), c specific 3-HP production rate (mmol gCDW−1 h−1) and d specific glucose uptake rate (mmol gCDW−1 h−1) at different dilution rates for S. cerevisiae ST938. Cultivations were carried out in triplicates at 30 °C and pH 5.5 under C-limited conditions. エラーは、三重栽培から派生した標準偏差に対応しています
C制限条件下でのS.cerevisiae ST938の栽培は、バッチモードで観察された主に発酵代謝から、より高いバイオマス収率だけでなく、無視できるエタノールおよびグリセロール形成に反映されているchemostatsにおける呼吸代謝へのスイッチを示した(表1)。 さらに、微量の残存グルコースは0以下である。異なる反応器の流出から採取した試料中に1mMが検出され、培養物がグルコース制限されていることが確認された。 定常状態のケモスタット培養で見つかった炭素制限条件は、この生成物の収率がバッチ培養で決定された収率よりも20-25倍高かったので、3-HPの形成 これは、バッチ培養での発酵と比較して、呼吸中のATPの形態での炭素のエネルギーへのより効率的な変換に起因する可能性が最も高い。 興味深いことに、Sの栽培。 c制限条件下でのcerevisiae ST938は、比成長速度の低下に伴い、3HP炭素収率の一定の増加が観察され、3HP収率が16.6%c-molの最高収率が0.04h-1の希釈速度で観察されたことを明らかにした(図。 2a)。 バイオマス上の3HP収率は、バッチ培養における収率よりも十倍高く、希釈率を0.21から0.04h−1に低下させることにより、0.19から0.43g gCDW−1に二重 およそ0.50mmol gCDW-1h−1の3HPのための最高の比生産性は0.17および0の希薄率で見られました。これは、バッチ栽培で測定されたものよりも約四倍高い(図21h−1)。 2c、表1)。 予想されるように、特異的グルコース取り込み速度(qS)は、0.51から2.1mmolのgCDW−1h−1へのより高い希釈速度とともに増加した(図10B)。 2d)。 これらの値は、バッチモードでグルコース制限成長条件下でμ maxで観察された10.7mmol gCDW-1h−1の最大特異的グルコース取り込み速度の20倍以下である(表1)。 0の希釈速度での特定の基質取り込み速度およびバイオマス収率について得られた値。09h-1(表1)は、0.10h-1の希釈速度で野生型S.cerevisiaeを用いたケモスタット栽培からのデータと一致しており、それぞれ1.1および1.25mmol gCDW−1h−1ならびに0.49g g−1 野生型s.cerevisiaeの場合,基質当たりのバイオマス収率は希釈速度の増加とともに増加するが,このパラメータは維持代謝が低い希釈速度でバイオマス収率を減少させるかなりの炭素シンクを構成する限り,Dcrit以下で一般的に一定であることが分かった。 Sの場合。 cerevisiae株ST938は、しかし、それはバイオマス形成に向けられていなかった炭素は、3-HPと副産物の両方の形成にある程度貢献していたように見えました。
結論として、異なる希釈速度での連続培養で経験した違いだけでなく、S.cerevisiae野生型と同様のセットアップと比較して、3-HPを生成するための統合された生合成経路は、おそらく適応ストレス応答によって増幅される酵母の生理学に多大な影響を与えることを示唆している。 最後に、0の最も低い希薄率のC限られたchemostatの耕作。04h-1は最高の3馬力の炭素収率をもたらした。
小規模ケモスタット培養における3HP収量の増加のための窒素およびリン酸制限の調査
S.cerevisiae ST938をC制限条件下で特性化した後、窒素およびリン酸制限条件下での栽培が行われた。 ここでは、窒素(N)およびリン(P)制限下での対応する栽培を、小規模連続栽培システムにおいて調べた(図。 0.04h−1の設定された希釈速度で、これは以前にC制限条件下で3-HPの最高炭素収率をもたらした(表1)。 酵母株ST938のN-およびP-限定栽培からのパラメータおよびそれぞれの標準偏差を表2に要約する。
nおよびP制限された栽培条件では、異なる反応器の流出から採取されたサ しかし、0.63および0.19mMの範囲のわずかな量の残存グルコースが、N-およびP-制限下で検出された(表2)。 C−制限の間に、残存グルコースレベルは、0.1m Mをはるかに下回っていた(表2)。 NおよびP制限を適用する栽培は、C制限栽培条件のために計算された3HP炭素収率16.6%c-molと比較して、P制限条件下で有意に高い値を表示し、それぞれ17.7および21.1%c-molの3HP収率を明らかにした(表1、2)。 同様に、3-HPの比生産性が大幅に0.22と0.23ミリモルgCDW-1h-1の値を明らかにN−とP限定栽培のために増加した0.17ミリモルgCDW−1h−1C限定培養で達 また、バイオマス上の3HP収率は0.43と0の同等の値を示した。44g gCDW−1C-およびN-制限条件のために、しかし、P-制限の場合には、0.50g gCDW−1の増加した収率が観察された。 定量化された副生成物の全体的な低濃度のために、これらは無視できる(表2)。 C-およびP-制限のための特定の基質取り込み速度(qS)の値は同等であり、0.61ミリモルgCDW−1h−1のわずかに上昇した値は、N制限条件下で得られた。 基質あたりのバイオマス収率は、それぞれ72.4と75.2g mol-1のN-とP制限条件同様の値のために明らかにした。 78の生物量の収穫と比較される。4g mol−1C制限条件下で達成され、これらの値は類似している。 我々の研究は、基板あたりのより高い生成物収率は、N-およびP制限条件下で達成されたという理論的根拠をサポートしています。 その結果,副生成物の最小形成と組み合わせたN制限の場合のより高い特異的基質取り込み速度は,最終的に生成物形成を支持するように思われた。 P制限条件下では、生成物の合成を有利にすることができる副生成物の最小量が形成された。 さらに、いくつかの代謝変化がCO2として放出される炭素量の低下につながる可能性があると推測することができる。
要約すると、N-およびP-制限の下でのケモスタット栽培は、P-制限が最も高い生成物収量を可能にして、C-制限条件と比較して増加した3-HP収率
小規模ケモスタットで測定された生理学的パラメータのc-およびP制限条件下での1-Lベンチトップバイオリアクターにおける流加培養への移 したがって、このアプローチの概念は、比較可能性を保証するために、ケモスタットおよび流加培養のための重要な条件およびパラメータを一定に保つこ これらの条件は、(i)P制限ケモスタット栽培に適用されるのと同じC:P比、(i i)p hおよび温度のような同一のプロセス条件、および(iii)指数関数的飼料プロフ 生成物力価を最適化するために、chemostat実験からの基質当たりの最大生成物収率を有するパラメータ(D=0。04h−1)c-およびP-制限の下で、フェドバッチシステムへの転送のために選択されました。 セットアップの技術的な制限のために、流加バッチ栽培は0.05h-1の成長速度で行われ、これはケモスタット栽培における0.04h−1の設定希釈率に比 フィードバッチ栽培は、バイオマスを生成するための初期バッチ相と、成長速度を制御するための指数関数的な栄養制限された供給相から成っていた。 この段階の間にのみ基質濃度が制御され、したがって微生物増殖を制限していたので、供給段階のみが連続栽培システムから得られたパラメータの移 C−およびP−制限条件を適用したS.cerevisiae ST9 3 8の流加培養プロファイルを図1 0に示す。 図3に示すように、それぞれの標準偏差を有する対応する栽培パラメータを表3に要約する。
図。 3
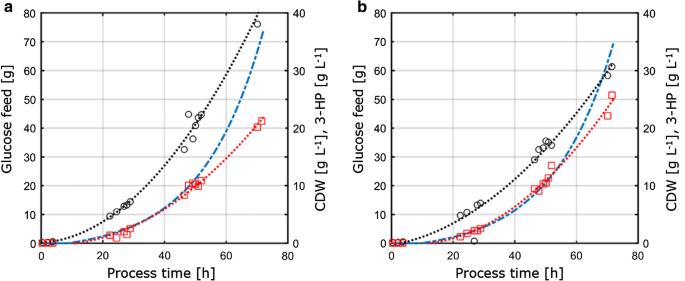
S.cerevisiae ST938の1Lベンチトップ発酵槽で、制限基板a炭素またはbリンとD=0.05h-1で指数供給ランプを使用して好気性 黒い円はバイオマス力価、3HP力価に赤い四角、反応器に供給されるグルコースの絶対量に青い破線を指します
表3Sの栽培パラメータ。 cerevisiae ST938炭素(C)とリン(P)制限条件下で1-Lベンチトップバイオリアクターで流加モードで成長

S.cerevisiae ST938の1Lベンチトップ発酵槽で、制限基板a炭素またはbリンとD=0.05h-1で指数供給ランプを使用して好気性 黒い円はバイオマス力価、3HP力価に赤い四角、反応器に供給されるグルコースの絶対量に青い破線を指します
流加培養で観察されたバイオマス収率は、そ P制限のために、わずかに減少したバイオマス収率は、両方のバイオマス収率のために観察された標準偏差内である、フェドバッチ操作(表2、3)中に観察されたのに対し、C限られた栽培のためのバイオマス収率は、chemostatとfed-batch操作の間で匹敵していた。 3-HPに対する基質当たりの炭素収率は、C-制限に対して15.9%であり、これはchemostatシステムで計算された値と比較してほぼ同一である(図10A)。 4a)。 本研究で決定された3HP収率は、β-アラニン経路を使用するように設計されたS.cerevisiae株でpH5.0で以前のC限定流加バッチ研究で得られた14%の基質当たりの炭素収率とマロニルCoAレダクターゼ依存性経路を利用したs.cerevisiae株で13%の炭素収率と密接に一致している。 Β-アラニン経路を介して基質あたりのより高い3HP炭素収率は、グルコース上の供給バッチ栽培で42%の値を示す大腸菌との研究で決定されました。

小規模ケモスタットと1-lベンチトップ反応器で決定された異なる制限の下での栽培パラメータの比較fed-batchモードで。 a3−hp炭素収率(%C−mol)およびバイオマス上のb3−HP収率(g GCDW−1)。 エラーは、三重栽培から派生した標準偏差に対応しています
P制限条件については、しかし、我々の研究では、3HPの炭素収率が25.6% 4a)。 バイオマス上の観察された3HP収率は、それぞれ、C-およびP制限条件のための0.38および0.65g gCDW−1であった。 C−制限のために、これは、chemostatの設定で観察された値を確認した(図1 0A)。 4b)。 P制限条件下での基質当たり3-HPの収率の増加と同時に基質当たりのバイオマス収率のわずかな減少のために、バイオマス当たり3-HPの収率はchemostat実験 ケモスタットで行われた栽培とは対照的に,エタノールまたはグリセロールの有意な蓄積は流加栽培では検出されなかった。 C−およびP−制限条件のための閉鎖炭素収支は、関連する量の他の(by−)生成物が形成されなかったことを示した(表3)。 副生成物スペクトルのこの違いは、グルコースあたりの3HP収率の増加を説明するかもしれません。
chemostatsで行わ栽培と比較して、流加培養で決定された特定のグルコース取り込み速度は、それぞれ0.75および0.77mmol gCDW-1h−1C−およびP制限条件のかなり高い値 上記のように、飼料プロファイルの指数因子の設定点を0.05h−1に設定し、0.059h−1まで変化させ、0を用いたchemostat実験と比較して、供給バッチ栽培で30-45%高04h-1(表3)、増加した特異的グルコース取り込み速度を引き起こす。 それにもかかわらず、c限定発酵のために、グルコース上のバイオマス収率は、ケモスタットと流加培養の間で同等であった。 同様に、特定の3HP生産速度は、それぞれ0.24ミリモルgCDW-1h-1と0.38ミリモルgCDW−1h−1で、供給バッチ栽培で上昇した。 基質あたりの3HP収率は、収量が栽培セットアップの小さな変動によって誘導される摂動に耐性がある堅牢な栽培パラメータであることを示唆し、chemostat P制限条件のために異なる反応器から採取したサンプルでは,グルコースと同様に残留りん酸塩は検出されず,培養物が対応する制限に関して制限されていることを確認した。 同様に、C−制限のために、試料中に残留グルコースは検出されなかった。
ここでは、以前にKleinらによって開発された小規模なchemostatシステムの改善を提示しました。 特に、反応器の数を24に増加させ、栽培量を6.5mLに減少させた。 並列化のこの高められた程度はさまざまな対等な小規模chemostatシステムがより高い作業量とリアクターのより低い数と作動するのでシステムに適した高効率のスクリーニング用具をする:連続的な平行振盪された生物反応炉(CosBios)システムは20-25mLの文化容積が付いている6つのそれぞれ8つの平行培養容器を使用する。 連続的な耕作のために変更されたsingle-use stirredred-tankの生物反応炉システム(生物反応炉、2mag AG)は10のmLの作業容積で8つの平行リアクターによって作動する。 Bergenholmらによって開発されたmini−chemost(M C)システム。 16の平行リアクターを含み、40のmLの作業容積を要求する。 従って私達のシステムは連続的なモードの微生物性能の簡単で、費用効果が大きいスクリーニングのためによく適当である。 しかし、排気ガスなどの追加パラメータを監視して、生理学的ひずみ特性化にとって特に重要な炭素分布の詳細な分析を可能にすることにより、システムをさらに拡張することは関連性がある可能性があります。
我々の研究は、N-とP-制限がS.cerevisiaeにおける3-HP形成のために有利であることを示唆したように、将来の実験は、それぞれの制限を持つ最適な3-HP産生を見つ さらに,ケモスタットから流加培養への生理学的パラメータの移動性を示した。 これは生理学的な変数がそのうちに変わり、chemostatsの得られた変数から逸脱するので有毒なか禁止の混合物が流加培養の間に集まらなければ実行可能で 一般的なアプローチとして、chemostatの実験は供給自体に物質を加えることによって潜在的な有毒なか禁止の混合物の影響を調査するための用具として役 他のすべてのパラメータは一定であるため、化合物およびその濃度の影響を直接評価および評価することができる。 我々の研究では、供給バッチ栽培で検出された副生成物の形成はなかったし、おそらく同様のストレス応答は、小規模なケモスタットの生理学的条件が供給バッチ条件のものに似ていることを可能にした弱酸のために誘導された。
要約すると、この研究では、3-HPの生産のためのC-およびP制限条件の概念は、新規並列化ケモスタット栽培システムで調査され、正常に流加モードで動作する1-Lベンチトップバイオリアクターに転送することができることを示した。 従って、chemostatsで得られる生理学的な変数はプロセス組み立てのための収穫基づかせていた変数を使用して流加栽培の設計そして性能の査定に使用す
