電気陰性度と結合極性
共有結合を電子共有と定義しましたが、共有結合の電子は常に二つの結合原子によって等しく共有されるわけではありません。 結合が同じ元素の二つの原子を接続しない限り、図4.3″極性対非極性共有結合”に示すように、結合中の電子を他の原子よりも強く引き付ける原子が常に存在する。 このような不均衡が発生すると、結合の片側に負電荷(部分負電荷と呼ばれ、δ−と呼ばれる)が蓄積され、結合の反対側に正電荷(δ+と呼ばれる)が蓄積される。 図4.3″極性対非極性共有結合”の部分(b)のように、電子の不均等な共有を有する共有結合は、結合全体に不均衡な電子分布を有する極性共有結合ボンダ共有結合と呼ばれる。. 電子の共有が等しい共有結合(図4の一部(a))。3″極性対非極性共有結合”)は、結合全体にバランスの取れた電子分布を持つ非極性共有結合ボンダ共有結合と呼ばれています。.図4.3極性対非極性共有結合
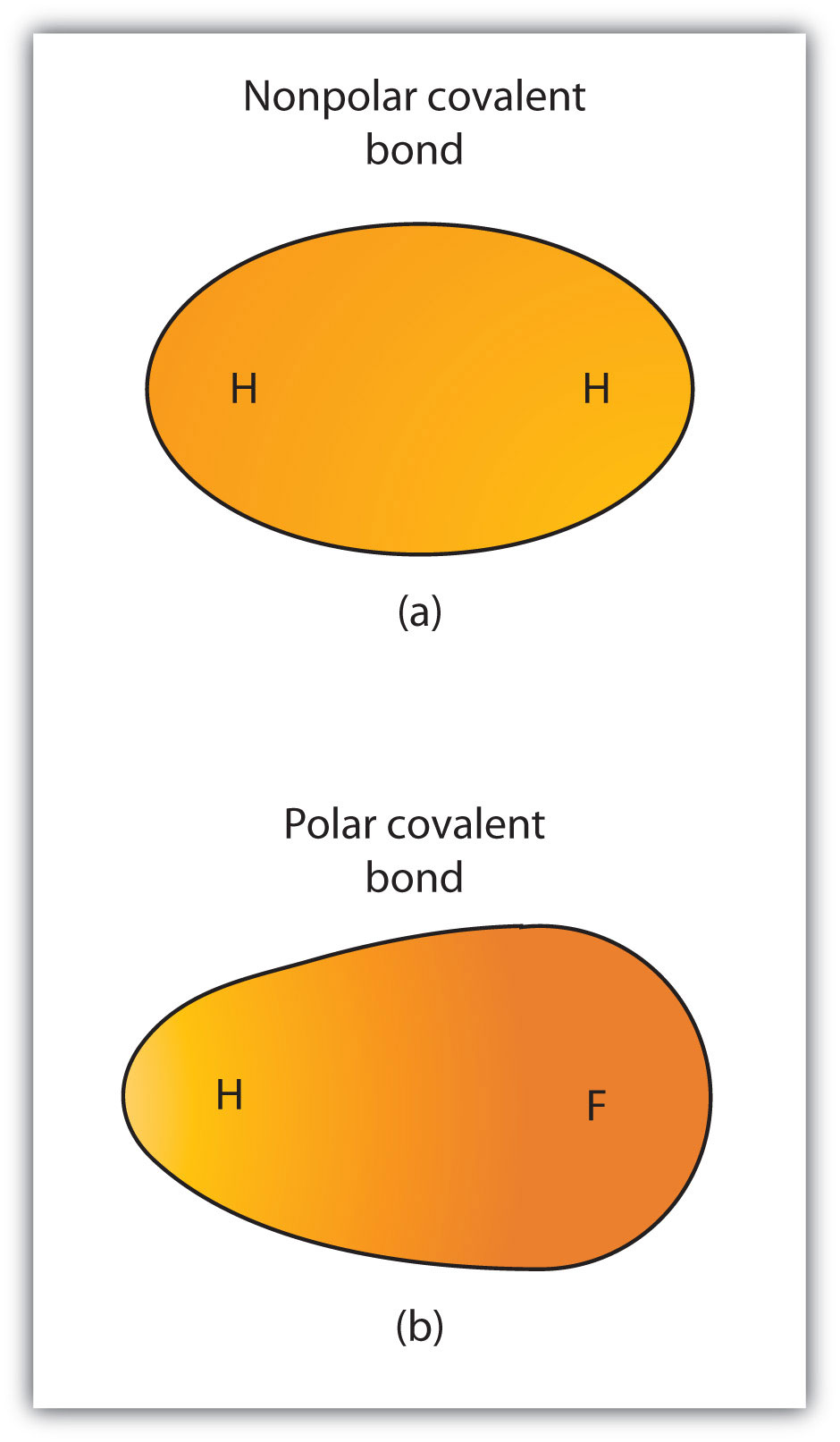
(a)共有結合中の電子は、両方の水素原子によって等しく共有されています。 これは非極性共有結合である。 (b)フッ素原子は、水素原子よりも結合中の電子を引き付け、電子分布の不均衡につながる。 これは極性共有結合である。異なる元素の原子間の任意の共有結合は極性結合であるが、極性の程度は大きく異なる。
異なる元素の原子間の任意の共有結合は極性結合 異なる要素間のいくつかの結合は最小限にしか極性がありませんが、他のものは強く極性があります。 イオン結合は究極の極性と考えることができ、電子は共有されるのではなく転送されます。 共有結合の相対的な極性を判断するために、化学者は電気陰性原子が共有結合を形成するときに電子をどれだけ強く引き付けるかの相対的な測 これは、共有結合を形成するときに原子が電子をどれだけ強く引き付けるかの相対的な尺度である。 電気陰性度の評価には様々な数値スケールがあります。 図4.4″さまざまな要素の電気陰性度”は、最も人気のあるものの1つであるポーリングスケールを示しています。 共有結合の極性は、結合を作る二つの原子の電気陰性度の差を決定することによって判断することができる。 電子陰性度の差が大きいほど、結合中の電子共有の不均衡が大きくなります。 ハードと高速のルールはありませんが、一般的なルールは、電気陰性度の差が約0.4未満の場合、結合は非極性とみなされ、差が0.4より大きい場合、結合は極性とみなされます。 電気陰性度の差が十分に大きい(一般に約1.8より大きい)場合、得られる化合物は共有結合ではなくイオン性であると考えられる。 ゼロの電気陰性度の差は、もちろん、非極性共有結合を示します。
図4.4さまざまな要素の電気陰性度
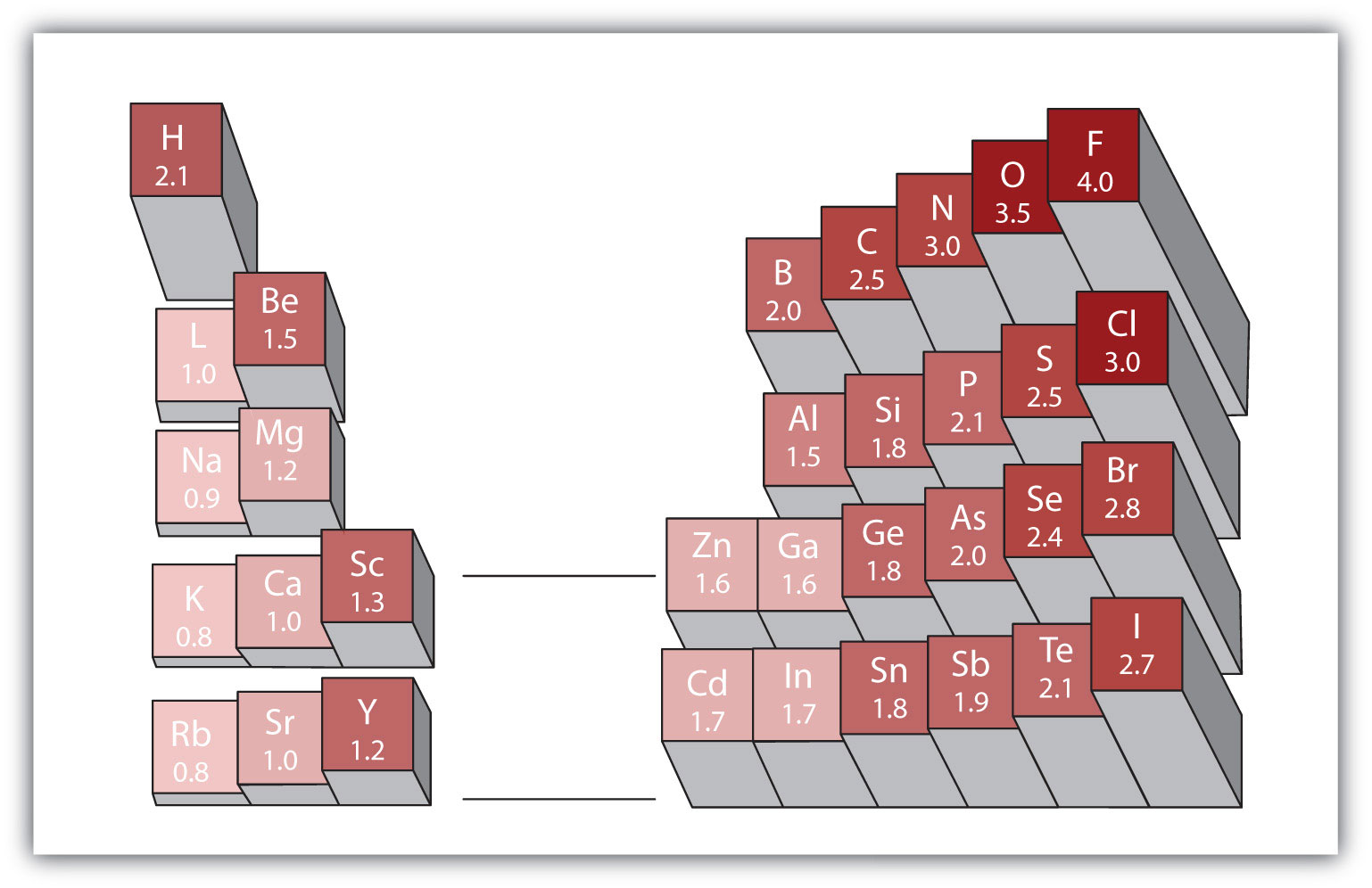
電気陰性度のための一般的なスケールは、フッ素原子の値が4.0、最高値に設定されています。
詳しく見る:Linus Pauling
間違いなく20世紀の最も影響力のある化学者、Linus Pauling(1901-94)は、二つの個人(つまり、非共有)ノーベル賞を受賞した唯一の人です。 1930年代、ポーリングは化学結合のいくつかの基本的な原理を明らかにするために新しい数学的理論を使用しました。 彼の1939年の著書”化学結合の性質”は、これまでに化学で出版された最も重要な本の一つです。1935年までに、ポーリングの関心は生物学的分子に変わり、彼はタンパク質構造に関する彼の研究のために1954年のノーベル化学賞を授与されました。 (彼は1953年にJames WatsonとJames Crickがその構造の発見を発表したとき、DNAの二重らせん構造を発見することに非常に近かった。 1962年には、核兵器の実験禁止に尽力した功績でノーベル平和賞を受賞している。
彼の晩年、ポーリングはビタミンCの大量投与は、一般的な風邪を含む病気を防ぐだろうと確信しました。 ほとんどの臨床研究は接続を示すことができませんでしたが、ポーリングは毎日大量の用量を服用し続けました。 彼は1994年に亡くなり、生涯を費やして科学的遺産を確立しました。

Linus Paulingは20世紀の最も影響力のある化学者の一人でした。
例6
原子の各ペアと結果の極性(または結合タイプ)との間の電気陰性度の違いを説明します。p>
- CとH
- HとH
- NaとCl
- OとH
溶液
- 炭素は2.5の電気陰性度を有し、水素の値は2.1である。 差は0.3であり、これはかなり小さい。 したがって、C-H結合は非極性であると考えられている。
- 両方の水素原子は同じ電気陰性度値を持っています—2.1。 差はゼロであるので、結合は非極性である。
- ナトリウムの電気陰性度は0.9であり、塩素は3.0である。 その差は2.1であり、これはかなり高いので、ナトリウムと塩素はイオン化合物を形成する。
- 水素の場合は2.1、酸素の場合は3.5で、電気陰性度の差は1.4です。 我々は非常に極性結合を期待するだろうが、O–H結合がイオン性であると考えられるほど極性ではない。
スキル構築演習
-
CとO
-
KとBr
-
NとN
-
CsとF
原子の各ペアと結果の極性(または結合タイプ)の電気陰性度の違いを記述します。/p>
分子の結合が極性である場合、分子全体として表示することができます個々の結合がどのように配向されているかに応じて、電荷の不均一な分布。 例えば、水分子内の2つのO–H結合の配向(図4.5「物理的性質と極性」)が曲がっている:分子の一端は部分的な正電荷を有し、他端は部分的な負電荷を有する。 要するに、分子自体は極性である。 水の極性は、その物理的および化学的特性に大きな影響を与えます。 (例えば、水の沸点は、このような小分子のために高く、極性分子が互いに強く引き付けるという事実によるものである。 対照的に、二酸化炭素中の2つのC=O結合は極性であるが、それらは互いに正反対にあり、互いの効果を相殺する。 したがって、二酸化炭素分子は全体的に非極性である。 極性のこの欠乏は二酸化炭素の特性のいくつかに影響を与えます。 (例えば、二酸化炭素は-77℃でガスになり、水が沸騰する温度よりもほぼ200℃低くなります。)
図4.5物理的性質と極性

水と二酸化炭素の物理的性質は、それらの極性によって影響されます。
コンセプトレビュー演習
-
共有結合中の2つの原子間の距離の名前は何ですか?
-
原子の電気陰性度は何を示していますか?電気陰性度の差が小さい場合、2つの原子の間にどのようなタイプの結合が形成されますか? ミディアム? 大きい?
答え
-
結合長
-
電気陰性度は、原子が共有結合中の電子を引き付ける量の定性的尺度です。
-
非極性;極性;イオン
キー持ち帰り
- 異なる原子間の共有結合は、異なる結合長を有する。
- 共有結合は、関与する原子間の電気陰性度の違いに応じて、極性または非極性にすることができます。
- 共有結合は、極性または非極性であり得
練習
-
どちらが長いですか—C–H結合またはC–O結合? (表4.2″いくつかの単結合のおおよその結合長”を参照してください。
-
どちらが短いですか—N–H結合またはC–H結合? (表4.2″いくつかの単結合のおおよその結合長”を参照してください。表4.2″いくつかの単結合のおおよその結合長”および表4のデータを使用して、ナノメートルは10-9mです。3″単結合と多重結合の結合長の比較”では、各結合の長さをナノメートル単位で決定します。
- A C–O結合
- A C=O結合
- H–N結合
- A C≤N結合
-
オングストローム(Å)は10-10mと定義されています。表4.2″いくつかの単結合のおおよその結合長”と表4.3″単結合と多重結合の結合長の比較”を使用して、オングストローム(Å)は10-10mと定義されています。オングストローム単位の各結合の長さ。
- C–C結合
- C=C結合
- N≤N結合
- H–O結合
-
演習3を参照してください。 ナノメートル単位が結合長を表す単位として有用なのはなぜですか?
-
演習4を参照してください。 オングストローム単位が結合長を表す単位として有用なのはなぜですか?
-
図4.4″さまざまな要素の電気陰性度”を使用して、各ペアのどの原子がより高い電気陰性度を持つかを決定します。P>
- HまたはC
- OまたはBr
- NaまたはRb
- IまたはCl
-
図4.4″様々な元素の電気陰性度”を使用して、各ペアのどの原子が電気陰性度Li>
- MgまたはO
- SまたはF
- AlまたはGa
- OまたはI
-
電子は各共有結合間で均等または不均等に共有されますか? 不等であれば、どの原子に電子がより強く描かれていますか?/li>
- C–O結合
- F–F結合
- S–N結合
- I–Cl結合
-
電子は各共有結合にわたって均等または不均等に共有されますか? 不等であれば、どの原子に電子がより強く描かれていますか?
- C–C結合
- S–Cl結合
- O–H結合
- H–H結合
回答
-
C–O結合は長いです。
-
- 0.143nm
- 0.120nm
- 0.100nm
- 0.143nm
- 0.143nm
- 0.120nm
- 0.120nm
- 0.100nm
- 0.116nm
実際の結合長は非常に小さいので、ナノメートル単位は長さの表現を理解しやすくします。/li>
- c
- O
- Na
- Cl
- 不等にOに向かって等しく
- 等しく
- 不等にNに向かってcl
