プログラムされた細胞死の二つのタイプの簡単な説明:アポトーシスとオートファジー
アポトーシス、またはタイプIプログラムされた細胞死は、最も広く細胞死の形態の研究されています。 その形態学的特徴は、光学顕微鏡下で同定することができ、細胞収縮、クロマチンの圧縮、細胞質膜のblebbing、そして最終的にはアポトーシス体の形成を含む(図1)。 Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
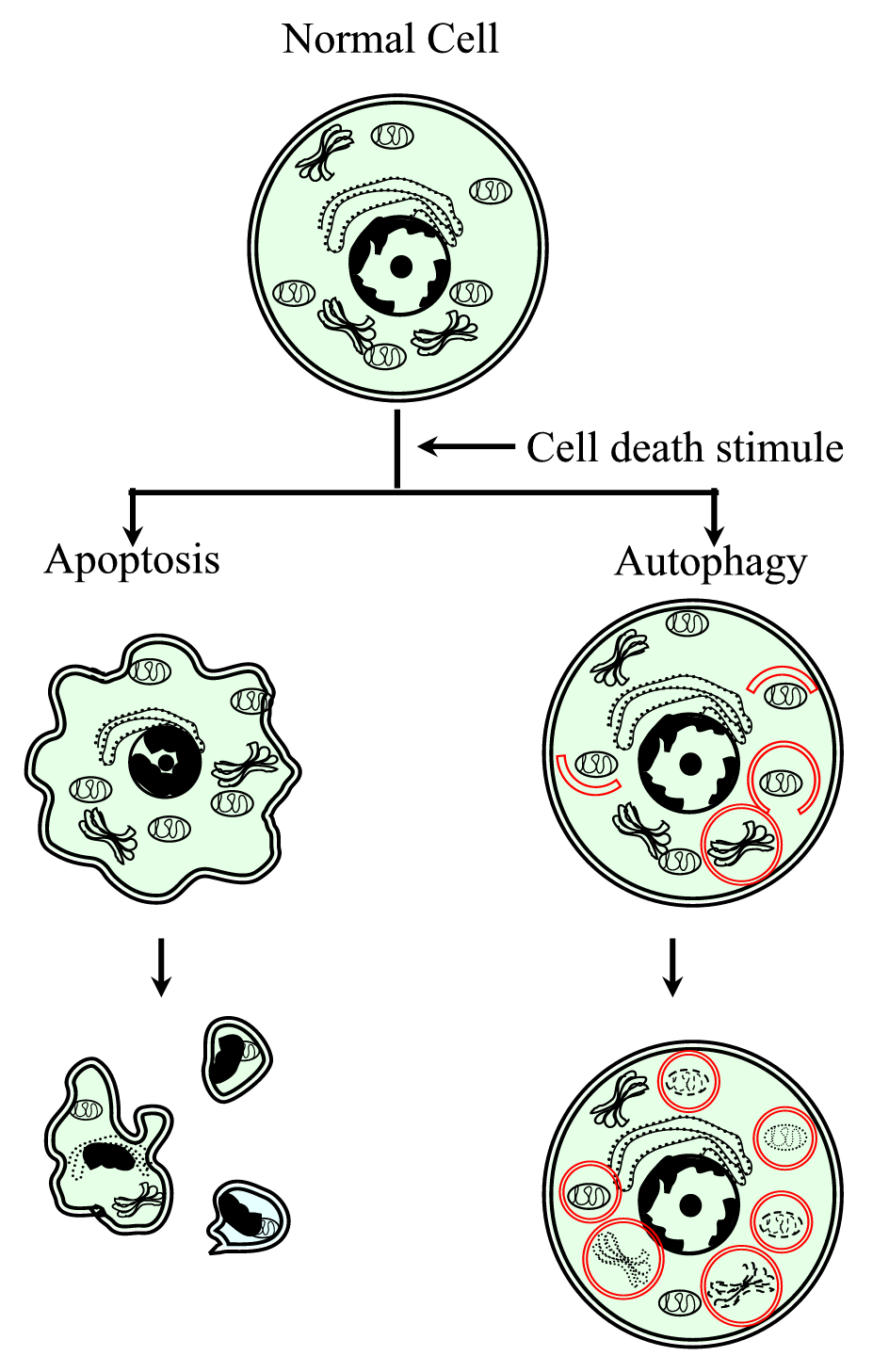
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceプログラムされた細胞死プロセスタイプI(アポトーシス)およびタイプII(オートファジー)の概略図。 アポトーシスは、細胞の収縮、クロマチンの圧縮、膜状のブレブ、およびアポトーシス体の形成によって特徴付けられる。 オートファジーは、細胞質含有量を有する多数のオートファゴソームの存在を特徴とする。 細胞質膜は、細胞破片が近傍または特殊なものによって除去されるまで保存されるので、両方のタイプの細胞死は炎症応答を生成しない。
カスパーゼは、プロカスパーゼと呼ばれるジモゲンとして不活性な形態で合成されるシステイニルアスパレート特異的プロテアーゼである(図2)。 細胞死プロセスの制御された実行を可能にするのは、この不活性形態である。 カスパーゼは線虫Ceanorhabditis elegansで最初に同定されたが、哺乳類には相同形態が存在する。
DNA断片化や圧縮されたクロマチンなどのアポトーシスの特徴は、カスパーゼ活性に起因する。 アポトーシスの間に、DNAはヌクレオソームサイズ(200bp)に断片化される。 アポトーシス中のDNA断片化の原因となる因子は、活性カスパーゼ-3によって活性化される特定のDNase(CAD、カスパーゼ活性化DNase)である。 活性カスパーゼ-3は、順番に、それがそれを活性化するためにrho関連キナーゼ-1(ROCK-1)を切断し、これは、最終的には、アポトーシス収縮形態を引き起こす細胞骨格の配置に影響を与えるアポトーシス中の形態学的細胞変化に関与している。

図2。
xmlns:xlink=”http://www.w3.org/1999/xlink”xmlns:mml=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceアポトーシス過程に関与するカスパーゼは、zymogenとして不活性な形態で合成され、プロドメイン、大きなサブユニット、および小さなサブユニットによって構成される。 ジモゲンは活性化されて四量体を形成する。
アポトーシス細胞死は非常にB細胞リンパ腫2(Bcl-2)ファミリーのメンバーによって調節されています。 Bcl-2ファミリーメンバーは、Bcl-2相同性(BH)およびドメイン組織に従って、抗アポトーシスおよびプロアポトーシスタンパク質として分類されている(図3)。 ドメインBH1、BH2、BH3、およびBH4の存在は、アポトーシスを阻害するグループに対応しています。 対照的に、アポトーシス促進群は、ドメインBH1、BH2、およびBH3を有する群と、ドメインbh3のみを有する群(BH3のみと定義される;レビューを参照)に分けら 蛋白質のこの系列はmitochondriaの中の細胞内のレベル、apoptosisのキーエレメントで機能を行います。

図3。h4> xmlns:xlink=”http://www.w3.org/1999/xlink”xmlns:mml=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceB細胞リンパ腫2(Bcl-2)ファミリータンパク質。 A)Bcl-2タンパク質の構造の一般的なスキーム化。 B)抗アポトーシスのメンバー–彼らはすべての4つのBHドメインを持っています。 C)順番に二つのグループに分割されているプロアポトーシスのメンバー:マルチドメインとBH3のみ。
アポトーシスは、外因性経路と内因性経路の二つのよく記述された経路によって開始することができます(図4)。 外因性活性化は、死リガンド(例えば、腫瘍壊死因子–TNF–スーパーファミリー、およびTNF関連アポトーシス誘導リガンド、またはTRAIL)とその同族の細胞表面死受容体(例えば、TNF受容体1、Fas、TRAIL受容体1、またはTRAIL受容体2)の関与を介して行われる(で概説される)。 リガンドが認識し、その受容体に結合すると、一連の細胞内複合体が形成され、イニシエータカスパーゼ(-8および-10など)が活性化され、次いで死刑執行カスパーゼ(-3、-6、および-7など)が活性化される。 In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. リガンド-受容体相互作用は、順番にアポトーシスの形態学的変化に伝導し、エグゼキューターカスパーゼ-3、-6、または-7に活性化することができるカスパーゼ-8の活性化を促進するために死誘導シグナリング複合体(DISC)のアセンブリを誘導する。 シトクロム-Cはアポトーシスプロテアーゼ活性化因子1(Apaf-1)を誘導し、アポトソームを組み立てるためにカスパーゼ-9の活性化を促進する。 アポトソームはカスパーゼに活性化することができる。対照的に、内在性アポトーシス経路は、DNA損傷、成長因子飢餓、および酸化ストレスを含む様々な刺激によって活性化することができる。 これらの刺激への細胞の露出の間に、mitochondriaはBcl-2家族の複数のメンバーが活動化させ、mitochondriaの外の膜のpermeabilization(MOMP)を促進するので、影響を受けています。 浸透した外部ミトコンドリア膜は、Apaf-1タンパク質に関連するシトクロムc(cyt c)の放出を可能にする。 その後、cyt cとApaf-1の結合は開始剤カスパーゼ-9と結合してアポトソームを構成する複合体を形成し、特定の細胞基質を切断することによってその機能を果たす開始剤カスパーゼを活性化する能力を有する。
細胞死の第二のプロセス、オートファジーは、時代遅れのオルガネラやタンパク質の分解を生成する遺伝的にプログラムされ、進化的に保存されたプ それは、栄養飢餓、低酸素症、高温、および損傷したまたは余分なオルガネラの蓄積を含む細胞内条件の変化などの細胞外刺激によって活性化される(
真核生物では、マイクロオートファジー、マクロオートファジー(一般に単にオートファジーと呼ばれる)、シャペロンを介したオートファジーの三つのタイプが記載されている(図5)。 マイクロオートファジーは、陥入プロセスによってリソソームのレベルで細胞質成分を直接巻き込むことを含み、マクロオートファジーは、リソソームと融合してオートファゴリソソームを形成する細胞成分を含む二重膜小胞の形成を伴う。 小胞内成分が分解され、可能であれば細胞によってリサイクルされるのは、オートファゴリソソームの内部にある(でレビュー)。 シャペロンを介したオートファジーは、最終的に、リソソームによる除去のために指定されたタンパク質を認識するシャペロンの参加を伴います。

図5。
xmlns:xlink=”http://www.w3.org/1999/xlink”xmlns:mml=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceオートファジーの異なるメカニズムの概略的な表現。 マクロオートファジー-オートファジー-は、分解されるリソソームに行われる細胞質内容物を巻き込む二重膜小胞の形成を意味する。 マイクロオートファジーは、リソソームによる細胞質成分の直接巻き込むことを特徴とする。 このプロセスは、リソソーム膜陥入を形成することにより、オルガネラの膜のリモデリングを含みます。 シャペロン媒介オートファジーの間に、分解されるべき蛋白質はリソソームにそれからターゲット貨物を運ぶHsp70のために目標とされます。
オートファジーは、オートファゴソームの形成をトリガーするシグナル伝達複合体を活性化するために必要とされるAtg(オートファジー関連)遺伝子によ Atggenesは酵母で発見されましたが、多くは高等真核生物でオルソログを持っています(図6)。 オートファゴソーム形成は、ホスファチジルエタノールアミンによる脂質分解を受けた細胞質タンパク質LC3(Atg8)の関与を伴い、新生オートファゴソーム膜に動員される(図7)。 Lipidated LC3蛋白質の蓄積は(LC3-IIとして知られている)autophagyのマーカーとして使用されます。

図6。h4> xmlns:xlink=”http://www.w3.org/1999/xlink”xmlns:mml=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. LC3タンパク質はホスファチジルエタノールアミンによって脂質化される。
自食細胞死、またはII型プログラムされた細胞死は、自食小胞によって細胞質の大規模な巻き込みによって特徴付けられます。 この強烈な自食作用は、基礎レベルで連続的に起こる自食作用とは実質的に異なる。 ショウジョウバエにおける超微細構造研究は、ほとんどの幼虫組織における自食性空胞の蓄積を明らかにした。 このタイプのプログラムされた細胞死は、オートファジーによる細胞質オルガネラの分解から始まるが、細胞骨格要素はプロセスの後期段階まで保存される(でレビューされる)。
