1980年代後半にカンナビノイド拮抗薬を開発する最初のアプローチは、THCの構造を変更することでしたが、結果は 1990年代初頭にcannabinoidのアゴニストの新しい系列はいくつかの限られた成功のアミノアルキルインドールの反対者の発見をもたらしたNSAID(非ステロイドの炎症抑制)の薬剤のpravadolineから発見されました。 アゴニストの構造に基づく調査が失望していたので最初の有効で、選択的なcannabinoidの反対者が全く新しい化学家族に属したことは驚きではなかった。 1994年に最初の選択的なカンナビノイドの反対者、SR141716(rimonabant)は1,5-diarylpyrazolesの家族に属するSanofiによって、導入されました。h3>
メインの記事
メインの記事
メインの記事
: Rimonabant
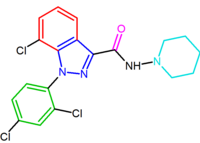
 Figure 2 Chemical structure of rimonabant
Figure 2 Chemical structure of rimonabant
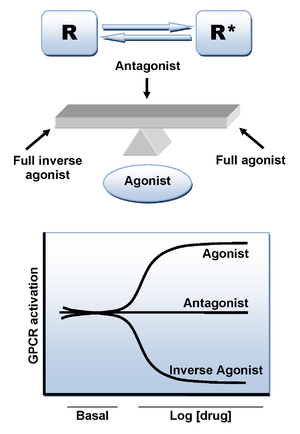 Figure 3 Schematic representation of the two state-model of CB1 receptor activation, in which receptors are in equilibrium between two states, active and inactive (R* and R)
Figure 3 Schematic representation of the two state-model of CB1 receptor activation, in which receptors are in equilibrium between two states, active and inactive (R* and R)
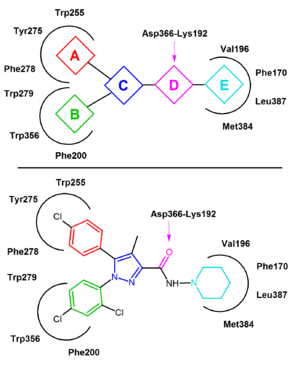 Figure 4 A general CB1 receptor inverse agonist pharmacophore model. 受容体-リガンド相互作用における推定CB1受容体アミノ酸側鎖残基を示した。 Rimonabantは代表的な例として下記に取られます。 適用された色は、一般的なCB1ファーマコホアとの相互特性を示しています
Figure 4 A general CB1 receptor inverse agonist pharmacophore model. 受容体-リガンド相互作用における推定CB1受容体アミノ酸側鎖残基を示した。 Rimonabantは代表的な例として下記に取られます。 適用された色は、一般的なCB1ファーマコホアとの相互特性を示しています
: Rimonabant



リモナバントは、系統名でも知られており、1,5-ジアリールピラゾールCB1受容体アンタゴニストである(図2)。 Rimonabantはだけでなく、CB1受容器の有効で、非常に選択的な配位子ですが、また口頭で活動的で、cannabinoidのアゴニストの効果のほとんどを、生体外および生体内 Rimonabantは肥満の処置のための明確な臨床効力を示しました。
BindingEdit
cb1受容体へのアゴニストリガンドの結合は、コンフォメーション変化を引き起こし、シグナル伝達を担う受容体の活性状態につながる。 しかし、リガンドの非存在下で活性状態につながる可能性のある追加のメカニズムがある。 多数の他のGPCRsとして、CB1受容器は構成的な活動の高レベルを表示し、こうして自発的に細胞内シグナリングの高い基底のレベルを保つアゴニストの結合の非存在下で活動的なconformational状態を採用できます。 これは、受容体が活性と不活性の2つの状態(R*とR)の間で平衡状態にある受容体活性化の2つの状態モデルによって説明することができる。 アゴニストは活性状態を安定化させて活性化をもたらし、中性アンタゴニストは活性状態と不活性状態に等しく結合するのに対し、逆アゴニストは優先的に不活性状態を安定化する(図3)。
リモナバントは、多くの場合、中性アンタゴニストとしてではなく逆アゴニストとして振る舞うことが報告されており、CB1の不活性状態に優先的に結合し、それによってシグナル伝達経路の活性化を減少させる可能性が高い。 重要な結合相互作用は、リモナバントのカルボニル基とCB1受容体のLys192残基との間に形成される水素結合である。 この結合は、膜貫通ヘリックス3および6の細胞内末端のLys192-Asp366塩橋を安定化させる(図4)。 この特異的な塩橋は、受容体の不活性状態に存在するが、活性状態には存在しない。
CB1の不活性状態では、リモナバントは膜貫通内に結合する-3-4-5-6 アロママイクロドメイン。 リモナバントの結合は、2,4-ジクロロフェニル環と一方の側のTrp279/Phe200/Trp356残基と他方の側のパラ-クロロフェニル環とTyr275/Trp255/Phe278残基との間の直接芳香族スタッキング相互作用を含む。 親油性ピペリジニル部分は、アミノ酸残基Val196/Phe170/Leu387およびMet384によって形成された空洞にうまく収まる(図4)。
PharmacophoreEdit
これまでに報告されたほとんどのCB1拮抗薬は、リモナバントの類似体またはイソステレスである。 一般的なCB1逆アゴニストファーマコフォアモデルは、これらの類似体であるジアリールピラゾールの共通の特徴から抽出することができます(図4)。 このファーマコホアは、二つの芳香族部分、AおよびBによって置換された環状コア、C(例えば、リモナバント中のピラゾール)を含む。水素結合アクセプター単位、Dは、cを環状親油性部分、Eと接続する。場合によっては、単位EはCに直接接続する。図4において、リモナバントが例として使用される。 単位Aは4-クロロフェニル基を表し、単位Bは2,4-ジクロロフェニル環を表す。 単位Cは中心ピラゾール環であり、単位Dは水素結合受容体として機能するカルボニル基を表す。 単位Eは親油性アミノピペリジニル部分を表す。
構造-活性関係編集
CB1受容体での最適な結合は、ピラゾール5位にパラ置換フェニル環を必要とする。 ピラゾールの5-置換基は、受容体認識および拮抗作用に関与する。 フェニル環のパラ置換基は、塩素、臭素またはヨウ素であり得るが、アルキル鎖も許容され得ることが示されている。 中央のピラゾール環の番号付けを図2に示します。
ピラゾール1位の2,4-ジクロロ置換フェニル環は、親和性および活性のために好ましい。 このフェニル環上の付加的なハロゲンが親和性を低下させることが示されている。
リモナバント中の1-ピペリジニル基のような3-カルボキサミド基で環置換を有することも好ましい。 アミノピペリジニル置換基のアルキルアミド,エーテル,ケトン,アルコールまたはアルカンによる置換は,主に親和性の低下をもたらした。 ピペリジニルをペンチル鎖またはヘプチル鎖に置換すると,化合物はアゴニスト的性質を示した。 これらの結果に基づいて、ピラゾール3位はアゴニズムに関与しているようであり、1位、4位、5位は拮抗作用に関与しているようであると結論された。
研究は、カルボキサミド酸素の不在が親和性を低下させることを示している。 さらに,カルボキサミド酸素の存在は逆アゴニスト特性を付与するのに寄与するが,この酸素を欠く類似体は中性アンタゴニストであることが分かった。 これらの結果は、カルボキサミド酸素がCb1受容体でLys192残基と水素結合を形成するという仮説を支持する。
ジアリールピラゾール誘導体編集
SR141716(リモナバント)類似体は、最近、この化学群内の構造活性関係(SAR)の良好な理解につながる、いくつかのグループによ 記載されているほとんどの化合物はSR141716よりも強力ではありませんが、SR147778およびAM251の二つは言及する価値がありますが、両方ともmuオピオイド受容体でも作用している可能性があります。
第二世代アンタゴニストであるSR147778(スリナバント)は、リモナバントよりも長い作用持続時間を有し、経口活性を増強する。 行為のこの高められた持続期間はピラゾールリングの4位置におそらくより代謝的に安定したエチルグループの存在が原因です。 もう一つの変更は臭素による5フェニルの塩素の置換基の取り替えです。
ジアリールピラゾール誘導体AM251は、塩素置換基が5-フェニル環のパラ位でヨウ素に置き換えられている場所で記載されている。 この派生物はrimonabantより有効、選択的であるようであった。
21位の変異長のアルキルアミドまたはアルキルヒドラジドのいずれかを有する類似体が合成された。 親和性は五つの炭素までの炭素鎖長の増加とともに増加することが観察された。 またアミド類縁体はヒドラジド類縁体よりも高い親和性を示した。 しかし、これらの類似体のどれもrimonabantよりも有意に大きな親和性を持っていなかったが、それにもかかわらず、彼らはCB1受容体上のCB2受容体のためのrimonabantよりもわずかに選択的であった。
リモナバントの構造を剛性化することにより、ジアリールピラゾール誘導体の親和性を高めるためのいくつかの試みがなされている。 一般的な薬物経路モデルに関しては、単位A、Bおよび/またはCは、剛体分子を導く付加的な結合によって連結される。 例えば、縮合多環式ピラゾールNESS-0327は、リモナバントよりもCB1受容体に対して5000倍以上の親和性を示した。 但し、この混合物は悪い中央生物学的利用能を所有しています。別の化合物、インダゾール誘導体O-1248は、その5-アリール基がピラゾール部分に融合しているリモナバントの類似体とみなすことができる。
しかし、この構造的修飾は、CB1受容体親和性の67倍の減少をもたらした。
これらのリモナバントのジアリールピラゾール誘導体を表1にまとめた。

|  |
| SR147778 | AM251 |
 |
 |
| NESS-0327 | O-1248 |
Other derivativesEdit
Structurally different from the 1,5-diarylpyrazoles are the chemical series of the 3,4-diarylpyrazolines. このシリーズの中ではSLV-319(ibipinabant)、CB2と比較されるCB1のために約1000倍より選択的で、rimonabantと同じような生体内の活動を表示する有効なCB1反対者です。
リモナバントの類似体を開発するために使用される別のアプローチは、中央ピラゾール環を別の複素環に置き換えることであった。 このアプローチの例は、4,5-ジアリールイミダゾールおよび1,5-ジアリールピロール-3-カルボキサミドである。
ジアリール-ピラゾールおよびイミダゾールの多数の縮合二環誘導体が報告されている。 これらの例は、ピリミジン環がイミダゾール環に縮合したプリン誘導体である。 オテナバント(CP-945,598)はファイザーによって開発された縮合二環式誘導体の例である。
いくつかの研究グループは、六員環ピラゾールバイオイソステレスを研究しています。 例えば、一つの2,3-ジアリールピリジン誘導体は、強力かつ選択的CB1逆アゴニストであることが示された。 この化合物の構造は、リモナバントのアミド部分が親油性(ベンジルオキシ)と極性(ニトリル)機能性に分割できる可能性を示している。 他の六員環類似体は、例えば、ピリミジンおよびピラジンである。
五員環および六員環類似体に加えて、アゼチジンのような他の環状誘導体がある。
五員環類似体に加えて、アゼチジンのような他の環状誘導体 一例は、ジアリールピラゾールの1,5-ジアリール部分を模倣する1,1-ジアリール基を有するメチルスルホンアミドアゼチジン誘導体である。 スルホニル基は水素結合受容体として働く。 1,1-ジアリール基は、ベンゾジオキソールやヒダントインなどの誘導体にも存在する。非環式類似体も報告されている。
非環式類似体も報告されている。 これらの類似体は、リモナバントの1,5-ジアリール置換基に対応する1,2-ジアリールモチーフを含む。 非環式類似体の例は、merckによって開発されたtaranabant(MK-0364)である。
これらの類似体の代表者を表2に要約する。
 |
 |
 |
|
| Type of derivative |
3,4-Diarylpyrazoline (Ibipinabant) | 4,5-Diarylimidazole | 1,5-Diarylpyrrole-3-carboxamides |
 |
 |
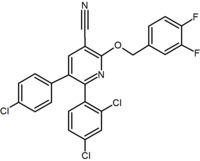 |
|
| Type of derivative |
Purine (pyrimidine ring fused to an imidazole ring) |
Purine derivative (Otenabant) | 2,3-Diarylpyridine |
 |
 |
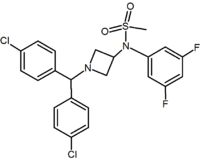 |
|
| Type of derivative |
Pyrimidine | Pyrazine | Methylsulfonamide azetidine |
 |
 |
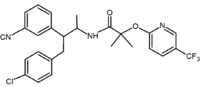 |
