L’uso di una terminologia coerente all’interno e tra gli studi è fondamentale per consentire un processo di prova efficiente. Gli standard CDISC come CDASH, SDTM, SEND e ADaM standardizzano le strutture da utilizzare durante la raccolta e l’invio dei dati, ma per quanto riguarda i valori dei dati stessi?
Questo post fornisce una panoramica della terminologia controllata standardizzata del CDISC e di come dovrebbe essere utilizzata per raccogliere e inviare dati in modo da velocizzare le prove e consentire l’analisi di studi incrociati.
Se sei interessato a leggere di più sugli standard CDISC puoi leggere i nostri blog Tutto ciò che devi sapere su SDTM e Introduzione agli standard CDISC.
CDISC partner con NCI per definire la terminologia standardizzata
CDISC ha collaborato con il National Cancer Institute (NCI) per contribuire a portare coerenza alla terminologia negli studi clinici. Attraverso questa collaborazione è stato definito un insieme standard di terminologia che viene aggiornato trimestralmente, portando coerenza semantica tra gli studi. Utilizzando questa terminologia, la stessa informazione sarà rappresentata nello stesso modo in tutti gli studi.
Facciamo un semplice esempio – Sesso:
- Il maschio dovrebbe essere rappresentato da “Maschio”, “MASCHIO”, “M” o “1”?
- Come dovrebbe essere registrato qualcuno che è intersex?
Nei giorni passati queste informazioni potrebbero essere state raccolte in modi diversi per ogni studio. Lo standard terminologico CDISC NCI ora definisce che le uniche opzioni consentite sono ” F”, “M”, “U” e “INDIFFERENZIATA”, e che una persona che è intersessuale dovrebbe essere registrata come “INDIFFERENZIATA”. Puoi vedere come questo esempio molto semplice rende già molto più facile comprendere i dati sottostanti e segmentare facilmente le diverse popolazioni attraverso gli studi.
![]() Note
Note
Il catalogo degli standard di dati della FDA ora impone che la terminologia NCI standardizzata sia utilizzata per tutti nuovi studi. Questo rende la vita di un recensore molto più facile, in quanto sanno come interpretare i dati.

Come viene definita la terminologia CDISC NCI?
La tabella seguente mostra come viene definita la terminologia del sesso standard.
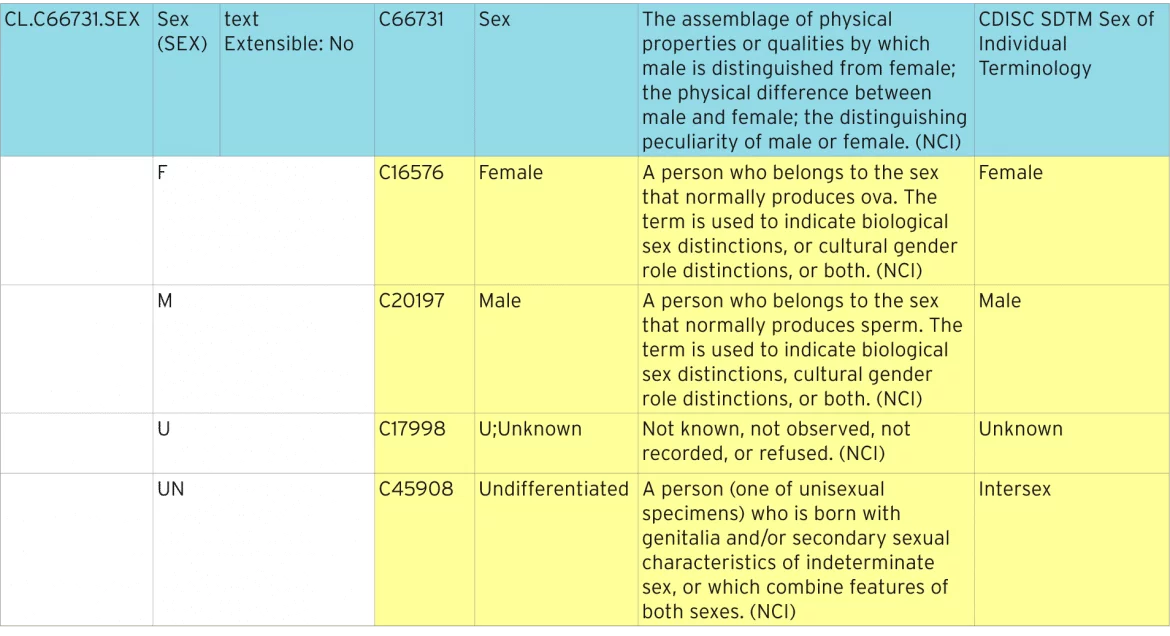
Identificazione della terminologia standardizzata
La riga blu rappresenta l’elenco di codici che contiene tutti i singoli codici. L’elenco dei codici ha un “codice C” standard di “C66731″. Ciascuno dei singoli codici ha il proprio codice C, ad esempio”C16576”. Questi codici C sono utilizzati nei metadati ODM e Define-XML per identificare gli elenchi di codici come terminologia standard NCI.
Estensibilità
Questa lista di codici è definita come non estensibile, il che significa che ovunque venga utilizzata la lista di codici non deve contenere termini non elencati qui. Agli elenchi di codici estensibili possono essere aggiunti termini aggiuntivi. Questi termini aggiuntivi devono essere descritti in Define-XML come termini estesi e non possono essere duplicati o sinonimi di termini esistenti.
Valore di invio, sinonimi e termine preferito
Il valore di invio è ciò che deve essere inviato a un regolatore. Il valore effettivamente visualizzato su un modulo può essere diverso, e forse uno dei sinonimi o il termine preferito.
Disponibile in molti colori
Gli standard terminologici NCI sono disponibili in diversi formati per soddisfare diverse esigenze, tra cui Excel, ODM, HTML e RDF. L’esempio sopra è tratto dalla versione di Excel.
Raggruppati in sottoinsiemi per CDASH, SDTM, ADaM e altri
Per comodità, la terminologia NCI è raggruppata in un certo numero di sottoinsiemi.
- SDTM terminologia contiene i termini per l’utilizzo in un SDTM a base di presentazione
- CDASH terminologia contiene i termini per l’utilizzo in CDASH a base di raccolta dati
- ADaM terminologia contiene i termini per l’utilizzo in Adamo set di dati
- INVIA terminologia contiene i termini per l’utilizzo in un SEND a base di presentazione
- Protocollo terminologia contiene i termini per l’utilizzo con il Modello di Rappresentazione del Protocollo (PRM) di Sperimentazione Clinica e di Registro XML (CTR-XML)
Utilizzando CDISC NCI Terminologia in uno studio
Quando si definisce la presentazione dei metadati nel Definire XML, liste di codici vengono utilizzati per definire fisso liste di valori per determinate variabili. Secondo l’attuale regolamento FDA, questi elenchi di codici devono essere conformi alla terminologia standardizzata CDISC NCI, dove tale terminologia esiste. Essi sono collegati alla terminologia standardizzata aggiungendo Alias C-codici, ad esempio:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
Quando si definisce la raccolta di dati metadati in ODM c’è alcun obbligo di utilizzare la terminologia standardizzata, tuttavia, in questo modo si elimina la necessità di una mappa di termini dai dati raccolti con i tuoi dati. Ciò semplifica enormemente il processo di studio end-to-end e aumenta la coerenza tra gli studi.
Gestione degli aggiornamenti
La gestione degli aggiornamenti terminologici può essere una notevole quantità di lavoro, in particolare con gli standard aggiornati così regolarmente. Come fai a sapere quali studi o standard organizzativi potrebbero essere influenzati dalla nuova terminologia? Come si fa quindi effettuare gli aggiornamenti richiesti in modo efficiente e affidabile?
Il modo più semplice per gestire questo è utilizzando un repository di metadati CDISC-aware che consente di definire standard organizzativi basati sulla terminologia standardizzata, e costruire i vostri studi da tali standard. Poiché il repository comprende le relazioni tra tutti gli standard e i tuoi studi, può semplificare il processo di aggiornamento alle nuove versioni degli standard terminologici CDISC NCI.
