Messaggio urgente: quando un paziente relativamente giovane si presenta a cure urgenti con dolore toracico, può esserci o meno una causa “tipica”. Una valutazione tempestiva e una valutazione accurata dei fattori di rischio sono essenziali per un’assistenza efficiente e, spesso, per la sopravvivenza del paziente.
Max Palatnik, MD
Presentazione del caso
Un maschio di 35 anni presentato alle 21:59 con una lamentela principale di dolore toracico; alle 22: 03, abbiamo notato quanto segue:
Temp: 98.9
Pulse: 103
Resp: 16
Syst: 122
Diast: 69
O2Sat: 99%
Storia della malattia attuale (22:47) (Testualmente)
Pt. maschio di 38 anni con un PMH di miocardite e pericardite nel 1983 e nel 1991, che ha cenato alle 6:30 e ha iniziato a sentire la pressione sul petto anteriore mentre guardava la TV alle 7:30 PM. – sembrava che “alcuni erano seduti sul mio petto”. Associato singhiozzo e radiazioni nella sua spalla e la mano sinistra “formicolio”. Ha avuto bruciore di stomaco, ma questo sembrava diverso. Ha preso il bicarbonato di sodio (che normalmente prende per il suo bruciore di stomaco) e questo non ha aiutato. Nessun sincope, nausea, vomito, febbre, dolore RUQ o storia di intolleranze alimentari. Ha avuto alcuni sintomi virali 2 settimane fa (tosse non produttiva, sinus HA e PND che si è risolto.) Non orthopnea, PND, relazione di dolore per l’esercizio, trauma toracico, pleuritic componente
Storia Medica/Valutazione
Farmaci, allergie comuni: Nessuna
PMH: Miocardite/Pericardite
PSH: Nessuno
SocHx: Non-fumatore
FamHx: Positivo per il CAD con 52 anni di parentela con MI, padre CABG: 53
Esame (22:52)
Generale: Ben-apparire; ben nutrita; in nessun apparente difficoltà.
Testa: normocefalica; atraumatica.
Occhi: PERLA; EOM intatto
ENT: TM normale; naso normale; nessuna rinorrea; La gola è rossa e lievi essudati.. Membrane mucose umide.
Collo: Elastico; non tendente; nessuna linfoadenopatia cervicale. Nessun segno meningeo
Cardiovascolare: normale S1, S2; nessun mormorio, strofina o galoppa. No riproducibile tenerezza della parete toracica
Respiratorio: Normale escursione al torace con la respirazione; respiro suoni chiari e uguali bilateralmente; senza sibili, rhonchi, o rantoli.
Addome: suoni intestinali normali; non disteso; non tendente; nessuna organomegalia palpabile.
Estremità: ROM normale in tutte e quattro le estremità; non tendente alla palpazione; gli impulsi distali sono normali e uguali.
Pelle: Normale per età e razza; caldo; asciutto; buon turgore; nessuna lesione apparente o essudato
Note di progresso (23: 12)
Ha ricevuto 2 aspirina per bambini e SL NTG con sollievo dal disagio toracico. Ha poi avuto 1 pollice di Nitropaste posto. Alle 00: 44 il suo dolore è tornato e il suo ECG è stato ripetuto. Gli è stato dato 15mg Maalox senza miglioramento poi ½ pollice più NTP che ha fatto alleviare il disagio.
Risultati
ECG 1: Onde T appiattite inferiori e in V2-V6.
ECG 2: Nessuna modifica
Labs
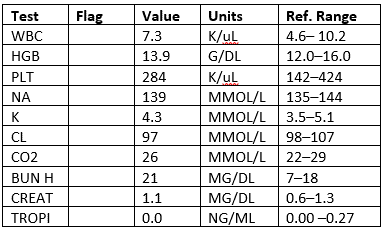
CXR: Negativo
Diagnosi (01:57)
Dolore toracico, storia di miocardite
Disposizione (02: 02)
Il paziente è stato ricoverato in ospedale in telemetria.
Corso ospedaliero
Pt. sottoposto a enzimi seriali e ripetere l’ECG al mattino. Ha escluso per MI ed è stato rilasciato. Una successiva ECO di stress era negativa dopo aver esercitato per 12,5 minuti senza disagio toracico o alterazioni dell’ECG.
Seconda visita
- Il paziente ha seguito il suo PCP, è stato diagnosticato con GERD ed è stato iniziato con un PPI.
- Il paziente è tornato alla DE 6 settimane dopo con senso di oppressione toracica e dispnea nel contesto di un pasto. I suoi sintomi sono stati peggiorati dallo sforzo, si verificano a riposo e sono migliorati dal posizionamento verticale e con Prilosec.
- Nessuna febbre associata, tosse, radiazioni, diaforesi, dolore al polpaccio, edema periferico.
- Il paziente ha segni vitali normali, con un esame insignificante e appropriato.
- ECG rivela TWI in aVL, così come nuove onde q in V1-V2 e NSST modifiche.
- CXR è negativo.
- I laboratori mostrano una troponina che è > 20 volte il limite superiore della norma.
- Il paziente riceve aspirina, eparina, Plavix, nitroglicerina ed è ammesso per sindrome coronarica acuta.
- Il paziente viene sottoposto a intervento coronarico percutaneo (PCI) con posizionamento dello stent di successo e successivamente viene scaricato in buone condizioni.
Discussione
Il dolore toracico è la denuncia di presentazione per oltre il 5% dei pazienti nei reparti di emergenza (EDs) negli Stati Uniti. La valutazione del paziente con dolore toracico è una sfida tremenda, in gran parte a causa dell’ampia diagnosi differenziale, ma anche a causa del rischio associato a diagnosi errate. Tra le condizioni più rapidamente fatali nella medicina d’urgenza—molte delle quali possono presentarsi inizialmente a cure urgenti—sono la sindrome coronarica acuta (ischemia miocardica e infarto), la dissezione aortica, l’embolia polmonare, la pericardite con tamponamento cardiaco, miocardite, pneumotorace da tensione e rottura esofagea. Tutte queste condizioni tendono a manifestarsi con dolore toracico, e tutti dovrebbero essere considerati all’inizio della valutazione del paziente con dolore toracico.
È responsabilità del medico valutare questi pazienti con l’elenco dei potenziali rischi per la vita in cima alla diagnosi differenziale. Una storia dettagliata, un esame fisico (con particolare attenzione agli esami cardiaci, polmonari e vascolari) e informazioni di test di base (ad esempio, elettrocardiogramma, radiografia del torace) possono spesso escludere rapidamente queste minacce di vita con ragionevole precisione. Tuttavia, nei casi in cui questa valutazione rapida iniziale non riesce a escludere una delle diagnosi mortali, ulteriore workup in un ambiente di maggiore acuità può essere giustificata.
Sebbene i sintomi tipici di ACS siano descritti come un inizio graduale di dolore o dolore di pressione nel petto con radiazione al braccio sinistro, al collo o alla mascella, in realtà l’atipico può essere più “tipico.”In una grande sintesi di dati, le caratteristiche storiche più utili che aumentavano la probabilità di infarto miocardico acuto erano le radiazioni al braccio o alla spalla destra, le radiazioni a entrambe le braccia, il dolore che peggiorava con lo sforzo, la diaforesi e la nausea o il vomito.1 Alcuni sottoinsiemi, tra cui donne, diabetici e anziani hanno maggiori probabilità di avere sintomi anginosi che sono rappresentati da dispnea, vomito, diaforesi, debolezza generalizzata; alcuni possono avere presentazioni indolori.2 Anche in quei pazienti con sintomi atipici come dolore pleuritico o dolorabilità palpabile nella parete toracica, la probabilità post-test è sufficientemente ridotta solo in coloro che sono già a basso rischio.1 L’enumerazione del carico storico del fattore di rischio cardiaco è di scarso valore prognostico, specialmente nei pazienti di età superiore ai 40 anni.3
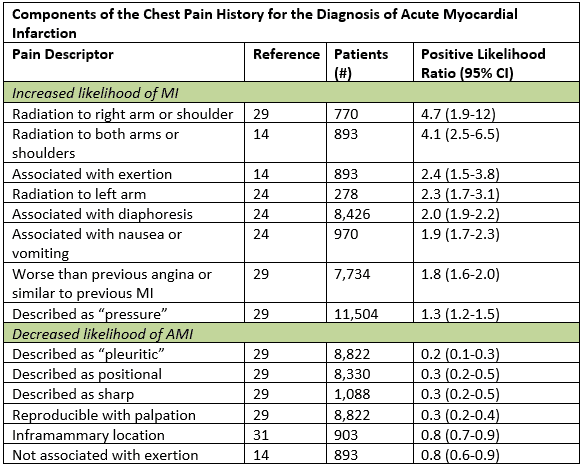
Adattato da Swap CJ, et al. JAMA. 2005;294:2623-2629.
I pazienti giovani (<45 anni) rappresentano un gruppo ad alto rischio di diagnosi errata di ACS, principalmente a causa della tendenza da parte dei medici a sottovalutare il rischio cardiaco. Fino al 10% degli infarti miocardici negli Stati Uniti si verificano in pazienti <di 45 anni, la maggior parte dei quali è correlata alla cardiopatia aterosclerotica. La malattia aterosclerotica è stata osservata nel 17% degli adolescenti in uno studio,4 e la malattia multivasale osservata nel 20% dei giovani adulti (età media: 26 anni) in uno studio autoptico sulle vittime della violenza urbana.5 Un recente studio ED ha rilevato che il 5,4% dei pazienti di 24─39 anni che presentavano dolore toracico ha governato per ACS e il 2,2% ha avuto un evento cardiaco avverso (cioè morte, infarto miocardico, necessità di intervento coronarico percutaneo o intervento di bypass cardiaco) entro 30 giorni.6 Sebbene l ‘incidenza complessiva di ACS sia più bassa nei pazienti giovani, i medici non devono scontare un HPI relativo esclusivamente in base all’ età del paziente.
Il diabete mellito (DM) rappresenta un’altra condizione ad alto rischio in termini di potenziale diagnosi errata di ACS. I pazienti con DM sono inclini a presentazioni indolori quando hanno ischemia cardiaca. Dispnea, confusione, vomito, affaticamento) si verificano fino al 40% dei casi. I pazienti diabetici hanno anche maggiori probabilità di avere esiti avversi da ACS.7 I medici curanti non devono quindi fare affidamento sui tipici disturbi che presentano per avviare un workup cardiaco nei pazienti diabetici, né dovrebbero fare affidamento su biomarcatori cardiaci positivi per indurre un approccio aggressivo al trattamento in questi pazienti.
L’uso di cocaina deve essere considerato un ulteriore fattore di rischio indipendente per la cardiopatia aterosclerotica e l’infarto miocardico, specialmente nei pazienti giovani. Alcuni autori stimano che la cocaina rappresenti fino al 25% della MIs acuta nei pazienti <45 anni.7 L’uso acuto di cocaina può indurre vasocostrizione coronarica, aumento dell’aggregazione piastrinica e/o stimolazione adrenergica che porta a disritmie e ischemia. L’uso cronico di cocaina è associato anche all’infarto miocardico, causando un’aterogenesi marcatamente accelerata e una successiva infarto miocardico precoce. Nel complesso, i consumatori di cocaina hanno un rischio di infarto miocardico aumentato di sette volte.8
Il lupus eritematoso sistemico (LES) è un fattore di rischio significativo ma sottovalutato per l’aterosclerosi precoce e l’infarto miocardico. Si stima che i pazienti giovani con LES abbiano un rischio aumentato di nove volte di infarto miocardico precoce.9 Donne < 45 anni, in particolare, sono a rischio aumentato, con stime di aumento del rischio di infarto miocardico precoce fino a cinquanta volte.10 La causa dell’aterosclerosi precoce nel LES è probabilmente multifattoriale, ma in gran parte correlata alla coesistenza di infiammazione sistemica e dislipidemie.
L’infezione da virus dell’immunodeficienza umana (HIV) è stata identificata come un fattore di rischio indipendente per l’aterosclerosi precoce. L’evidenza suggerisce che l’infezione da HIV provoca lesioni endoteliali ai vasi coronarici, avviando una cascata infiammatoria che porta a lesioni aterosclerotiche.11 La scoperta di aterosclerosi precoce è particolarmente importante nei pazienti con stadi successivi di infezione da HIV (conta CD4 <200).12 I regimi farmacologici attualmente utilizzati nel trattamento dell’HIV (inibitori della proteasi) esacerbano anche il rischio di aterosclerosi precoce. Nel complesso, i pazienti HIV con ACS presenti ad un’età che è più di 10 anni più giovane rispetto ai pazienti non HIV.13
La malattia renale cronica (CRD) è stata recentemente identificata come un fattore di rischio indipendente per l’aterosclerosi accelerata. La CRD è associata a infiammazione cronica14 e aumento dell’aggregazione piastrinica.15 Questi fattori, combinati con una maggiore prevalenza di fattori di rischio convenzionali concomitanti, producono un rischio sproporzionatamente elevato di eventi cardiaci in questi pazienti.14
Sebbene debba essere ottenuto e valutato entro 10 minuti dalla presentazione per quanto riguarda l’ischemia cardiaca, l’ECG non deve essere utilizzato per escludere ACS. Fino al 50% dei pazienti con ischemia cardiaca o infarto avrà un ECG non specifico o normale.16 ECG seriali possono aumentare la resa diagnostica a conferma della presenza di ACS in pazienti con sintomi in corso.
Proprio come l’ECG, i biomarcatori cardiaci sono utili quando sono positivi, ma hanno un’utilità limitata quando sono normali. Il test del biomarcatore seriale nel corso di 3─6 ore è diventato un protocollo di routine in molti EDs e ha un’eccellente sensibilità nel rilevare prove di MI. Tuttavia, i biomarcatori non possono essere fatti valere per escludere l’ischemia cardiaca. La convalida prospettica del punteggio” CUORE ” ha permesso ai professionisti la capacità di differenziare in modo affidabile un sottoinsieme di pazienti a basso rischio che probabilmente non trarrebbero beneficio da ulteriori test.17
Le prove di sforzo e l’angiografia coronarica sono usate più comunemente presto nella valutazione dei pazienti con dolore toracico per governare in ACS. Sebbene un test di stress negativo o un angiogramma sia associato a un minor rischio di CAD sottostante, nessuno dei due test può escludere definitivamente ACS o la presenza di trombosi coronarie sottostanti significative. La maggior parte delle modalità di stress test rileva l’evidenza di lesioni coronariche significative con sensibilità solo dall ‘ 85% al 95%.18-19 L’angiografia coronarica è anche un test imperfetto; false interpretazioni angiografia negativa non sono rari in presenza di malattia diffusa, placche eccentriche, occlusioni “a filo”, lesioni ostiali ramo, rami laterali sovrapposti, e anche quando le lesioni sono presenti all’interno dell’arteria coronaria principale sinistra.20 Ulteriori dati che compromettono l’affidabilità di questi test indicano che la maggior parte delle MIs si verificano da occlusioni all’interno delle arterie che erano precedentemente <50% ostruiti prima che si verificasse l’infarto.21-23
Questi tipi di lesioni sono solitamente associati a stress test negativi o angiogrammi “non significativi” se i test vengono eseguiti prima dell’infarto. Per la loro natura di rilevare la stenosi coronarica fissa, i test di stress non sono in grado di valutare o prevedere placche coronariche vulnerabili che sono a rischio di essere spostate, portando a un evento coronarico acuto. In uno studio su pazienti valutati per ACS che avevano uno stress test negativo nei precedenti 3 anni, oltre il 20% ha raggiunto l’indice composito di AMI, stress test positivo, CABG o cateterizzazione con intervento, con la stragrande maggioranza dei test negativi che si verificano entro 1 anno dalla presentazione.24 Allo stesso modo, su test ancora più invasivi uomini e donne con CAD normale o “minimo” sul cateterismo cardiaco (1,2% e 3,3%, rispettivamente) hanno avuto AMI o morte entro 1 anno dal follow-up.25 È fondamentale che il medico non faccia affidamento su un test obiettivo preliminare di fronte a un paziente con segni e sintomi indicativi di ACS.
Sommario
La valutazione del dolore toracico e possibili ACS è uno sforzo ad alto rischio. La decisione di perseguire un” workup cardiaco completo ” dovrebbe essere basata principalmente su un HPI completo. I medici devono essere consapevoli della frequenza delle presentazioni atipiche, specialmente nelle donne, negli anziani e nei pazienti diabetici. Anche i giovani pazienti meritano una considerazione speciale, poiché il loro rischio è spesso sottovalutato. Ulteriori fattori di rischio cardiaco non tradizionali, tra cui cocaina, lupus eritematoso sistemico, virus dell’immunodeficienza umana e malattia renale cronica meritano un’attenzione extra. Il test diagnostico consiste nell’elettrocardiografia (utile per governare in ACS, ma non per escludere la diagnosi) e nel test del biomarcatore cardiaco, che sono anche utili principalmente quando positivi. È importante sottolineare che lo stress test negativo o l’angiogramma è molto utile per stratificare i pazienti a un basso rischio di ACS e CAD, ma non escludono definitivamente la diagnosi.
Citazione: Palatnik M. Un uomo di 38 anni con dolore al petto. J Pronto soccorso Med. Marzo 2018. Disponibile all’indirizzo: https://www.jucm.com/a-38-year-old-man-with-chest-pain/.
- Scambia CJ, Nagurney JT. Valore e limitazioni della storia del dolore toracico nella valutazione di pazienti con sospette sindromi coronariche acute. JAMA. 2005;294:2623-2629.
- El-Menyar A, Zubaid M, Sulaiman K. Presentazione atipica della sindrome coronarica acuta: un significativo predittore indipendente della mortalità ospedaliera. J Cardiol. 2011;57;165-171.
- Han JH, Lindsell CJ, Storrow AB, et al. Il ruolo del carico del fattore di rischio cardiaco nella diagnosi delle sindromi coronariche acute nell’impostazione del pronto soccorso. Ann Emerg Med. 2007;49;145-152.
- Tuzcu EM, Kapadia SR, Tutar E, et al. Alta prevalenza di aterosclerosi coronarica in adolescenti asintomatici e giovani adulti: evidenza da ecografia intravascolare. Circolazione. 2001;103:2705-2710.
- Joseph A, Ackerman D, Talley JD, et al. Manifestazioni di aterosclerosi coronarica nelle giovani vittime di traumi-uno studio autoptico. J Am Coll Cardiol. 1993;222:459-467.
- Marsan RJ Jr., Shaver KJ, Sease KL, et al. Valutazione di una regola di decisione clinica per i pazienti giovani adulti con dolore toracico. Acad Emerg Med. 2005;12:26-32.
- Fergus TS, Fazel R, Fang J, et al. Presentazione, gestione e risultati dei pazienti diabetici rispetto ai pazienti non diabetici ricoverati per sindromi coronariche acute. Cuore. 2004;90:1051-1052.
- Qureshi AI, Suri MF, Guterman LR, et al. Consumo di cocaina e probabilità di infarto miocardico non fatale e ictus: dati del terzo sondaggio nazionale sulla salute e la nutrizione. Circolazione. 2001;103:502-506.
- D’Agata DJ, Kokolis S, Belilos E, et al. Malattia coronarica prematura nel lupus eritematoso sistemico con ampia reocclusione a seguito di intervento chirurgico di bypass coronarico. J Cardiolo invasivo. 2003;15:157-163.
- Manzi S, Meilahn EN, Rairie JE, et al. Tassi di incidenza specifici per età di infarto miocardico e angina nelle donne con lupus eritematoso sistemico: confronto con lo studio Framingham. Am J Epidemiol. 1997;145:408-415.
- Varriale P, Saravi G, Hernandez E, et al. Infarto miocardico acuto in pazienti infetti da virus dell’immunodeficienza umana. Am Cuore J. 2004;147: 55-59.
- Hsue PY, Lo JC, Franklin A, et al. Progressione di aterosclerosi come valutato dallo spessore intima-media carotidea in pazienti con infezione da HIV. Circolazione. 2004;109:1603-1608.
- Hsue PY, Giri K, Erickson S, et al. Caratteristiche cliniche delle sindromi coronariche acute in pazienti con infezione da virus dell’immunodeficienza umana. Circolazione. 2004;109:316-319.
- Yerkey MW, Kernis SJ, Franklin BA, et al. Disfunzione renale e accelerazione della malattia coronarica. Cuore. 2004;90:961-966.
- Aggarwal A, Kabbani SS, Rimmer JM, et al. Effetti bifasici dell’emodialisi sulla reattività piastrinica in pazienti con malattia renale allo stadio terminale: un potenziale contributo al rischio cardiovascolare. Am J Rene Dis. 2002;40:315-322.
- Brady WJ, Aufderheide TP, Chan T, et al. Diagnosi elettrocardiografica di infarto miocardico acuto. Emerg Med Clin Nord Am. 2001;19:295-320.
- Backus BE, Six AJ, Kelder JC, et al. Una convalida prospettica del punteggio cardiaco per i pazienti con dolore toracico presso il pronto soccorso. Int J Cardiologia. 2013;168;2153-2158.
- Ioannidis JPA, Salem D, Chew PW, et al. Accuratezza delle tecnologie di imaging nella diagnosi di ischemia cardiaca acuta nel pronto soccorso: una meta-analisi. Ann Emerg Med. 2001;37:471-477.
- Lateef F, Gibler WB. Test provocatori per il dolore toracico. Am J Emerg Med. 2000;18:793-801.
- Schwartz L, Gourassa MG. Valutazione di pazienti con dolore toracico e angiogrammi coronarici normali. Arch Int Med. 2001;161:1825-1833.
- Giroud D, Li JM, Urban P, et al. Relazione del sito di infarto miocardico acuto alla stenosi arteriosa coronarica più grave all’angiografia precedente. Sono J Cardiol. 1992;69:729-732.
- Hackett D, Davies G, Maseri A. Le stenosi coronariche preesistenti in pazienti con primo infarto miocardico non sono necessariamente gravi. Eur Cuore J. 1988;9: 1317-23.
- Hackett D, Verwilghen J, Davies G, et al. Stenosi coronariche prima e dopo infarto miocardico acuto. Sono J Cardiol. 1989;63:1517-1518.
- Walker J, Galuska M, Vega D. Malattia coronarica nei pazienti con dolore toracico del pronto soccorso con recenti test di stress negativi. West J Emerg Med. 2010;11;384-388.
- Hemingway H, McCallum A, Shipley M, et al. JAMA 2006; 295; 1404-1411.
