l’Introduzione di inibitore del ciclo cellulare
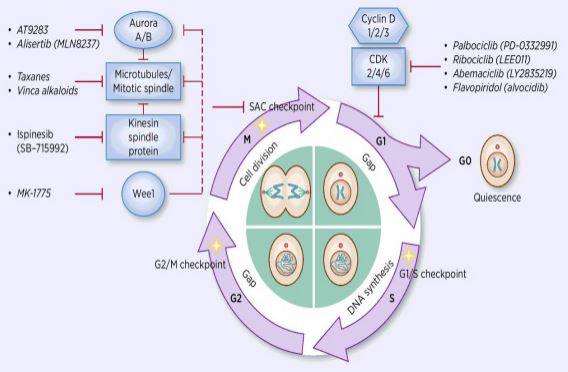
Il processo di regolazione del ciclo cellulare è l’attivazione o l’inattivazione di vari fattori normativi sotto la sorveglianza di checkpoint, avviando il processo di cellulare e la replicazione del DNA e la divisione in due cellule figlie. Tra molti regolatori del ciclo cellulare, chinasi ciclina-dipendente (CDK) è al centro, ed è un sistema di rete che regola il ciclo cellulare con inibitori della chinasi ciclina e ciclina-dipendente (CKIS). I CDK sono una classe di serina/treonina chinasi e attualmente si trovano 13 specie, tra cui CDK1 ~ 13, che svolgono un ruolo nella regolazione del ciclo cellulare dei CDK e nella regolazione trascrizionale dei CDK. La regolazione del ciclo cellulare è, infatti, la regolazione dei checkpoint, con i punti regolatori G1/S che sono i più importanti. Quando il ciclo cellulare viene stimolato da segnali esterni come fattori di crescita, la subunità catalitica CDK4/CDK6 si lega alla subunità regolatrice CyclinD e i residui di CDKS vengono attivati dalla fosforilazione/defosforilazione. Dopo l’attivazione dei CDK, la proteina Rb viene fosforilata. Il gene rb, noto anche come gene del retinoblastoma, è il primo gene soppressore del tumore clonato e la sua capacità di formare un complesso con fattori di trascrizione (come E2F) dopo la fosforilazione della proteina viene persa. E2F svolge un ruolo importante nella regolazione del ciclo cellulare e induce l’espressione di CiclinA e CDK2 e forma un complesso CiclinA / CDK2, che fosforila ulteriormente la proteina Rb e rilascia completamente E2F. Successivamente, E2F entra nel nucleo per attivare una serie di cicli cellulari in fase S. Nella fase tardiva della replicazione del DNA durante la fase S, CDK2 viene attivato dalla ciclinA, che inattiva il fattore di trascrizione E2F nel tempo, prevenendo l’apoptosi causata da E2F persistentemente attivato. Le statistiche di ricerca mostrano che oltre il 90% dei tumori umani ha mutazioni nei geni correlati nelle vie CDK, Ciclina, CKI e Rb, con CDK e la sua subunità regolatrice corrispondente Ciclina che è la più frequentemente disfunzionale. Inoltre, le fluttuazioni nel ciclo cellulare promuovono la resistenza alla chemioterapia e riducono gli effetti della chemioterapia. Pertanto, la regolazione dell’attività CDK/Ciclina, che ripristina il normale ciclo cellulare, è una delle strategie per il trattamento dei tumori.
Gli inibitori del ciclo cellulare sono ora utilizzati clinicamente
I ricercatori di farmaci si sono concentrati sulla ricerca di diversi tipi di CDK e inibitori della ciclina come farmaci anti-cancro all’avanguardia. Attualmente, gli inibitori CDK sono principalmente divisi in endogeni ed esogeni. La più grande classe di piccoli inibitori endogeni della molecola è proteine a basso peso molecolare, che sono classificate in due grandi categorie secondo le differenze nelle funzioni strutturali e una classe è chiamata la famiglia specifica doppia INK4, compreso p15, p16, p18, p19, che inibisce la famiglia della proteina. La proteina inibitoria-dipendente della chinasi associata a CiclinD si lega al corrispondente CDK4 libero, bloccando così il legame di CDK4 al ciclinD corrispondente per formare un complesso di dimeri catalitici. L’altra classe è chiamata famiglia Kip, tra cui P21, P27,P57. Questa famiglia proteica può formare un trimero con un complesso dimerico composto da ciclina E / CDK2 e ciclinA / CDK1, bloccando il centro cataliticamente attivo del dimero. L’inibizione di questi inibitori endogeni, quando combinata con il complesso chinasico, regola specificamente la sua attività, regolando così con precisione la trasformazione della cellula dalla fase G1 a S. Gli studi hanno dimostrato che l’insorgenza e lo sviluppo di tumori multipli sono associati a una diminuzione dell’espressione di CDK/cicline o a una diminuzione dell’espressione di inibitori endogeni, come la delezione di P16, che ha una relazione con lo sviluppo di melanoma, cancro ai polmoni, cancro al seno e cancro del colon-retto. La cancellazione della proteina P27 è comune nel cancro al seno, nel cancro alla prostata, nel cancro del colon e nel cancro gastrointestinale. Pertanto, la cancellazione dell’inibitore CDKS endogeno o della mutazione genica è un riferimento importante per la diagnosi del tumore. Gli inibitori endogeni di piccole molecole sono anche una classe di importanti RNA non codificanti scoperti negli ultimi anni. Le regioni del sito bersaglio si legano l’una all’altra per degradare rapidamente ed efficacemente l’mRNA o inibire la traduzione della proteina, controllando la proteina a un livello inferiore o ottimale e richiedendo attività vitali. Sono stati scoperti più di 10 microRNA coinvolti nella regolazione del ciclo cellulare. Tra questi, miR1-2 e miR3-4 target CDK4, rispettivamente, e il ciclo cellulare viene arrestato nella fase G1, che inibisce la proliferazione delle cellule tumorali; MIR-22 mira alle cellule CDK6. Il ciclo è stagnante nella fase G1, che induce la senescenza nelle cellule del cancro al seno. In diversi processi biologici, questi miRNA regolano la progressione del ciclo cellulare mirando a E2F, CDK, Ciclina, P21, P27, DNA polimerasi alfa, ecc. promuovere o bloccare i regolatori chiave del ciclo cellulare. Gli inibitori esogeni includono acidi nucleici antisenso, anticorpi, piccole interferenze di RNA interferenti (siRNA) e composti di piccole molecole. I composti di piccole molecole sono la classe più importante di inibitori esogeni di CDK. Negli ultimi anni, poiché la comprensione della struttura cristallina consente alle persone di condurre studi di simulazione molecolare, sono state fatte scoperte nella progettazione e nello sviluppo di studi altamente efficienti e selettivi sugli inibitori chimici dei CDK. Si può dire che tali composti hanno nuovi membri ogni giorno. Attualmente, piccole molecole inibitori CDK possono essere suddivise in 13 categorie, Roscovitine e Olomouc, Pirimidine (PD-033299), Flavonoidi (Flavopiridols), Thiazoles (SNS03), antracene e i suoi derivati (SU951), piperidone (Paullones), imidazopyridine, pyrazolopyridine (AZ703), pyrazines ( AT751), butirrolattone-1 (butirrolattone-1), scorpionine (UCN-01) e altre due specie. Tredici inibitori di piccole molecole sono entrati in studi clinici. Sono tutti prodotti chimici a piccola molecola di eterocicli planari che competono con l’ATP per il legame al sito di legame ATP della chinasi CDK. Gli esperimenti in vivo hanno dimostrato che CYC202 ha una buona resistenza ai farmaci e una buona attività fisiologica orale e ha evidenti effetti inibitori sui tumori solidi nei topi nudi inoculati dal cancro del colon umano e dalle cellule tumorali uterine. Negli studi di fase Ib, 10 pazienti con tumori ovarici stavano assumendo CYC per più di 20 mesi, senza aumento di tumori o gravi effetti collaterali correlati al trattamento, tra i quali il tumore di un paziente si è ridotto di oltre il 30% e alcuni pazienti che sono stati trattati per più di un anno hanno una condizione stabile. Studi clinici di fase II hanno scoperto che CYC202 da solo ha un effetto leggermente più povero ed è efficace in combinazione con altri farmaci chemioterapici. Sono in corso anche studi clinici di fase IIb su CYC202 in combinazione con capecitabina per il trattamento del cancro al seno, in combinazione con 2,2-difluorodeossicitidina o cisplatino per il trattamento del cancro del polmone e del carcinoma nasofaringeo. Lo sviluppo e l’applicazione della tecnologia di interferenza dell’RNA a piccole molecole hanno permesso di studiare l’espressione genica di specifiche molecole target di intervento e molti scienziati hanno iniziato a intervenire nella sintesi di CDK/Ciclina a livello genetico. Limaet al. transfected CyclinE-targeting siRNA in Hep3B, HepG2, SNU449 (sovraespressione della ciclina) e HuH7 (sovraespressione della ciclina) e ha scoperto che l’espressione della ciclina è stata ridotta del 90% nelle cellule. La sintesi del DNA è significativamente ridotta e le cellule subiscono apoptosi. Galimberti et al. transfected siRNA targeting CiclinA, CDK2, e CDK1 in cellule tumorali del polmone del mouse HOP-62, H-522 e H-23, rispettivamente, e ha scoperto che CiclinA/CDK2 può indurre apoptosi e inibire la proliferazione delle cellule tumorali del polmone. La diminuzione dell’espressione CDK1 causata dall’interferenza siRNA CDK1 causa solo l’arresto della fase cellulare e rallenta la proliferazione cellulare; mentre la co-interferenza siRNA CDK1 e CDK2 porta a una diminuzione simultanea dell’espressione CDK1 e CDK2, causando resistenza nelle fasi del ciclo cellulare S e G2/M. La stagnazione ha anche indotto l’apoptosi delle cellule. Cao Yinfang e altre trasfezioni di successo del vettore di espressione ricombinante siRNA CDK2/CiclinA nelle cellule HepG2 hanno mostrato che l’espressione di mRNA CDK2 e CiclinA è diminuita significativamente, il ciclo cellulare è stato arrestato in fase S, le cellule di fase G1 sono aumentate in modo significativo, l’attività della caspasi-3 migliorata, le cellule HepG2
Funzione dell’inibitore del ciclo cellulare
Con l’approfondimento della comprensione dell’importante ruolo della regolazione del ciclo cellulare nella formazione del tumore e nell’apoptosi, la regolazione del ciclo cellulare è stata ulteriormente studiata nella resistenza alla chemioterapia tumorale. Le chinasi ciclina-dipendenti (CDK), che svolgono un ruolo nella guida del motore cellulare durante il ciclo cellulare, sono obiettivi ideali per la terapia tumorale. La maggior parte delle cellule tumorali ha attivazione, sovraespressione del gene del ciclo di divisione cellulare (cdk) e difetti nella funzione CDKIs. L’inibitore CDK esercita un’azione di rottura che inibisce il ciclo cellulare. Negli ultimi anni, i CDKIS sono diventati un punto culminante importante della terapia del cancro, che inibisce l’attività dei CDK nel ciclo cellulare. Una serie di studi clinici hanno anche dimostrato che una singola applicazione può avere effetti moderati. Tuttavia, in combinazione con i tradizionali farmaci chemioterapici citotossici, CDKIs può migliorare significativamente l’effetto antitumorale dei farmaci chemioterapici tradizionali. Pertanto, la ricerca sugli effetti antitumorali dei farmaci CDKIs e di altri farmaci chemioterapici è diventata un punto caldo nell’attuale trattamento della resistenza tumorale.
Reference
- Bendris N, Lemmers B, Blanchard J M. Cell cycle, citoscheletro dynamics and beyond: the many functions of cyclins and CDK inhibitors. Ciclo cellulare. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. Targeting delle chinasi nucleari nel cancro: sviluppo di inibitori della chinasi del ciclo cellulare. Farmacologia& Terapie. 2014, 142(2):258-269.
- Stone A, Sutherland R L, Musgrove E A. Inibitori delle chinasi del ciclo cellulare: recenti progressi e prospettive future come terapia oncologica. Crit Rev Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. Regolazione del ciclo cellulare e melanoma. Rapporti oncologici attuali. 2016, 18(6):34.
- Malumbres M, Barbacid M. Ciclo cellulare, CDKS e cancro: un paradigma che cambia. Natura Recensioni Cancro. 2009, 9(3):153-166.
