Qual è la densità delle cellule?
Modalità lettore
La densità del materiale biologico è responsabile della sedimentazione delle cellule sul fondo dei nostri tubi da laboratorio e piastre multi-pozzo e serve come base della centrifugazione di routine che fa parte della vita quotidiana di tanti biologi. Queste stesse differenze di densità tra le cellule e il loro esterno acquoso sono anche la base del contrasto che osserviamo nelle immagini di microscopia di fase. Queste differenze sono importanti anche al di fuori dell’impostazione di laboratorio. Ad esempio, il plancton deve fare i conti con questa differenza di densità per rimanere a una profondità nell’oceano dove la luce del sole è abbondante piuttosto che affondare nelle profondità annerite. Dato che la maggior parte dei biologi e biochimici fanno uso della separazione basata sulla densità su base giornaliera sembra sorprendente quanto raramente densità come quelle raccolte nella Tabella 1 siano effettivamente discusse.
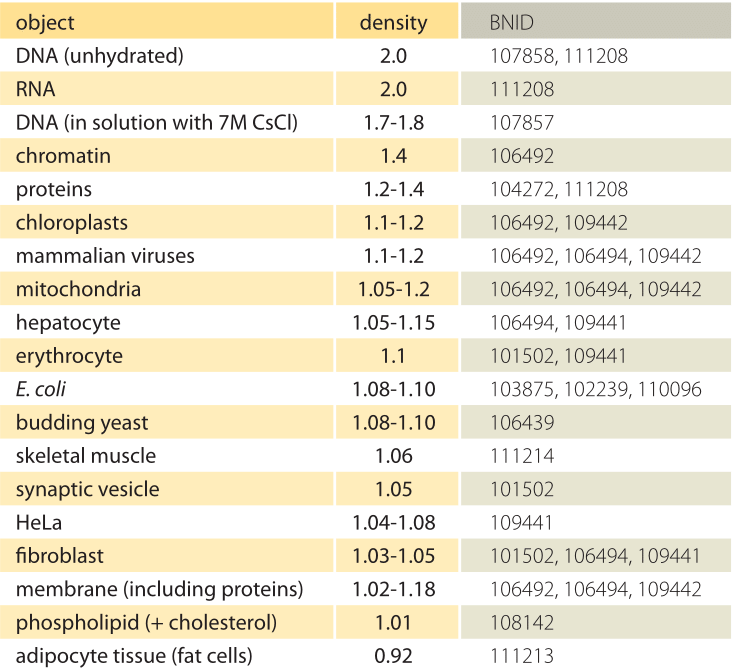
Tabella 1: Densità di oggetti biologici rispetto all’acqua. Questo è quasi equivalente a dare loro in unità di g / ml o 1000 kg / m3. I valori sono ordinati in ordine decrescente. Salvo indicazione contraria, i valori sono stati misurati in soluzione di saccarosio o ficoll.
Qual è la base di base per le diverse densità di diversi organelli e tipi di cellule? In larga misura queste differenze possono essere attribuite al rapporto tra contenuto di acqua e massa secca. Le proteine hanno una densità di ≈1,3-1,4 (BNID 104272, 101502) rispetto all’acqua (o quasi equivalentemente in unità di g/ml o 1000 kg/m3). Dato il valore di riferimento di 1 per la densità dell’acqua, uno spettro di valori intermedi per la densità delle cellule tra 1 e 1.3 sono ottenuti in base all’abbondanza relativa di proteine e acqua. I lipidi sono all’estremità bassa vicino all’acqua ad una densità di circa 1 (BNID 108142). All’altro estremo, i granuli di amido con una densità di ≈1,5 (BNID 103206) e i nucleotidi a ≈1,7 possono spostare il bilancio di massa complessivo nella direzione opposta.
Conoscere la densità si basa spesso sulla posizione in cui un dato componente biologico si deposita quando viene filato in una centrifuga contenente un gradiente di concentrazioni spesso prodotto dal saccarosio o, nel caso del DNA, dal cloruro di cesio. La densità riflette la massa divisa per il volume, ma per i composti caricati in soluzione la densità è influenzata anche dai gusci della cosiddetta acqua legata. La densità in questo caso diventa una densità effettiva, ridotta dall’acqua legata, e quindi in qualche modo dipendente dalla concentrazione di sale (BNID 107858).
La velocità di sedimentazione, come avviene in una centrifuga, è quantificata in unità di Svedberg che è l’origine dei nomi 70S, 23S ecc. per il ribosoma e le sue subunità rRNA. Un rRNA 23S sedimenterà ad una velocità di 23×10-12 m/s sotto gravità normale. In un ultracentrifugo che produce un’accelerazione di un milione di g la velocità sarà proporzionalmente scala a 23×10-6 m/s o circa 1 mm / min. La velocità di sedimentazione dipende dalla densità, dalle dimensioni e dalla forma della molecola. Per forme e densità simili la velocità di sedimentazione scala come radice quadrata della massa molecolare. Per tali casi la massa molecolare va come il quadrato della velocità di sedimentazione, tale che le subunità 23S e 16S del ribosoma hanno una massa molecolare con un rapporto di circa (23/16) 2 o circa 2 che è strettamente in linea con le misure di 0,9 e 0.5 MDa rispettivamente (BNID 110972, 110967). Nella clinica, il tasso di sedimentazione degli eritrociti (globuli rossi) viene regolarmente utilizzato per misurare l’infiammazione. Tassi molto superiori a 10 mm / ora di solito indicano la presenza del fattore pro-sedimentazione fibrinogeno che è un indicatore generale di una condizione infiammatoria.
È ben noto che l’acqua è la frazione molecolare più abbondante di cellule, ma quanto abbondante esattamente? Se esaminiamo i tessuti da organismi multicellulari, trovare il contenuto di acqua è un semplice compito di misurare la massa del tessuto prima e dopo l’essiccazione. Ma come si possono eseguire tali misurazioni per le cellule? Quando pesiamo una massa di cellule prima e dopo l’essiccazione come misuriamo solo le cellule senza acqua intorno a loro? Anche dopo la centrifugazione c’è acqua lasciata nel pellet cellulare con conseguente ambiguità circa la massa secca stessa.
Ancora una volta l’etichettatura radio-isotopica viene in soccorso (Cayley et al 1991). In primo luogo, l’acqua etichettata (usando trizio, 3H) viene misurata in un pellet cellulare. Questo indica la somma di acqua all’interno e all’esterno delle cellule. Quindi, un altro composto solubile etichettato ma che non può entrare nella cellula, come 14C-inulina o 3H-PEG, misura il volume di acqua all’esterno delle cellule in un pellet centrifugato (ad esempio, in E. coli circa il 25-35% del volume del pellet (BNID)). La differenza indica il contenuto di acqua all’interno delle cellule. Tali metodi portano a valori tipici che vanno da ≈60-65% in massa per lievito in erba e globuli rossi a ≈70% per E. coli e l’ameba D. discoideum e fino a ≈80% per i tessuti muscolari del ratto e del cuore del maiale (BNID 105938, 103689). Poiché il contributo della materia secca è dominato da costituenti di densità ≈1.3 (cioè proteine), ciò porta alla densità complessiva caratteristica di ≈1.1 (BNID 103875, 106439, 101502). Da queste frazioni caratteristiche si può dedurre che la massa secca per volume sia di circa 300-500 mg / ml (BNID 108131, 108135, 108136), ma durante la crescita lenta i valori possono essere più alti. Le basse densità sono comuni nei semi secchi e nelle piante subacquee che hanno parti galleggianti con densità inferiori all’acqua circostante, consentendo loro di galleggiare. Densità inferiori a quella dell’acqua possono essere raggiunte sia da gas come in alghe e alcuni batteri o utilizzando soluti di peso molecolare (MW) inferiore al mezzo circostante (ad esempio sostituendo il sodio con MW≈23 con ammonio con MW≈18) come nei piccoli crostacei, copepodi antartici.
Gli esseri umani sono fatti di circa il 60% di acqua (40% nelle cellule, 15% nel liquido interstiziale e 5% nel plasma sanguigno, BNID 110743) e la maggior parte di noi ha sperimentato i forti effetti della disidratazione dopo aver dimenticato di bere anche solo pochi bicchieri. Eppure, alcune cellule possono essere sorprendentemente robusto per una diminuzione del loro contenuto di acqua. Ad esempio, il tasso di metabolismo del glucosio nelle cellule epatiche di ratto non è stato influenzato dalla perdita del 25% di acqua intracellulare. Tale diminuzione può essere raggiunta per osmosi-cambiando la tonicità (concentrazione di soluto) del fluido extracellulare. Un esempio estremo è quello del notevole gambero di salamoia. Vivendo in ambienti in cui la concentrazione salina esterna può fluttuare ed essere molto alta, è stato dimostrato di avere cisti che possono essere essiccate a solo il 2% di acqua senza danni irreversibili e a livelli di idratazione superiori al 37% (solo circa la metà del suo stato completamente idratato) la loro fisiologia si comporta normalmente. Questa robustezza di fronte alla perdita di acqua potrebbe essere correlata a una distinzione a volte fatta tra due forme di acqua all’interno della cella. Normale ” acqua alla rinfusa “che sono più dispensabili e” acqua legata ” che è associata ai componenti cellulari e serve come solvente essenziale per il corretto funzionamento.





