Breve descrizione di due tipi di morte cellulare programmata: apoptosi e autofagia
L’apoptosi, o morte cellulare programmata di tipo I, è la più studiata delle forme di morte cellulare. Le sue caratteristiche morfologiche possono essere identificate sotto microscopia ottica e comprendono il restringimento cellulare, la compattazione della cromatina, il blebbing della membrana citoplasmatica e, infine, la formazione di corpi apoptotici (Figura 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
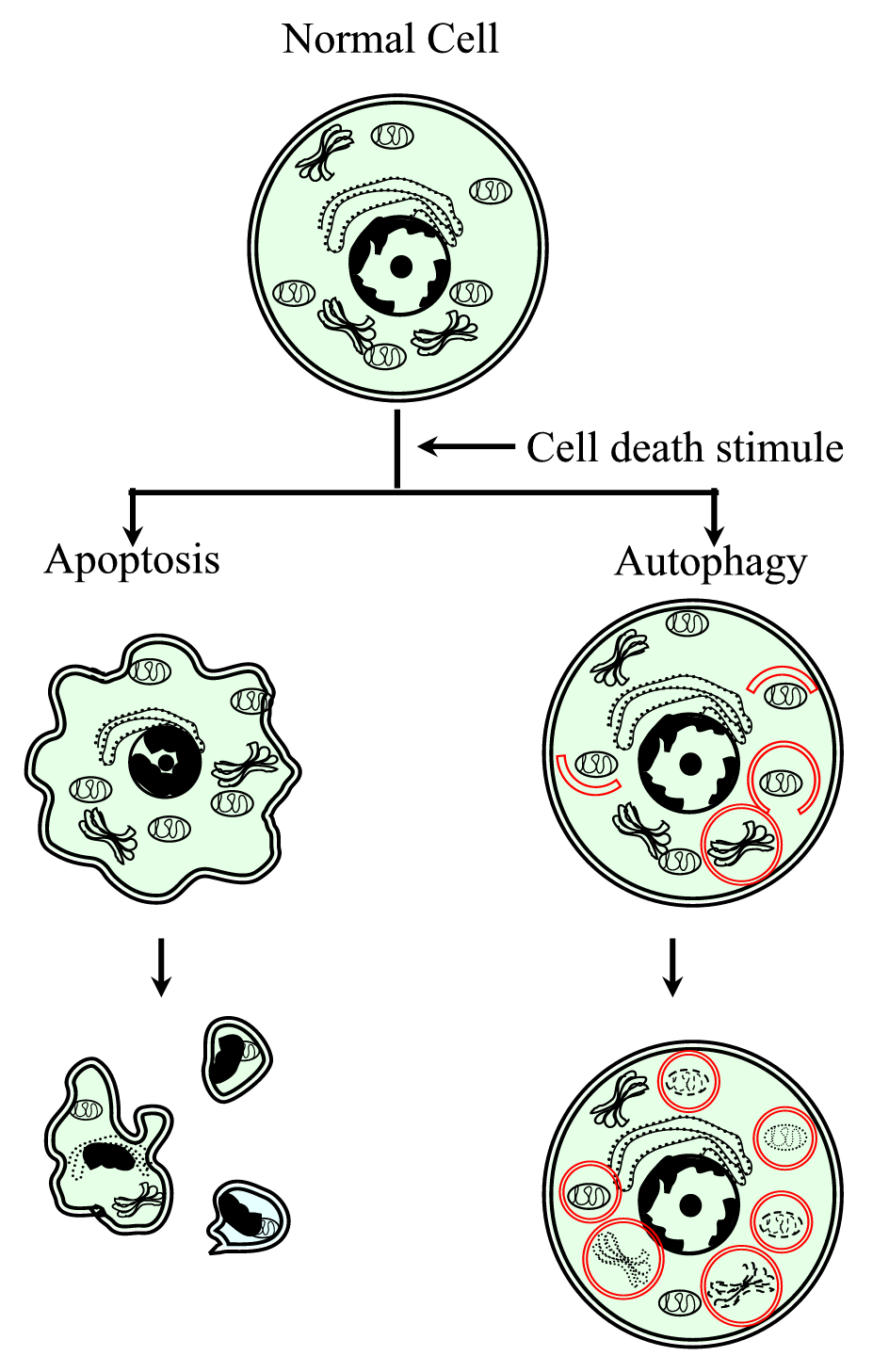
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRappresentazione schematica del processo di morte cellulare programmato di tipo I (apoptosi) e di tipo II (autofagia). L’apoptosi è caratterizzata da una contrazione cellulare, compattazione della cromatina, bleb membranosi e formazione di corpi apoptotici. L’autofagia è caratterizzata dalla presenza di un gran numero di autofagosomi con contenuto citoplasmatico. Entrambi i tipi di morte cellulare non generano una risposta infiammatoria poiché la membrana citoplasmatica viene conservata fino a quando i detriti cellulari non vengono eliminati dal vicinato o da quelli specializzati.
Le caspasi sono proteasi specifiche del cisteinil-aspartato che vengono sintetizzate in una forma inattiva come zimogeni chiamati pro-caspasi (Figura 2). È questa forma inattiva che consente l’esecuzione controllata del processo di morte cellulare. Le caspasi sono state identificate per la prima volta nel nematode Ceanorhabditis elegans, ma forme omologhe sono presenti nei mammiferi .
Le caratteristiche dell’apoptosi, come la frammentazione del DNA e la cromatina compattata, derivano dall’attività della caspasi. Durante l’apoptosi, il DNA è frammentato in dimensioni del nucleosoma (200 bp) . Il fattore responsabile della frammentazione del DNA durante l’apoptosi è una DNasi specifica (CAD, DNasi attivata dalla caspasi) che viene attivata dalla caspasi-3 attiva . La caspasi-3 attiva, a sua volta, è coinvolta nei cambiamenti morfologici delle cellule durante l’apoptosi, dove scinde la chinasi-1 rho-associata (ROCK-1) per attivarla e questo, infine, influenza la disposizione citoscheletrica causando la morfologia del restringimento apoptotico .

Figura 2.
xmln:xlink = “http://www.w3.org/1999/xlink ” xmln:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceLe caspasi coinvolte nel processo apoptotico sono sintetizzate in una forma inattiva come zimogeni, sono costituite da un pro-dominio, una grande subunità e una piccola subunità. Gli zimogeni vengono attivati formando tetrameri.
La morte delle cellule apoptotiche è altamente regolata dai membri della famiglia del linfoma a cellule B 2 (Bcl-2). I membri della famiglia Bcl-2 sono stati classificati come proteine anti-apoptotiche e pro-apoptotiche in base alla loro omologia Bcl-2 (BH) e all’organizzazione del dominio (Figura 3). La presenza di domini BH1, BH2, BH3 e BH4 corrisponde al gruppo che inibisce l’apoptosi. Il gruppo pro-apoptotico, al contrario, è diviso in due gruppi: quelli con domini BH1, BH2 e BH3 e quelli con solo i domini BH3 (definiti solo come BH3; vedere la recensione in ). Questa famiglia di proteine svolge le sue funzioni a livello intracellulare all’interno dei mitocondri, un elemento chiave nell’apoptosi.

Figura 3.
xmlns: xlink=” http://www.w3.org/1999/xlink ” xmlns: mml=” http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceProteine della famiglia del linfoma a cellule B 2 (Bcl-2). A) Schematizzazione generale della struttura delle proteine Bcl-2. B) I membri anti-apoptotici-possiedono tutti e quattro i domini BH. C) I membri pro-apoptotici che a loro volta sono divisi in due gruppi: solo multidominio e BH3.
L’apoptosi può essere avviata da due vie ben descritte: le vie estrinseche e intrinseche (Figura 4). L’attivazione estrinseca è condotta attraverso la partecipazione di ligandi di morte (come il fattore di necrosi tumorale – TNF – superfamiglia e ligandi indotti da apoptosi correlati al TNF, o TRAIL) con i loro recettori di morte della superficie cellulare affini (come il recettore TNF 1, Fas, il recettore TRAIL 1 o il recettore TRAIL 2) (recensito in ). Una volta che il ligando riconosce e si lega al suo recettore, si formano una serie di complessi intracellulari per attivare le caspasi iniziatrici (come -8 e -10), che poi attivano le caspasi boia (come -3, -6 e -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. L’interazione ligando–recettore induce l’assemblaggio del complesso di segnalazione che induce la morte (DISCO) per promuovere l’attivazione della caspasi-8, che a sua volta è in grado di attivare l’esecutore caspasi -3, -6 o -7, conducendo ai cambiamenti morfologici dell’apoptosi. La via intrinseca è diretta dalla permeabilizzazione della membrana esterna mitocondriale, che consente il rilascio di elementi pro-apoptotici come citocromo-C. Il citocromo-C induce l’apoptosi proteasi-attivando il fattore 1 (Apaf-1) per promuovere l’attivazione di caspasi-9 per assemblare l’apoptosoma. L’apoptosoma è in grado di attivare l’esecutore caspasi.
La via apoptotica intrinseca, al contrario, può essere attivata da vari stimoli, tra cui il danno al DNA, la fame del fattore di crescita e lo stress ossidativo . Durante l’esposizione delle cellule a questi stimoli, i mitocondri sono interessati, poiché diversi membri della famiglia Bcl-2 sono attivati e promuovono la permeabilizzazione della membrana esterna dei mitocondri (MOMP). La membrana esterna permeata dei mitocondri consente il rilascio del citocromo c (cyt c), che è associato alla proteina Apaf-1. L’unione cyt c e Apaf-1 si lega quindi all’iniziatore caspasi-9 per formare il complesso che costituisce l’apoptosoma, che ha la capacità di attivare le caspasi iniziatrici che svolgono le loro funzioni scindendo specifici substrati cellulari.
Il secondo processo di morte cellulare, l’autofagia, è un processo geneticamente programmato ed evolutivamente conservato che produce la degradazione di organelli e proteine obsoleti. È attivato da tali stimoli extracellulari come fame di nutrienti, ipossia, alta temperatura e condizioni intracellulari alterate, incluso l’accumulo di organelli danneggiati o superflui (rivisto in ).
Negli organismi eucariotici sono stati descritti tre tipi di autofagia: microautofagia, macroautofagia (comunemente chiamata semplicemente autofagia) e autofagia mediata da chaperone (Figura 5). La microautofagia comporta l’inghiottimento di componenti citoplasmatici direttamente a livello del lisosoma mediante un processo di invaginazione, mentre la macroautofagia comporta la formazione di vescicole a doppia membrana che contengono componenti cellulari, che si fondono con i lisosomi per formare un autofagolisosoma. È all’interno dell’autofagolisosoma che i componenti intra-vescicolari vengono degradati e, se possibile, riciclati dalla cellula (riesaminati ). L’autofagia mediata da chaperone, infine, comporta la partecipazione degli chaperoni nel riconoscere le proteine designate per l’eliminazione dai lisosomi .

Figura 5.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instancerappresentazioni Schematiche dei diversi meccanismi di autophagy. La macroautofagia – autofagia-implica la formazione di una vescicola a doppia membrana, che inghiotte il contenuto citoplasmatico che verrà condotto al lisosoma per essere degradato. La microautofagia è caratterizzata dall’inghiottimento diretto di componenti citoplasmatici da parte del lisosoma. Questo processo comporta il rimodellamento della membrana dell’organello formando un’invaginazione della membrana lisosomiale. Durante l’autofagia mediata da chaperone, le proteine da degradare sono mirate a un Hsp70, che a sua volta trasporta il carico bersaglio al lisosoma.
L’autofagia è diretta da geni Atg(correlati all’AuTofagIa), che sono necessari per attivare il complesso di segnalazione che innesca la formazione di autofagosomi . Gli Atggenes sono stati scoperti nel lievito, ma molti hanno ortologhi negli eucarioti superiori (Figura 6). La formazione dell’autofagosoma comporta la partecipazione della proteina citoplasmatica LC3 (Atg8), che subisce la lipidazione da parte della fosfatidiletanolammina, e viene quindi reclutata nella membrana autofagosoma nascente (Figura 7). L’accumulo di proteina LC3 lipidata (nota come LC3-II) è usato come marker di autofagia .

Figura 6.
xmlns: xlink=” http://www.w3.org/1999/xlink ” xmlns: mml=” http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. La proteina LC3 è lipidata dalla fosfatidiletanolamina.
La morte cellulare autofagica, o morte cellulare programmata di tipo II, è caratterizzata da un massiccio inghiottimento del citoplasma da parte di vescicole autofagiche. Questa intensa attività autofagica differisce sostanzialmente dall’autofagia che si verifica continuamente a livelli basali. Studi ultrastrutturali in Drosophila hanno rivelato l’accumulo di vacuoli autofagici nella maggior parte dei tessuti larvali. Questo tipo di morte cellulare programmata inizia con la degradazione degli organelli citoplasmatici da autofagia, anche se gli elementi citoscheletrici sono conservati fino alle ultime fasi del processo (rivisto in ).
