Introduzione
Le cellule citotossiche sono parte integrante nella lotta contro le cellule tumorali e infette da virus. Queste cellule uccidono attraverso tre diversi percorsi, il rilascio di granuli litici, la via del recettore-ligando Fas o la via del recettore TRAIL–TRAIL. Ai fini di questo documento, ci concentreremo sulla degranulazione. Quando una cellula citotossica incontra una cellula bersaglio, aderisce strettamente ad essa formando la sinapsi immunitaria. I granuli litici vengono quindi polarizzati verso la sinapsi immunologica e rilasciati dalla cellula citotossica diretta verso il bersaglio (1). Questi granuli contengono vari mediatori citotossici come perforina e granzimi. La perforina rilasciata può formare pori transitori all’interno della membrana cellulare bersaglio consentendo ai granzimi di entrare nella cellula bersaglio. L’ingresso è probabilmente mediato anche da oligomeri di perforina che formano pori incompleti (archi) (2), ed è stato anche suggerito che granzymes e perforina possono essere assorbiti nelle cellule bersaglio attraverso la via endosomiale (3, 4). I dati alla base di questi meccanismi proposti sono stati recentemente discussi in dettaglio (5). Quando i granzimi entrano nelle cellule bersaglio, la via della caspasi viene attivata con conseguente apoptosi (6, 7). La membrana di questi granuli citotossici contiene glicoproteina-1 di membrana associata al lisosomio (LAMP1), nota anche come CD107a (8). La parte luminale del ratto CD107a è transitoriamente esposta al lato extracellulare della membrana cellulare dopo la degranulazione prima di essere nuovamente interiorizzata. Pertanto, la colorazione CD107a indica che si è verificato un evento di degranulazione (9). Mentre il ruolo per CD107a è ancora in fase di determinazione, gli studi siRNA contro CD107a hanno dimostrato che è essenziale per il traffico di perforina all’interno delle vescicole, poiché la consegna di perforina ai granuli litici è inibita in assenza di CD107a (10). CD107a ha anche dimostrato di avere un ruolo nella protezione delle cellule citotossiche dalla morte legandosi alla perforina e impedendo l’inserimento nella membrana cellulare (11).
Esistono due tipi principali di linfociti citotossici, cellule natural killer (NK) e cellule T CD8. Entrambi i tipi di cellule uccidono attraverso il rilascio di granuli litici, la via del recettore Fas / ligando Fas e la via del recettore TRAIL/TRAIL, ma lo stimolo necessario per attivare questi due gruppi cellulari è diverso. Le cellule T riconoscono l’antigene presentato dalle molecole MHC di classe I attraverso il loro recettore delle cellule T attivante (TCR), mentre le cellule NK riconoscono gli antigeni delle cellule bersaglio attraverso vari recettori inibitori e attivanti. I recettori inibitori sono importanti per impedire alle cellule NK di uccidere le cellule sane mentre i recettori attivanti inducono la citotossicità delle cellule NK.
Prima dell’identificazione di CD107a come marker per la degranulazione nelle cellule NK (12), l’output per misurare la capacità citotossica era la morte delle cellule bersaglio. Il rilevamento di CD107a mediante citometria a flusso ha permesso ai ricercatori di identificare le cellule effettore specifiche con capacità citotossica. Dalla sua scoperta, una vasta gamma di pubblicazioni di dati provenienti da studi su topi e umani è stata completata mostrando il vantaggio di utilizzare un anticorpo anti-CD107a. Il ratto è un prezioso modello animale immunologico per lo studio di malattie come la leucemia e l’innesto vs. malattia dell’ospite (13), ma le letture funzionali sono state ostacolate dalla mancanza di anticorpi anti-rat CD107a specifici di alta qualità per la citometria a flusso. Questo articolo descrive la creazione di un anticorpo verso il ratto CD107a e la caratterizzazione della risposta di degranulazione nelle cellule T del ratto NK e CD8+.
Materiali e metodi
Animali
Criceti inbred armeni (Cytogen Research and Development Inc., MA, USA) sono stati ospitati nel Dipartimento di Medicina Comparata presso Rikshospitalet, Oslo University Hospital, in accordo con le linee guida istituzionali. I ceppi di ratto PVG-RT1U, PVG-RT7b, PVG-RT1N, e PVG-R23 sono stati utilizzati in modo intercambiabile, e mantenuta per più di 20 generazioni e ospitato in conformità con le linee guida Sperimentali Bordo dell’Animale sotto il Ministero dell’Agricoltura, Norvegia e dalla Convenzione Europea per la Protezione degli Animali Vertebrati utilizzati a fini Sperimentali o ad Altri fini Scientifici Scopo. I ratti sono stati usati all’età di 8-12 settimane. Le strutture per animali da laboratorio sono sottoposte a un programma di monitoraggio sanitario di routine e testate per gli organismi infettivi secondo una modifica delle raccomandazioni della Federation of European Laboratory Animal Science Association. Gli esperimenti sugli animali sono stati regolati attraverso regolamenti di laboratorio, che sono messi avanti dalla legge sul benessere degli animali in cui la Norvegia segue la direzione di laboratorio dell’UE e la convenzione europea di laboratorio.
Abs e reagenti
Anticorpi contro NKp46, NKR-P1A 3.2.3-PB, o non coniugato (vincolante solo NKR-P1A, ma non NKR-P1B, nel ceppo PVG), CD8 (OX8-biotina), CD2 (OX34, non coniugato), TCR (R73-Alexa647), topo IgD b allotipo (TIB96-non coniugato, usato come topo IgG isotipo), e CD45.2 (His41-FITC, usato come topo IgG isotipo) sono stati fatti nel nostro laboratorio e coniugato secondo protocolli standard. Gli anticorpi contro CD3 (IF4, non coniugato) e il suo topo isotipo IgM (MM-30, non coniugato) e il controllo isotipo IgG del criceto armeno (HTK88-FITC) sono stati acquistati da Biolegend (San Diego, CA, USA). Gli anticorpi anti-CD107a commerciali sono stati acquistati da AbCam (Cambridge, UK) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) e Lifespan (Seattle, WA, USA) (LS-C8580-unconjugated). LS-C8580 è stato coniugato con Alexa488 estere NHS (Sigma-Aldrich, St. Louis, MO, USA) per l’uso in saggi funzionali. Anticorpo anti-BANDIERA (M2, non coniugato) e anti-topo IgG (capra policlonale-FITC) sono stati acquistati da Sigma-Aldrich (St. Louis, MO, USA). IL-2 è stato ottenuto da un surnatante di coltura cellulare dializzato di una linea cellulare ovarica di criceto cinese (CHO) stabilmente trasfettata con un costrutto di espressione IL-2 di ratto. La proteina peridinina clorofilla-a (PerCP) ha coniugato la streptavidina, il controllo policlonale dell’isotipo del criceto IgG di FITC, il controllo dell’isotipo del topo FIT1 di FITC (MOPC-FITC) e il GolgiStop sono stati acquistati da BD biosciences (Franklin Lakes, NJ, USA). Il criceto anti-armeno di capra (policlonale-FITC) è stato acquistato da Jackson Immunoresearch (West Grove, PA, USA). Supernatanti da ibridomi OX41, CD172a (SIRPa), R73 (anti-rat TCRaß), OX19 (anti-CD5), OX12 (anti-Igk catena), e OX33 (anti-CD45RA) sono stati realizzati in-house. Il siero di criceto di controllo è stato derivato da criceti armeni non immunizzati.
La clonazione del ratto CD107a
Il ratto CD107a è stato PCR amplificato da cDNA generato da splenociti di ratto PVG e subclonato in un vettore di espressione pMX contenente un gene di resistenza alla puromicina (un generoso dono del Dr. Michael R. Daws) (14). I primer CD107 sono stati progettati sulla base di una sequenza cDNA rat CD107a (LAMP1) (GenBank: NM_012857). Avanti primer: 5′-GCCCCAGCACTGTTCGAGGT-3′; Primer inverso: 5′-GTTGTTACCGTCCTGTACACACT-3′. Un peptide anionico trypsin-1 leader (MSALLILALVGAAVA) è stato utilizzato nel vettore di espressione e la regione transmembrana CD107 originale è stata sostituita da un frammento transmembrana CD8 per facilitare l’espressione di superficie elevata. Un FLAG-tag (DYKDDDK) è stato legato all’N-terminale della proteina CD107 per rendere rilevabile l’espressione della superficie. Tutte le sequenze inserite e il frame di lettura aperto nel costrutto plasmidico chimerico finale sono stati esaminati e confermati dal sequenziamento del DNA Sanger.
Trasformazione di BWZ.36 Cellule con plasmide pMX-CD107a
293T sono state seminate in una piastra di coltura cellulare a 6 pozzetti con 4 ml di terreno RPMI 1640, trasfettate con 7,5 µl di reagente FuGENE6 (Roche, protocollo del produttore) e incubate a 37°C con il 5% di CO2. Il reagente FuGENE6 è stato pre-diluito con Opti-MEM (Gibco) e miscelato con 1,5 µg di plasmide PMX-CD107a e 1 µg di plasmide retrovirale specifico per roditori pCL-ECO (Addgene #12371). Ventiquattro ore dopo la trasfezione, il surnatante è stato decantato e sostituito con un mezzo RPMI1640 con 2% di FBS e trasferito a 32 ° C per la produzione retrovirale. Quarantotto ore dopo, il surnatante è stato raccolto e filtrato con un filtro Filtropur S da 0,2 µm (Sarstedt) e salvato a -80°C per la trasduzione retrovirale.
Il 105 BWZ.36 cellule sono state seminate per pozzetto in una piastra di coltura cellulare a 24 pozzetti (Corning) e coltivate con terreno fresco RPMI1640 con 10% FBS, durante la notte. Il surnatante è stato rimosso e RPMI1640 contenente il 10% di FBS, 16 µg di polibrene (ad una concentrazione finale di 8 µg/ml) e 1,5 ml di supernatante retrovirale è stato aggiunto e centrifugato a 32°C a 2400 rpm per 2 h. Le cellule sono state quindi incubate a 32 ° C per 1 ora dopo di che il surnatante è stato rimosso e sostituito con un mezzo fresco RPMI1640 con 10% FBS e coltivato per 3 giorni, a 37°C con 5% CO2 (il giorno 2, è stato possibile utilizzare un mezzo completo con 1 ng/ml di puromicina). I transfettanti espansi BWZ.CD107a-FLAG sono stati esaminati per l’espressione superficiale del FLAG-tag e quindi sono stati utilizzati per l’immunizzazione anticorpale o lo screening anticorpale.
Generando CD107A esprimendo transfettanti
Il plasmide chimerico CD107a del ratto è stato trasfettato in cellule CHO. In breve, le cellule CHO sono state coltivate in mezzo RPMI1640 completo (cRPMI; mezzo RPMI1640 con 10% FBS, 1mm Na piruvato, 50µM 2-mercaptoetanolo) fino a raggiungere la confluenza 30%. Il plasmide da 2,5 µg è stato miscelato con 7,5 µl di Fugene 6 reagente (Roche) e aggiunto sulle cellule a goccia. Due giorni dopo, le cellule CHO sono state staccate con un mezzo RPMI1640 integrato con EDTA 2mM e sono state seminate in piastre di coltura cellulare a fondo piatto da 96 pozzetti (25 cellule/pozzetto) con mezzo di selezione (cRPMI integrato con puromicina 20 µg/ml) per la clonazione di transfettanti stabili. Dopo 10-12 giorni di coltura, i cloni adulti sono stati sottoposti a screening con anticorpi anti-BANDIERA (M2). Uno dei cloni che esprimono il più alto livello di superficie di FLAG e CD107a è stato utilizzato per le vaccinazioni.
Immunizzazione e fusione cellulare
I criceti inbred armeni maschi di età compresa tra 3 e 10 settimane sono stati immunizzati mediante iniezioni intraperitoneali (ip) con 2 × 106 cellule CHO.CD107a – FLAG una volta alla settimana per 3 settimane. Una spinta con 4 × 106 cellule BWZ.CD107a-FLAG stabilmente trasfette è stata data ip 32 giorni dopo la prima immunizzazione e i sieri sono stati analizzati per la colorazione superficiale sia di CHO.CD107a-FLAG che di BWZ.CD107a-transfectants BANDIERA. Due dei tre animali sono risultati positivi, e 3 giorni dopo il potenziamento, le cellule della milza sono state raccolte e raggruppate dai due animali, uno dei quali aveva splenomegalia. Circa 2,0 × 108 cellule di milza e 1,4 × 108 cellule di mieloma NS0 sono state lavate tre volte in DMEM con additivi (piruvato di sodio da 1 mm, 2-mercaptoetanolo da 0,05 mm e antibiotico / antimicotico) e centrifugate a 90 g per 10 min. Mantenendo il tutto a 37°C da questo punto in avanti, il pellet è stato sciolto toccando il tubo e pre-riscaldato polietilenglicole 1500 (Roche) è stato aggiunto goccia a goccia mescolando delicatamente per 1 min. Tre millilitri di DMEM con additivi sono stati aggiunti gradualmente per i successivi 3 min finendo con un extra 7 ml prima di centrifugare a 500 g. Il pellet è stato lavato con un accurato lavaggio (senza risospensione) con DMEM con additivi e 20% FBS (DMEM-20) e coltivato durante la notte. Le cellule sono state raccolte il giorno seguente e 100 ml DMEM-20 con 2× hypoxanthine–aminopterin–thymidine (SIGMA) e 10% hybridoma cloning supplement (HCS) (PAA) è stato aggiunto. La sospensione cellulare è stata trasferita su piastre a 96 pozzetti. Dopo 12 giorni, i surnatanti provenienti da cloni in crescita sono stati testati mediante citometria a flusso per la colorazione di antigeni di superficie presenti su BWZ. CD107a-FLAG e CHO. CD107a-FLAG, ma non su BWZ.36 cellule trasfettate con antigeni irrilevanti etichettati come controlli negativi. I 9 dei 12 cloni positivi che producono anticorpi specifici sono stati ulteriormente succlonati utilizzando DMEM-20 integrato con ipoxantina-timidina e HCS. Solo un clone (SIM1) produceva ancora anticorpi dopo la subclonazione e questo è stato ulteriormente subclonato un’altra volta. Anticorpi IgG specifici per criceto CD107a sono stati rilevati da FITC anti-Armenian hamster IgG (Jackson Immunoresearch). Anti-CD107a dall’ibridoma SIM1 è stato purificato dalla proteina HiTrap G HP (GE Healthcare, Life Sciences) e FITC-coniugato secondo le procedure standard o Alexa488-coniugato secondo il protocollo del produttore.
Generazione di cellule Effettrici
Dalla milza sono state preparate sospensioni a cellule singole. I linfociti sono stati isolati usando un gradiente di linfoprep e poi eseguiti su una colonna di lana di nylon per rimuovere le cellule B e i macrofagi. Per la generazione di cellule NK attivate da IL-2 (LAK), le cellule rimanenti sono state coltivate durante la notte in IL-2. Il giorno seguente, le cellule non aderenti sono state rimosse mediante lavaggio con PBS e le cellule NK aderenti sono state mantenute in RPMI integrate con IL-2, 10% FBS inattivato dal calore, 1% Streptomicina/penicillina, 1mm piruvato di sodio e 50 µM 2-mercaptoetanolo. Le cellule sono state coltivate per 8-10 giorni. Per la generazione di cellule NK arricchite o cellule T e NK ordinate, le cellule sono state arricchite dalla selezione negativa dopo la fase di lana di nylon. Per l’arricchimento delle cellule NK, le Dynabeads IgG pan-mouse (Invitrogen Dynal) sono state rivestite con anticorpi contro i macrofagi (OX41), le cellule T (R73 e OX19) e le cellule B (OX12 e OX33). Per l’arricchimento delle cellule T, le Dynabeads IgG pan-mouse sono state colorate con anticorpi contro i macrofagi (OX41) e le cellule B (OX12 e OX33). Le cellule sono state arricchite da due fasi di selezione negativa con perline colorate per 30 min a 4°C. Le cellule NK arricchite avevano una purezza di circa il 50-60% e sono state utilizzate per studi di degranulazione. Le cellule T arricchite (purezza del 79-85%) sono state ulteriormente classificate per le cellule TCR+ utilizzando un FACS Aria (BD Biosciences).
Saggi di degranulazione
Per misurare la risposta di degranulazione mediante colorazione con anti-rat CD107a (SIM1) durante la stimolazione delle cellule bersaglio, gli effettori NK e le cellule bersaglio YAC sono stati incubati, con un rapporto 1 a 1 di 3 × 105 cellule / pozzetto (salvo diversa indicazione) in supporti contenenti il SIM1 mAb, gli altri anticorpi anti-CD107a disponibili in commercio, o controllo isotipo. Per misurare la risposta di degranulazione alla stimolazione anticorpale da cellule NK, abbiamo utilizzato piastre a fondo piatto a 96 pozzetti rivestite con concentrazioni variabili di anti-NKp46 (Wen23), anti-NKR-P1A (3.2.3) e un controllo dell’isotipo mouse1 del topo (TIB96). Il giorno seguente, le piastre sono state lavate con PBS e bloccate con cRPMI prima di aggiungere 3 × 105 celle NK arricchite sospese in cRPMI contenenti SIM1 per pozzetto. Per misurare la degranulazione dalle cellule T, sono stati ordinati e coltivati in cRPMI con IL-2 per 2-3 giorni. Le piastre a fondo piatto a 96 pozzetti sono state rivestite durante la notte con anticorpi contro CD3 (IF4), CD2 (OX34) o un controllo isotipo IgM (MM-30). Circa 3 × 105 celle T sono state aggiunte per pozzetto in cRPMI contenente SIM1. Tutti i test sono stati incubati per 4 h. Golgistop è stato aggiunto per l’ultimo 3 h di incubazione per prevenire la degradazione di CD107a internalizzato. Le cellule sono state poi lavate e colorate con anticorpi verso i recettori di superficie appropriati e analizzati utilizzando il FACS Canto o LSR II (BD Biosciences).
Analisi del rilascio del cromo
Cellule bersaglio YAC-1 (5 × 106 cellule / ml cRPMI) con aggiunta di 3.7 MBq51Cr sono stati incubati a 37°C per 1 h, mescolando ogni 15 min. Le cellule sono state quindi lavate tre volte con PBS con 2% FBS e risospese a 1 × 105 cellule/ml in cRPMI. Le cellule effettrici LAK e le cellule bersaglio sono state placcate ai rapporti specificati in un volume finale di 200 µl. Le cellule sono state centrifugate e incubate per 4 ore a 37°C. Il rilascio specifico di 51Cr è stato misurato utilizzando l’auto-gamma Cobra (Packard).
Risultati
Per creare un anticorpo contro CD107a, abbiamo creato un vettore di espressione contenente la regione della membrana extracellulare del ratto CD107a, la regione transmembrana del ratto CD8 e un FLAG-tag 3′-terminale per rilevare l’espressione superficiale (Figura 1A). Il vettore è stato trasfettato in cellule CHO e BWZ.Linea cellulare 36 T e sottoposto a screening per l’espressione di CD107a utilizzando un anticorpo anti-FLAG (M2) (Figura 1B). Le cellule CHO trasfette stabilmente CD107a sono state iniettate in criceti consanguinei armeni una volta alla settimana per 3 settimane con una spinta finale di cellule BWZ trasfettate stabilmente CD107a 3 giorni prima della fusione con la linea cellulare del mieloma NS0. I supernatanti dei diversi cloni sono stati testati per la specificità verso BWZ. CD107a-FLAG, ma non irrilevante BWZ contrassegnato con FLAG.36 transfettanti. Un clone, SIM1, è stato trovato per legarsi specificamente al transfectant esprimente CD107a, ma non al controllo transfected FLAG (Figura 1C).

Figura 1. Generazione di un anticorpo monoclonale anti-ratto CD107a (SIM1). (A) Mappa vettoriale schematica del vettore di espressione pMX con peptide leader, FLAG-tag, inserto CD107a e dominio transmembrana di CD8. (B) Ovaio di criceto cinese trasfettato stabilmente e BWZ.36 cellule sono state testate per l’espressione della superficie cellulare di CD107a contrassegnato con FLAG utilizzando un anticorpo anti-FLAG (M2) (istogrammi ombreggiati). Il controllo negativo è l’anticorpo secondario da solo (istogramma trasparente). C) Le cellule BWZ trasfettate con CD107a-FLAG o antigene irrilevante (NKR-P1F-FLAG) sono state macchiate con siero di controllo di criceto, surnatante SIM1 o anticorpo anti-FLAG (M2).
Il clone SIM1 è stato ulteriormente testato in saggi funzionali in parallelo con due anticorpi CD107a disponibili in commercio, che potrebbero potenzialmente reagire in modo incrociato con CD107a di ratto nella citometria a flusso. I cloni anticorpali testati erano H4A3 di AbCam (che reagisce in modo incrociato con umani, ratti, topi e primati nella citometria a flusso) e il clone anticorpale LS-C8580 di LifeSpan BioSciences (che reagisce in modo incrociato con CD107a di topi, umani e ratti in immunoistochimica e Western blot secondo il sito Web del produttore). Il nostro clone anticorpale SIM1 ha identificato le cellule degranulanti in presenza di cellule bersaglio e ha mostrato poca colorazione di fondo in assenza di bersagli (pannello superiore Figura 2A). Clone H4A3 macchiato la più alta percentuale di cellule NK dopo la stimolazione delle cellule bersaglio (pannello centrale). Tuttavia, c’era anche un alto livello di colorazione di fondo in assenza di cellule bersaglio, indicando un legame non specifico. Livelli molto bassi di degranulazione, se presenti, sono stati misurati dal clone LS-C8580 mAb (pannello inferiore). La specificità di questi anticorpi è stata confermata dalla colorazione positiva del transfettante BWZ.CD107a-FLAG, ma non BWZ.Controllo NKR-P1F-FLAG (Figura 2B). Il clone anticorpale H4A3, che ha dimostrato di legarsi a CD107a umano (16), non ha macchiato le cellule BWZ trasfette CD107A del ratto, indicando che non vi è alcuna reazione crociata con CD107A del ratto. Anche il clone anti-topo CD107A ID48 non è riuscito a macchiare il transfettante CD107A del ratto. LS-C8580 non coniugato, d’altra parte, ha mostrato una colorazione specifica delle cellule transfettate CD107a (dati non mostrati). Tuttavia, il clone di LS-C8580 è disponibile soltanto come anticorpo non coniugato che non è adatto per gli studi di degranulazione. I ripetuti tentativi nel nostro laboratorio di coniugare LS-C8580 ad Alexa488 non hanno purtroppo fornito forti coniugati di colorazione, sebbene la piccola dimensione del campione e la concentrazione di LS-C8580 possano essere la causa della scarsa coniugazione. LS-C8580 coniugato mostra una colorazione ridotta ma specifica delle cellule transfettate CD107a (Figura 2B), ma come mostrato nella Figura 2A, non siamo stati in grado di rilevare le cellule degranulanti durante i test funzionali con questo coniugato. In conclusione, il SIM1 mAb macchia specificamente le cellule NK di ratto degranulanti dopo la stimolazione con le cellule bersaglio.

Figura 2. SIM1 misura la degranulazione da cellule T natural killer (NK) e CD8. (A) La percentuale di cellule degranulanti è stata misurata utilizzando anticorpi anti-CD107a SIM1, H4A3 e LS-C8580, con o senza cellule bersaglio YAC-1 come stimolo. Viene mostrato un esperimento rappresentativo su quattro (B). Colorazione della linea cellulare BWZ. CD107a-FLAG con cloni anticorpali SIM1, H4A3, LS-C8580 o ID48. BWZ.36 cellule trasfettate con antigene irrilevante contrassegnato con BANDIERA (BWZ.NKR-P1G-FLAG) è stato incluso come controllo negativo, (C) le cellule NK arricchite sono state stimolate con anti-NKp46 legato alla piastra, anti-NKR-P1A o topo I1 come controllo dell’isotipo e SIM1 è stato utilizzato per misurare la percentuale di cellule degranulanti. Le celle NKp46+ (Wen23) o NKR-P1Abright (3.2.3) sono state chiuse. (D) Le cellule TCR+ sono state ordinate (purezza 99%) e coltivate in IL-2 per 2-3 giorni. Le cellule sono state quindi stimolate con anti-CD3 legato alla piastra e anti-CD2 o controllo isotipo IgM del mouse per anti-CD3. Il pannello inferiore mostra la stimolazione con anti-CD3 e anti-CD2 e la colorazione con un controllo isotipo SIM1 (FITC hamster IgG policlonale). Le cellule T sono state ordinate utilizzando anticorpi R73-Alexa647 e 3.2.3-PB, gating su cellule R73+/3.2.3. I dati mostrati provengono da un esperimento rappresentativo di tre esperimenti indipendenti separati.
La stimolazione diretta dei recettori NK attivanti attraverso anticorpi legati alla piastra è un altro metodo potente per indurre la degranulazione. Per testare il clone SIM1 in questo test funzionale, abbiamo incubato cellule NK arricchite su piastre rivestite con anticorpi verso i recettori attivanti NKp46 e NKR-P1A (Figura 2C). Come controllo negativo, le piastre sono state rivestite con il controllo dell’isotipo mouse1 del mouse. La colorazione con l’anticorpo SIM1 ha identificato il 25,5 o il 44% di cellule degranulanti dopo stimolazione cellulare NK in piastre rivestite rispettivamente con 5 µg/ml anti-NKp46 o anti-NKR-P1A. La percentuale di cellule degranulanti è aumentata ulteriormente quando le piastre sono state rivestite con una maggiore concentrazione di anticorpi stimolanti (10 µg/ml). Non è stata indotta alcuna degranulazione nei pozzetti rivestiti con il controllo dell’isotipo mouse1 del topo.
Abbiamo visto chiaramente la degranulazione nelle cellule NK stimolate con cellule bersaglio o con anticorpi contro i recettori di attivazione utilizzando il nostro anticorpo SIM1. Volevamo anche confermarlo nelle cellule T citotossiche. Le cellule T sono state selezionate dalle cellule della milza e coltivate in IL-2 per 2-3 giorni. Le cellule T sono state quindi stimolate con anti-CD3 e anti-CD2 legati alla piastra (Figura 2D). La degranulazione è stata misurata da cellule T CD8 + coltivate quando stimolate con anti-CD3 e anti-CD2 nei giorni 2 e 3. Nessuna degranulazione è stata misurata da cellule T CD4 non citotossiche, o dopo stimolazione con anticorpo di controllo isotipo, dimostrando ulteriormente la specificità del nostro anticorpo SIM1.
Le cellule killer attivate dalla linfochina (LAK) vengono create coltivando cellule NK in IL-2 per 7-10 giorni e sono comunemente usate come cellule effettrici molto potenti nei test di rilascio del cromo per studiare la citotossicità e, pertanto, dovrebbero essere in grado di generare alti livelli di degranulazione. Per misurare la degranulazione dalle cellule LAK, inizialmente abbiamo usato un 1:1 rapporto tra effettore e target ma trovato inaspettatamente bassi livelli di degranulazione (dati non mostrati). Tuttavia, facendo una titolazione per trovare rapporti effettori ottimali, abbiamo visto aumentare i livelli di degranulazione quando i rapporti effettori / target erano inferiori a 1 (Figura 3A). Il rapporto ottimale per i saggi di degranulazione è quindi in contrasto con i saggi di citotossicità in cui il livello di citotossicità aumenta con rapporti effector: target più elevati (Figura 3B).
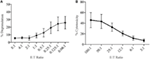
Figura 3. Basso effettore:i rapporti target sono importanti per garantire un’adeguata sensibilità nei saggi di degranulazione con cellule NK di ratto. (A) Degranulazione di cellule LAK coltivate 8-10 giorni in IL-2 contro bersagli YAC-1 a diversi effettori:rapporti target. (B) La citotossicità del LAK coltivato IL-2 contro le cellule bersaglio YAC-1 è stata confermata con il test di rilascio del cromo completato nei giorni 8-10. Tutti i grafici sono cumulativi di tre o più esperimenti separati con barre che mostrano SD.
Discussione
Nel test iniziale di SIM1 e dei diversi anticorpi CD107a commerciali nei saggi di degranulazione nel ratto, abbiamo scelto una piccola gamma di effettori per indirizzare i rapporti con un’inclinazione verso più cellule effettori rispetto ai bersagli basati sulla letteratura attuale (12, 16, 17). I rapporti tra effettori e cellule bersaglio possono variare da carta a carta, ma studi precedenti che hanno titolato i rapporti tra effettori e cellule bersaglio hanno dimostrato che la degranulazione ottimale delle cellule NK di topo ha raggiunto un picco di 4,5:1 con le cellule bersaglio YAC-1 (18) e le cellule NK umane hanno ucciso le cellule K562 al meglio con un rapporto di 5: 1 o 10:1 (12). Tuttavia, quando si utilizza una gamma più ampia di effettori per indirizzare i rapporti, mostriamo che la degranulazione utilizzando cellule di ratto LAK è stata indotta in modo più efficace quando si utilizzano quattro o più bersagli per cellula effettuatrice. Questa differenza nel rapporto tra effettore ottimale e target tra il ratto e altre specie potrebbe essere dovuta al tipo di cellule bersaglio utilizzate, poiché le titolazioni tra effettore umano e topo e rapporto target negli studi sopra menzionati hanno utilizzato cellule bersaglio provenienti dalla stessa specie. Le cellule effettrici potrebbero essere più sensibili alle cellule bersaglio della stessa specie e quindi hanno bisogno di meno cellule bersaglio per attivarsi. La linea cellulare YAC-1 utilizzata nel nostro studio è un linfoma a cellule T di topo, che è stato lo standard per molti anni per stimolare la citotossicità dalle cellule NK di ratto. Non possiamo escludere che l’utilizzo di una cellula bersaglio di ratto si tradurrebbe in una stimolazione più forte delle cellule NK e successivamente potrebbero essere necessarie meno cellule bersaglio per indurre la degranulazione.
È anche chiaro da questo studio che i rapporti effettore-bersaglio utilizzati per i test di citotossicità non sono correlati bene con i rapporti necessari per misurare la risposta ottimale di degranulazione nelle cellule effettore. Ciò non è sorprendente in quanto la lettura di questi due saggi è diversa, con citotossicità che misura la morte cellulare bersaglio e degranulazione che misura la risposta NK ai bersagli.
In conclusione, abbiamo sollevato un anticorpo contro il ratto CD107a (SIM1) e caratterizzato la sua capacità di rilevare la degranulazione nei linfociti citotossici nel ratto. Abbiamo dimostrato che SIM1 è specifico per le cellule degranulanti e, attraverso l’ottimizzazione del protocollo di degranulazione, abbiamo determinato che utilizzando effector:target cell ratios inferiori a 1:4 assicurano una stimolazione ottimale delle cellule LAK. Lo sviluppo dell’anti-ratto CD107a (SIM1) consente una migliore analisi e caratterizzazione delle risposte citotossiche dei linfociti di ratto e sarà uno strumento prezioso nei molti modelli di malattia del ratto.
Dichiarazione etica
Lo studio è approvato dalla National Animal Research Authority (FDU), Norvegia (numero di permesso: ID-1698).
Contributi dell’autore
AS è stato responsabile dell’analisi delle espressioni, dei saggi funzionali e della scrittura del manoscritto. K-ZD ha eseguito la clonazione cDNA e la generazione di transfettanti. JTV è stata coinvolta nella pianificazione e supervisione del progetto e nella stesura del manoscritto. LK è stato responsabile per le vaccinazioni, la tecnologia ibridoma, la scrittura del manoscritto, e la supervisione del progetto.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori ringraziano Ulla Heggelund e Stine Martinsen per l’assistenza tecnica in laboratorio e il personale della struttura per animali presso il Dipartimento di Medicina comparata del Rikshospitalet, Oslo University Hospital per l’aiuto con le vaccinazioni. Grazie a Marit Inngjerdingen per le discussioni scientifiche.
Finanziamento
La ricerca è stata finanziata dall’Università di Oslo, South-Eastern Norway Regional Health (2009104), e Legatet til Henrik Homans Minde.
1. Arancione JS. Formazione e funzione della sinapsi immunologica delle cellule NK litiche. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038 / nri2381
PubMed Abstract | CrossRef Full Text/Google Scholar
2. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. I pori della perforina nella membrana endosomiale innescano il rilascio di granzyme B endocytosed nel citosol delle cellule bersaglio. Nat Immunolo (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Abstract | CrossRef Full Text/Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforina e granzimi: funzione, disfunzione e patologia umana. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Il progetto è stato realizzato in collaborazione con il Centro Studi di Bologna. Un secondo trapianto profilattico di midollo osseo MHC-non corrispondente protegge contro la leucemia mieloide acuta del ratto (BNML) senza malattia letale del trapianto contro l’ospite. Trapianto (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Il sito utilizza cookie tecnici e di terze parti. Applicazioni della clonazione dell’espressione mediata da retrovirus. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Ridotta degranulazione delle cellule NK in pazienti con herpes frequentemente ricorrenti. Vaccino Clin Immunolo (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO, et al. Analisi funzionale delle cellule NK umane mediante citometria a flusso. Metodi Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
