Il primo approccio per sviluppare antagonisti dei cannabinoidi alla fine degli anni 1980 è stato quello di modificare la struttura del THC, ma i risultati sono stati deludenti. Nei primi anni 1990 nuova famiglia di agonisti cannabinoidi è stato scoperto dal FANS (non steroidei anti-infiammatori) farmaco pravadolina che ha portato alla scoperta di antagonisti aminoalchil indolo con alcuni ma limitato successo. Poiché la ricerca basata sulla struttura degli agonisti è stata deludente, non è stata una sorpresa che il primo antagonista potente e selettivo dei cannabinoidi appartenesse a una famiglia chimica completamente nuova. Nel 1994 il primo antagonista selettivo dei cannabinoidi, SR141716 (rimonabant), è stato introdotto da Sanofi appartenente ad una famiglia di 1,5-diarilpirazoli.
RimonabantEdit



Rimonabant, noto anche con il nome sistematico , è un antagonista del recettore CB1 1,5-diarilpirazolo (Figura 2). Rimonabant non è solo un ligando potente e altamente selettivo del recettore CB1, ma è anche attivo per via orale e antagonizza la maggior parte degli effetti degli agonisti cannabinoidi, come il THC, sia in vitro che in vivo. Rimonabant ha dimostrato una chiara efficacia clinica per il trattamento dell’obesità.
BindingEdit
Il legame di un ligando agonista al recettore CB1 provoca un cambiamento conformazionale e porta allo stato attivo del recettore che è responsabile della trasduzione del segnale. Tuttavia, esiste un meccanismo aggiuntivo che può portare allo stato attivo in assenza di ligando. Come numerosi altri GPCR, il recettore CB1 mostra un alto livello di attività costitutiva e quindi può adottare spontaneamente uno stato conformazionale attivo in assenza di legame agonista, mantenendo elevati livelli basali di segnalazione intracellulare. Ciò può essere spiegato dal modello a due stati di attivazione del recettore in cui i recettori sono in equilibrio tra due stati, attivi e inattivi (R* e R). Un agonista stabilizzerà lo stato attivo che porta all’attivazione, un antagonista neutro si lega ugualmente agli stati attivi e inattivi, mentre un agonista inverso stabilizzerà preferenzialmente lo stato inattivo (Figura 3).
Rimonabant è stato segnalato in molti casi a comportarsi come agonista inverso piuttosto che come antagonista neutro ed è probabile che si leghi preferenzialmente allo stato inattivo del CB1, diminuendo così l’attivazione della via di segnalazione. L’interazione di legame chiave è un legame idrogeno formato tra il gruppo carbonilico di rimonabant e il residuo Lys192 del recettore CB1. Questo legame stabilizza il ponte salino Lys192-Asp366 dell’estremità intracellulare delle eliche transmembrana 3 e 6 (Figura 4). Questo ponte specifico del sale è presente nello stato inattivo del ricevitore ma assente nello stato attivo.
Nello stato inattivo di CB1 rimonabant si lega all’interno della transmembrana-3-4-5-6 microdominio aromatico. Il legame di rimonabant comporta interazioni dirette di impilamento aromatico tra il suo anello 2,4-diclorofenile e i residui Trp279/Phe200/Trp356 da un lato e l’anello para-clorofenile e i residui Tyr275/Trp255/Phe278 dall’altro lato. La porzione lipofila piperidinilica si adatta bene in una cavità formata dai residui aminoacidici Val196 / Phe170 / Leu387 e Met384 (Figura 4).
PharmacophoreEdit
La maggior parte degli antagonisti CB1 riportati finora sono analoghi vicini o isosteres di rimonabant. Un modello generale di farmacoforo agonista inverso CB1 può essere estratto dalle caratteristiche comuni di questi analoghi, i diarilpirazoli (Figura 4). Questo farmacoforo contiene un nucleo ciclico, C, (ad esempio pirazolo in rimonabant) sostituito da due parti aromatiche, A e B. Un’unità di accettore del legame idrogeno, D, collega C con una parte lipofila ciclica, E. In alcuni casi l’unità E si collega direttamente a C. In Figura 4 rimonabant è usato come esempio. L’unità A rappresenta un gruppo 4-clorofenilico e l’unità B un anello 2,4-diclorofenilico. L’unità C è l’anello centrale del pirazolo e l’unità D rappresenta il gruppo carbonilico che funge da accettore del legame idrogeno. L’unità E rappresenta una frazione di aminopiperidinil lipofila.
Relazioni struttura-attivitàmodifica
Il legame ottimale al recettore CB1 richiede un anello fenilico para-sostituito nella posizione 5 del pirazolo. Il 5-sostituente del pirazolo è coinvolto nel riconoscimento dei recettori e nell’antagonismo. Il para-sostituente dell’anello fenilico potrebbe essere cloro, bromo o iodio, ma è stato dimostrato che una catena alchilica potrebbe anche essere tollerata. La numerazione dell’anello centrale del pirazolo è mostrata in Figura 2.
Un anello fenilico 2,4-dicloro-sostituito alla posizione 1 del pirazolo è preferito per affinità come pure per l’attività. È stato dimostrato che ulteriori alogeni su questo anello fenilico diminuiscono l’affinità.
È anche favorevole avere una sostituzione dell’anello al gruppo 3-carbossammide, come il gruppo 1-piperidinile in rimonabant. La sostituzione del sostituente amminico piperidinile con ammidi alchilici, eteri, chetoni, alcoli o alcani ha determinato principalmente una diminuzione dell’affinità. La sostituzione del piperidinile con pentile o una catena eptilica ha dato ai composti proprietà agonistiche. Sulla base di questi risultati si è concluso che la posizione 3 del pirazolo sembra essere coinvolta nell’agonismo, mentre le posizioni 1,4,5 sembrano essere coinvolte nell’antagonismo.
La ricerca ha indicato che l’assenza dell’ossigeno del carbossamide provoca l’affinità diminuita. Inoltre, la presenza di ossigeno carbossammidico contribuisce a conferire le proprietà agoniste inverse, mentre gli analoghi privi di questo ossigeno si trovano ad essere antagonisti neutri. Questi risultati supportano l’ipotesi che l’ossigeno carbossamide forma un legame idrogeno con residuo Lys192 al recettore CB1.
Derivati di diarilpirazolomodifica
Gli analoghi SR141716 (rimonabant) sono stati recentemente descritti da diversi gruppi, portando a una buona comprensione della relazione struttura-attività (SAR) all’interno di questo gruppo chimico. Mentre la maggior parte dei composti descritti sono meno potenti di SR141716, due di loro sono degni di nota, SR147778 e AM251, anche se entrambi possono avere azione a recettori oppioidi mu pure.
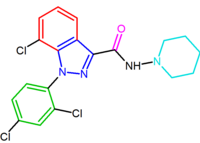
SR147778 (surinabant), un antagonista di seconda generazione, ha una durata d’azione più lunga rispetto a rimonabant e una maggiore attività orale. Questa maggiore durata d’azione è probabilmente dovuta alla presenza del gruppo etilico più metabolicamente stabile nella posizione 4 del suo anello pirazolico. Un altro cambiamento è la sostituzione del 5-fenil cloro sostituente dal bromo.
Il derivato del diarilpirazolo, AM251, è stato descritto dove il sostituente del cloro è stato sostituito da iodio nella posizione para dell’anello 5-fenile. Questo derivato sembrava essere più potente e selettivo di rimonabant.
Sono stati sintetizzati 21 analoghi che possedevano un’ammide alchilica o un idrazide alchilico di lunghezze varianti in posizione 3. È stato osservato che l’affinità aumenta con l’aumento della lunghezza della catena di carbonio fino a cinque carboni. Anche gli analoghi dell’ammide hanno mostrato una maggiore affinità rispetto agli analoghi dell’idrazide. Tuttavia, nessuno di questi analoghi possedeva un’affinità significativamente maggiore rispetto a rimonabant, ma tuttavia erano leggermente più selettivi di rimonabant per il recettore CB1 rispetto al recettore CB2.
Sono stati fatti diversi tentativi per aumentare l’affinità dei derivati del diarilpirazolo rigidificando la struttura di rimonabant. In termini di modello farmacoforo generale le unità A, B e / o C sono collegate da legami aggiuntivi che portano a molecole rigide. Ad esempio, il pirazolo policiclico condensato NESS-0327 ha mostrato 5000 volte più affinità per il recettore CB1 rispetto a rimonabant. Tuttavia, questo composto possiede una scarsa biodisponibilità centrale.
Un altro composto, il derivato indazolico O-1248, può essere considerato un analogo di rimonabant in cui il suo gruppo 5-arilico è fuso alla frazione pirazolica. Tuttavia, questa modifica strutturale ha provocato una diminuzione di 67 volte nell’affinità del ricevitore CB1.
Questi derivati di diarilpirazolo di rimonabant sono riassunti nella Tabella 1.

|

|
| SR147778 | AM251 |
 |
 |
| NESS-0327 | O-1248 |
Other derivativesEdit
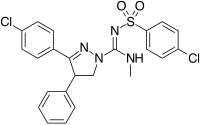
Structurally different from the 1,5-diarylpyrazoles are the chemical series of the 3,4-diarylpyrazolines. All’interno di questa serie è SLV-319 (ibipinabant), un antagonista potente CB1 che è circa 1000 volte più selettivo per CB1 rispetto a CB2 e visualizza in vivo attività simile a rimonabant.
Un altro approccio utilizzato per sviluppare analoghi di rimonabant era quello di sostituire l’anello centrale del pirazolo con un altro eterociclo. Un esempio di questo approccio sono 4,5-diarilimidazoli e 1,5-diarilpirrolo-3-carbossammidi.
È stato riportato un gran numero di derivati biciclici fusi di diaril-pirazolo e imidazoli. Un esempio di questi è un derivato delle purine dove un anello della pirimidina è fuso ad un anello dell’imidazolo. Otenabant (CP-945,598) è un esempio di un derivato biciclico fuso sviluppato da Pfizer.
Diversi gruppi di ricerca hanno studiato bioisosteres di pirazolo ad anello a sei membri. Ad esempio, un derivato della 2,3-diarilpiridina ha dimostrato di essere un agonista inverso CB1 potente e selettivo. La struttura di questo composto dimostra la possibilità che la frazione ammidica di rimonabant possa essere suddivisa in una funzionalità lipofila (benzilossi) e polare (nitrile). Altri analoghi ad anello a sei membri sono ad esempio pirimidine e pirazine.
Oltre agli analoghi ad anello a cinque e sei membri ci sono altri derivati ciclici come le azetidine. Un esempio è il derivato azetidina metilsulfonamide che ha un gruppo 1,1-diarile che imita la frazione 1,5-diarile dei diarilpirazoli. Il gruppo sulfonilico funge da accettore di legame idrogeno. Il gruppo 1,1-diarile è presente anche in derivati come i benzodiossoli e le idantoine.
Sono stati riportati anche analoghi aciclici. Questi analoghi contengono un motivo 1,2-diarile che corrisponde ai sostituenti 1,5-diarile di rimonabant. Un esempio di un analogo aciclico è taranabant (MK-0364) sviluppato da Merck.
I rappresentanti di questi analoghi sono riassunti nella Tabella 2.
|

|
 |
|
| Type of derivative |
3,4-Diarylpyrazoline (Ibipinabant) | 4,5-Diarylimidazole | 1,5-Diarylpyrrole-3-carboxamides |
 |
 |
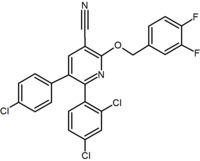 |
|
| Type of derivative |
Purine (pyrimidine ring fused to an imidazole ring) |
Purine derivative (Otenabant) | 2,3-Diarylpyridine |
 |
 |
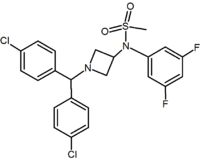 |
|
| Type of derivative |
Pyrimidine | Pyrazine | Methylsulfonamide azetidine |
 |
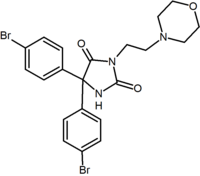 |
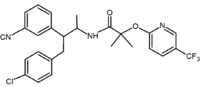 |
|
| Tipo di derivati |
Benzodiossolo | Idantoina | Aciclici derivati (Taranabant) |
recettore CB1 antibodiesEdit
gli Anticorpi contro il recettore CB1 sono stati sviluppati e introdotti nell’uso clinico in Russia. Tra questi brizantin (russo: Бризантин®) e dietressa (russo: Диетресса®). Brizantin è indicato per il trattamento dell’astinenza da nicotina e della cessazione del fumo e dietressa è indicato per la perdita di peso. Dietressa è disponibile over-the-counter in Russia.
