

L’anidride carbonica (CO2) è un composto chimico. È un gas a temperatura ambiente. È fatto di un carbonio e due atomi di ossigeno. Le persone e gli animali rilasciano anidride carbonica quando espirano. Inoltre, ogni volta che viene bruciato qualcosa di organico (o viene fatto un incendio), produce anidride carbonica. Le piante usano l’anidride carbonica per produrre cibo. Questo processo è chiamato fotosintesi. Le proprietà dell’anidride carbonica furono studiate dallo scienziato scozzese Joseph Black nel 1750.
L’anidride carbonica è un gas serra. I gas serra intrappolano l’energia termica. I gas serra cambiano il clima e il tempo sul nostro pianeta, la Terra. Questo è chiamato cambiamento climatico. I gas serra sono una causa del riscaldamento globale, l’aumento della temperatura superficiale della Terra.
Ruolo biologico
L’anidride carbonica è un prodotto finale negli organismi che ottengono energia dalla scomposizione di zuccheri, grassi e aminoacidi con l’ossigeno come parte del loro metabolismo. Questo è un processo noto come respirazione cellulare. Questo include tutte le piante, gli animali, molti funghi e alcuni batteri. Negli animali superiori, l’anidride carbonica viaggia nel sangue dai tessuti del corpo ai polmoni dove viene espirato. Le piante assorbono anidride carbonica dall’atmosfera da utilizzare nella fotosintesi.
Ghiaccio secco
Il ghiaccio secco, o anidride carbonica solida, è lo stato solido del gas CO2 inferiore a -109,3 ° F (-78,5°C). Il ghiaccio secco non si trova naturalmente sulla terra ma è prodotto dall’uomo. È incolore. La gente usa il ghiaccio secco per rendere le cose fredde e per rendere le bevande gassate, uccidere i roditori e congelare le verruche. Il vapore di ghiaccio secco provoca soffocamento e, infine, la morte. Si raccomanda cautela e assistenza professionale ogni volta che è in uso ghiaccio secco.

Alla pressione usuale non si scioglie da un solido a un liquido, ma cambia direttamente da un solido a un gas. Questo è chiamato sublimazione. Cambierà direttamente da un solido a un gas a qualsiasi temperatura superiore a temperature estremamente fredde. Il ghiaccio secco sublima alla normale temperatura dell’aria. Il ghiaccio secco esposto all’aria normale emana gas di anidride carbonica che non ha colore. L’anidride carbonica può essere liquefatta a pressione superiore a 5,1 atmosfere.
Il gas di anidride carbonica che esce dal ghiaccio secco è così freddo che quando si mescola con l’aria raffredda il vapore acqueo nell’aria fino alla nebbia, che sembra un denso fumo bianco. È spesso usato nel teatro per creare l’aspetto di nebbia o fumo.
Isolamento e produzione
I chimici possono ottenere anidride carbonica dall’aria di raffreddamento. Chiamano questa distillazione d’aria. Questo metodo è inefficiente perché una grande quantità di aria deve essere refrigerata per estrarre una piccola quantità di CO2. I chimici possono anche utilizzare diverse reazioni chimiche per separare l’anidride carbonica. L’anidride carbonica è prodotta nelle reazioni tra la maggior parte degli acidi e la maggior parte dei carbonati metallici. Ad esempio, la reazione tra acido cloridrico e carbonato di calcio (calcare o gesso) produce anidride carbonica:
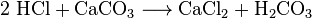
L’acido carbonico (H2CO3) si decompone quindi in acqua e CO2. Tali reazioni causano la formazione di schiuma o bolle, o entrambi. Nell’industria, tali reazioni vengono utilizzate molte volte per neutralizzare i flussi di acido di scarto.
Calce viva (CaO), una sostanza chimica che ha un uso diffuso, può essere fatta calcare riscaldamento a circa 850 °C. Questa reazione rende anche CO2:
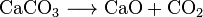
L’anidride carbonica viene prodotta anche nella combustione di tutti i combustibili contenenti carbonio, come metano (gas naturale), distillati di petrolio (benzina, diesel, cherosene, propano), carbone o legno. Nella maggior parte dei casi, viene rilasciata anche l’acqua. Ad esempio, la reazione chimica tra metano e ossigeno è:
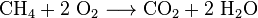
L’anidride carbonica viene prodotta nelle acciaierie. Il ferro è ridotto dalla sua ossidi con la coca in un altoforno, la produzione di ghisa e di biossido di carbonio:

Lievito metabolizza lo zucchero per produrre anidride carbonica ed etanolo, noto anche come alcol, nella produzione di vini, birre e altri alcolici, ma anche per la produzione di bioetanolo:
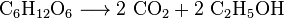
per Tutti gli organismi aerobici produrre CO2, quando si ossidano carboidrati, acidi grassi e proteine nei mitocondri delle cellule. Il gran numero di reazioni coinvolte è estremamente complesso e non descritto facilmente. (Includono la respirazione cellulare, la respirazione anaerobica e la fotosintesi). Photoautotrophs (cioè piante, cianobatteri) utilizzare un’altra reazione: le Piante assorbono CO2 dall’aria, e, insieme con l’acqua, reagiscono per formare carboidrati:
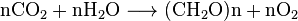
il biossido di Carbonio è solubile in acqua, in cui spontaneamente interconverts tra emissioni di CO2 e di H2CO3 (acido carbonico). Le concentrazioni relative di CO2, H2CO3 e le forme deprotonate HCO−
3 (bicarbonato) e CO2−
3(carbonato) dipendono dall’acidità (pH). In neutro o leggermente alcalino dell’acqua (pH > 6.5), il bicarbonato di forma predomina (>50%) diventando il più diffuso (>95%) il pH dell’acqua di mare, mentre in acqua alcalina (pH > 10.4) predominante (>del 50%) forma è carbonato di. Le forme di bicarbonato e carbonato sono molto solubili. Quindi, l’acqua oceanica equilibrata dall’aria (leggermente alcalina con pH tipico = 8,2–8,5) contiene circa 120 mg di bicarbonato per litro.
Produzione industriale
L’anidride carbonica industriale è prodotta principalmente da sei processi:
- Catturando sorgenti naturali di anidride carbonica dove viene prodotta dall’azione di acqua acidificata su calcare o dolomite.
- Come sottoprodotto degli impianti di produzione di idrogeno, dove il metano viene convertito in CO2;
- Dalla combustione di combustibili fossili o legno;
- Come sottoprodotto della fermentazione dello zucchero nella produzione di birra, whisky e altre bevande alcoliche;
- Dalla decomposizione termica del calcare, CaCO3, nella produzione di calce (ossido di calcio, CaO);
Reazione chimica
L’anidride carbonica può essere creata con una semplice reazione chimica:
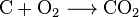 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of “dry ice”, a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

Pterapod shell disciolto in acqua di mare regolati ad un oceano di chimica previsti per l’anno 2100.
-

vista la fotosintesi e la respirazione. L’anidride carbonica (a destra), insieme all’acqua, forma ossigeno e composti organici (a sinistra) per fotosintesi, che possono essere respirati in acqua e (CO2).
-

Un aumento dei livelli di CO2 minacciato astronauti dell’Apollo 13, che si è dovuto adattare le cartucce dal modulo di comando per la fornitura di anidride carbonica, un impianto di lavaggio nel modulo lunare, che hanno usato come una scialuppa di salvataggio.
-

CO2 concentration meter using a nondispersive infrared sensor
