I complessi di trasferimento di carica presentano transizioni di trasferimento di carica in cui l’assorbimento innesca il trasferimento di un elettrone dal donatore all’accettore.
Quando lo iodio viene sciolto in soluzioni di solventi donatori il sorprendente colore viola dello iodio molecolare viene sostituito da un colore giallo-marrone. Questo perché complessi di trasferimento di carica come quelli formati da \(I_2\) possono assorbire la luce in modi che né il donatore né l’accettore possono da soli. Nello specifico, i complessi di trasferimento di carica presentano bande di trasferimento di carica (bande CT) nei loro spettri di assorbimento. Nella transizione di trasferimento di carica il trasferimento parziale iniziale di carica dalla base di Lewis del donatore all’acido di Lewis dell’accettore nel complesso di trasferimento di carica viene spinto ulteriormente dalla fotoeccitazione.
\
La natura di queste transizioni di trasferimento di carica è vista dalla descrizione orbitale del legame per i complessi di trasferimento di carica di iodio. Quando un complesso donatore-I2 forma la formazione del legame donatore-I2 e degli orbitali antibonding si traduce in uno spostamento nella transizione\(I2 \sigma \rightarrow \sigma*\) ad una maggiore energia a la formazione di una nuova banda di trasferimento di carica associata all’eccitazione di un elettrone dall’orbitale amina-I2 \(\sigma \) in gran parte centrata sull’ammina-I2 \
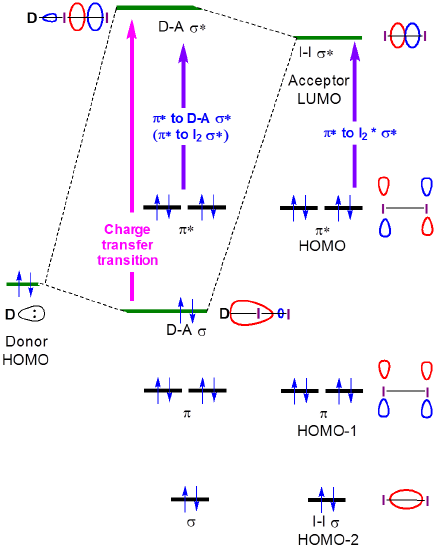
Figura 6.4.2.\ (\PageIndex{2}\). Interazioni orbitali di frontiera che danno luogo a cambiamenti negli spettri di assorbimento dello iodio quando forma un complesso di trasferimento di carica con un donatore di base di Lewis.
Le soluzioni di I2 come miscele con basi di Lewis come le ammine e nei solventi donatori caricano chiaramente le bande di trasferimento. Molti di questi spettri sono riportati nella figura 6.4.2.3.
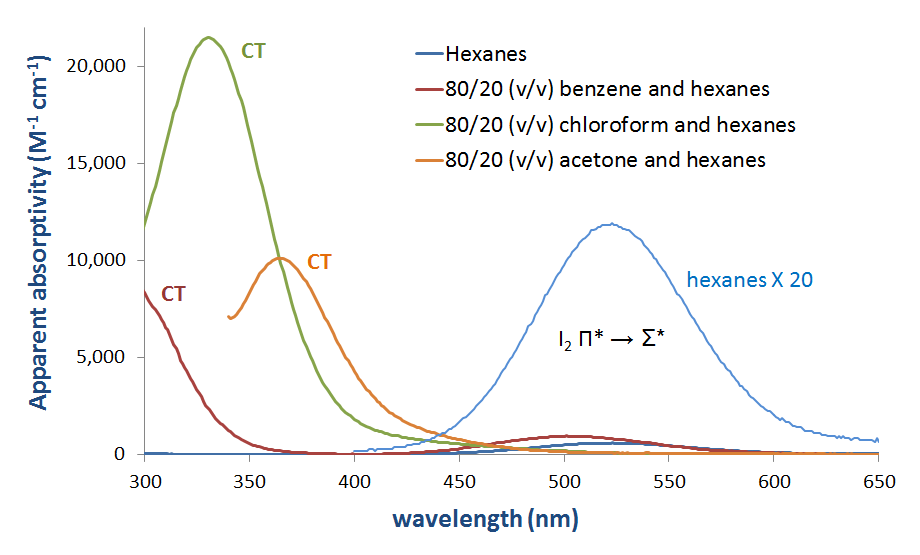
Figura 6.4.2.\ (\PageIndex{3}\). Spettro di assorbimento dello iodio molecolare (I2) in vari solventi che mostrano l’aspetto di una banda CT nei solventi donatori.*
In linea di principio, le energie sia del trasferimento di carica che delle transizioni \(I_2~\pi *~\rightarrow ~D-A~ \sigma *\) aumentano entrambe con la forza del donatore, come mostrato nella Figura 6.4.2.4.
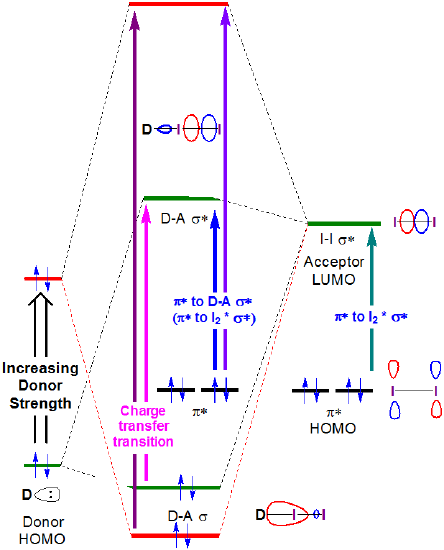
Figura 6.4.2.\ (\PageIndex{4}\). Cambiamento previsto nelle energie orbitali di frontiera associate alla formazione del complesso accettore donatore I2 quando l’energia HOMO del donatore viene aumentata.
Come si può vedere nella Figura 6.4.2. ci si potrebbe aspettare che l’energia della banda di trasferimento della carica aumenti man mano che l’HOMO donatore aumenta di energia per avvicinarsi di energia all’accettore LUMO. Sebbene si debba prestare attenzione nell’interpretazione degli spettri di fase di soluzione di I2, questa aspettativa è confermata da un’analisi superficiale e qualitativa degli spettri nella Figura 6.4.2.3. L’energia di transizione CT si sposta verso lunghezze d’onda inferiori (e quindi energia più elevata) mentre l’energia orbitale atomica più alta occupata per l’atomo donatore aumenta passando dall’acetone (ossigeno, -15,85 eV) al cloroformio (cloro, -13,67 eV) e infine al benzene (carbonio, -10.66 eV).**
Le bande di trasferimento di carica nella chimica dei metalli di transizione
Le transizioni di trasferimento di carica sono responsabili del colore intenso di molti complessi di metalli di transizione. In questi casi, tuttavia, la debole interazione acido-base di Lewis comporta la donazione e l’accettazione di elettroni incompleti in un legame \(p \pi-d \pi\) (o \(p\pi-d\pi*\)) tra un metallo e un ligando. Le bande di trasferimento di carica negli spettri di assorbimento di questi complessi comportano il trasferimento di elettroni tra il metallo e il ligando. In particolare, le bande
- Metal to ligand charge transfer (MLCT o CTTL) implicano il trasferimento di un elettrone da un orbitale metallico d riempito o parzialmente riempito a un orbitale di tipo ligando \(\pi*\).

- Le bande di trasferimento di carica da ligando a metallo (LMCT o CTTL) implicano il trasferimento di un elettrone da un ligando orbitale pieno o parzialmente riempito a un metallo d-orbitale.

- Le bande di trasferimento di carica da metallo a metallo possono essere osservate in alcuni complessi bimetallici. Tuttavia, questi sono solitamente pensati solo come un trasferimento di elettroni che come uno spostamento nello stato di un’interazione acido-base di Lewis.
Poiché le bande di trasferimento di carica del legante metallico implicano il trasferimento intermolecolare di elettroni tra il metallo e il legante per generare uno stato redox ad alta energia, lo stato eccitato CT è sia un ossidante migliore che un riducente rispetto allo stato fondamentale. Di conseguenza vi è stata un’intensa ricerca nello sviluppo di complessi metallici i cui stati eccitati di trasferimento di carica sono potenti ossidanti e riduttanti nell’aspettativa che siano in grado di guidare l’ossidazione fotocatalitica e la riduzione dei substrati.
* L’assorbimento apparente di I2 negli esani è stato calcolato dallo spettro di assorbimento di 215 µM I2 negli esani. Tutti gli altri assorbimenti apparenti sono stati calcolati da spettri di assorbimento di soluzioni che erano 44 µM in I2.
** Le posizioni di banda non sono le energie di banda CT e le energie HOMO date sono livelli di energia atomica e non corrispondono necessariamente all’HOMO del donatore in soluzione. A causa di questa e di altre semplificazioni questa analisi non è destinata a sostituire una rigorosa analisi computazionale dei fattori che danno origine a posizioni di banda CT.
1. Meyerstein, D.; Treinin, A., complessi di trasferimento di carica di iodio e anioni inorganici in soluzione. Transazioni della Società Faraday 1963, 59 (0), 1114-1120.
2. Baskar, A. J. A.; Rajpurohit, A. S.; Panneerselvam, M.; Jaccobb, M.; RoopSingh, D.; Kannappan, V., Analisi sperimentale e teorica dell’effetto sostituente sui complessi di trasferimento di carica di iodio e alcuni alchilbenzeni in soluzione di n-esano a 303K. Raccolte di dati chimici 2017, 7-8, 80-92.
