Obiettivi formativi
- Scrivi la formula chimica per un composto ionico semplice.
- Riconoscere gli ioni poliatomici nelle formule chimiche.
Abbiamo già incontrato alcune formule chimiche per semplici composti ionici. Una formula chimica è un elenco conciso degli elementi in un composto e dei rapporti di questi elementi. Per capire meglio cosa significa una formula chimica, dobbiamo considerare come un composto ionico è costruito dai suoi ioni.
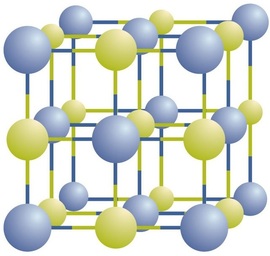
I composti ionici esistono come ioni positivi e negativi alternati in array tridimensionali regolari chiamati cristalli (Figura \(\PageIndex{1}\)). Come puoi vedere, non ci sono “particelle” individuali \(\ce{NaCl}\) nell’array; invece, c’è un reticolo continuo di ioni sodio e cloruro alternati. Tuttavia, possiamo usare il rapporto tra ioni sodio e ioni cloruro, espresso nei numeri interi più bassi possibili, come un modo per descrivere il composto. Nel caso del cloruro di sodio, il rapporto tra ioni sodio e ioni cloruro, espresso in numeri interi più bassi, è 1:1, quindi usiamo\ (\ce{NaCl}\) (un\ (\ce{Na}\) simbolo e un\ (\ce{Cl}\) simbolo) per rappresentare il composto. Pertanto, \(\ce {NaCl}\) è la formula chimica per il cloruro di sodio, che è un modo conciso di descrivere il numero relativo di ioni diversi nel composto. Un campione macroscopico è composto da miriadi di coppie NaCl; ogni singola coppia chiamata unità di formula. Sebbene sia conveniente pensare che i cristalli \ (\ce{NaCl}\) siano composti da singole unità \(\ce{NaCl}\), la figura \(\PageIndex{1}\) mostra che nessun singolo ion è associato esclusivamente a qualsiasi altro singolo ion. Ogni ion è circondato da ioni di carica opposta.
La formula per un composto ionico segue diverse convenzioni. Innanzitutto, il catione è scritto prima dell’anione. Poiché la maggior parte dei metalli forma cationi e la maggior parte dei non metalli formano anioni, le formule in genere elencano prima il metallo e poi il metalloide. In secondo luogo, le accuse non sono scritte in una formula. Ricorda che in un composto ionico, le specie componenti sono ioni, non atomi neutri, anche se la formula non contiene cariche. Infine, la formula corretta per un composto ionico ha sempre una carica netta zero, il che significa che la carica positiva totale deve essere uguale alla carica negativa totale. Per determinare la formula corretta di qualsiasi combinazione di ioni, determinare quanti di ogni ion è necessario per bilanciare le cariche positive e negative totali nel composto.
Questa regola si basa in definitiva sul fatto che la materia è, nel complesso, elettricamente neutra.
Per convenzione, supponiamo che ci sia un solo atomo se un pedice non è presente. Non usiamo 1 come pedice.
Se osserviamo il composto ionico costituito da ioni litio e ioni bromuro, vediamo che lo lithium litio ha una carica 1+ e lo brom bromuro ha una carica 1. Solo uno ion di ciascuno è necessario per bilanciare queste cariche. La formula per il bromuro di litio è \(\ce {LiBr}\).
Quando un composto ionico è formato da magnesio e ossigeno, lo magnesium magnesio ha una carica 2+ e l’atomo di ossigeno ha una carica 2. Sebbene entrambi questi ioni abbiano cariche più elevate rispetto agli ioni in bromuro di litio, si bilanciano ancora l’un l’altro in un rapporto uno a uno. Pertanto, la formula corretta per questo composto ionico è \(\ce {MgO}\).
Consideriamo ora il composto ionico formato da magnesio e cloro. Uno magnesium magnesio ha una carica 2+, mentre uno chlorine cloro ha una carica 1:
\
La combinazione di uno ion di ciascuno non bilancia completamente le cariche positive e negative. Il modo più semplice per bilanciare queste cariche è assumere la presenza di due ioni cloruro per ogni magnesium magnesio:
\
Ora le cariche positive e negative sono bilanciate. Potremmo scrivere la formula chimica per questo composto ionico come \(\ce {MgClCl}\), ma la convenzione è di usare un pedice numerico quando c’è più di uno ion di un dato tipo—\(\ce{MgCl2}\). Questa formula chimica dice che ci sono uno magnesium magnesio e due ioni cloruro in questa formula. (Non leggere la parte” Cl2 ” della formula come molecola del cloro elementare biatomico. Il cloro non esiste come elemento biatomico in questo composto. Piuttosto, esiste come due singoli ioni cloruro.) Per convenzione, il rapporto di numero intero più basso è usato nelle formule dei composti ionici. La formula \(\ce {Mg2Cl4}\) ha cariche bilanciate con gli ioni in un rapporto 1:2, ma non è il rapporto numero intero più basso.
Per i composti in cui il rapporto degli ioni non è così ovvio, i pedici nella formula possono essere ottenuti incrociando le cariche: utilizzare il valore assoluto della carica su uno ion come pedice per l’altro ion. Questo metodo è mostrato schematicamente nella Figura 3.3.2.
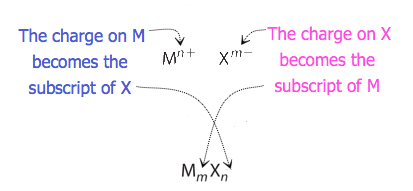
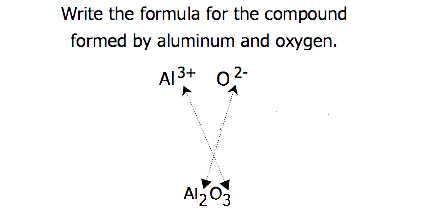
Quando si incrociano le cariche, a volte è necessario ridurre gli indici al loro rapporto più semplice per scrivere la formula empirica. Si consideri, ad esempio, il composto formato da Pb4+ e O2−. Utilizzando i valori assoluti delle cariche sugli ioni come pedici si ottiene la formula Pb2O4. Questo semplifica alla sua corretta formula empirica PbO2. La formula empirica ha uno ion Pb4+ e due ioni O2.
Esempio \(\PageIndex{1}\)
Scrivi la formula chimica per un composto ionico composto da ogni coppia di ioni.
- gli ioni di sodio e lo zolfo ioni
- l’alluminio ione e lo ione fluoruro
- 3+ ione del ferro e l’ossigeno, ioni
Soluzione
- Per ottenere un valence shell ottetto, sodio forme di uno ione con un 1+ carica, mentre lo zolfo ioni di 2− carica. Due ioni di sodio 1 + sono necessari per bilanciare la carica 2 sullo sulfur zolfo. Invece di scrivere la formula come \(\ce {NaNaS}\), la abbreviamo per convenzione in \(\ce{Na2S}\).
- Lo ion di alluminio ha una carica 3+, mentre lo fluor fluoruro formato dal fluoro ha una carica 1. Tre fluoro 1-ioni sono necessari per bilanciare il 3 + carica sullo aluminum di alluminio. Questa combinazione è scritta come \(\ce {AlF3}\).
- Il ferro può formare due possibili ioni, ma lo ion con una carica 3+ è specificato qui. L’atomo di ossigeno ha una carica 2 come ion. Per bilanciare le cariche positive e negative, guardiamo al minimo comune multiplo-6: due ioni di ferro 3 + daranno 6+, mentre tre ioni di ossigeno 2 daranno 6−, bilanciando così le cariche positive e negative complessive. Quindi, la formula per questo composto ionico è \(\ce {Fe2O3}\). In alternativa, utilizzare il metodo delle spese di attraversamento mostrato nella Figura 3.3.2.
Esercizio \(\PageIndex{1}\)
Scrivi la formula chimica per un composto ionico composto da ciascuna coppia di ioni.
- lo calcium calcio e lo oxygen ossigeno
- il 2+ copper rame e lo sulfur zolfo
- il 1+ copper rame e lo sulfur zolfo
Risposta a:
CaO
Risposta b:
CuS
Risposta c:
Cu2S
Ioni poliatomici
Alcuni ioni sono costituiti da gruppi di atomi legati covalentemente insieme e hanno una carica elettrica complessiva. Poiché questi ioni contengono più di un atomo, sono chiamati ioni poliatomici. Le strutture di Lewis, i nomi e le formule di alcuni ioni poliatomici si trovano nella Tabella 3.3.1.
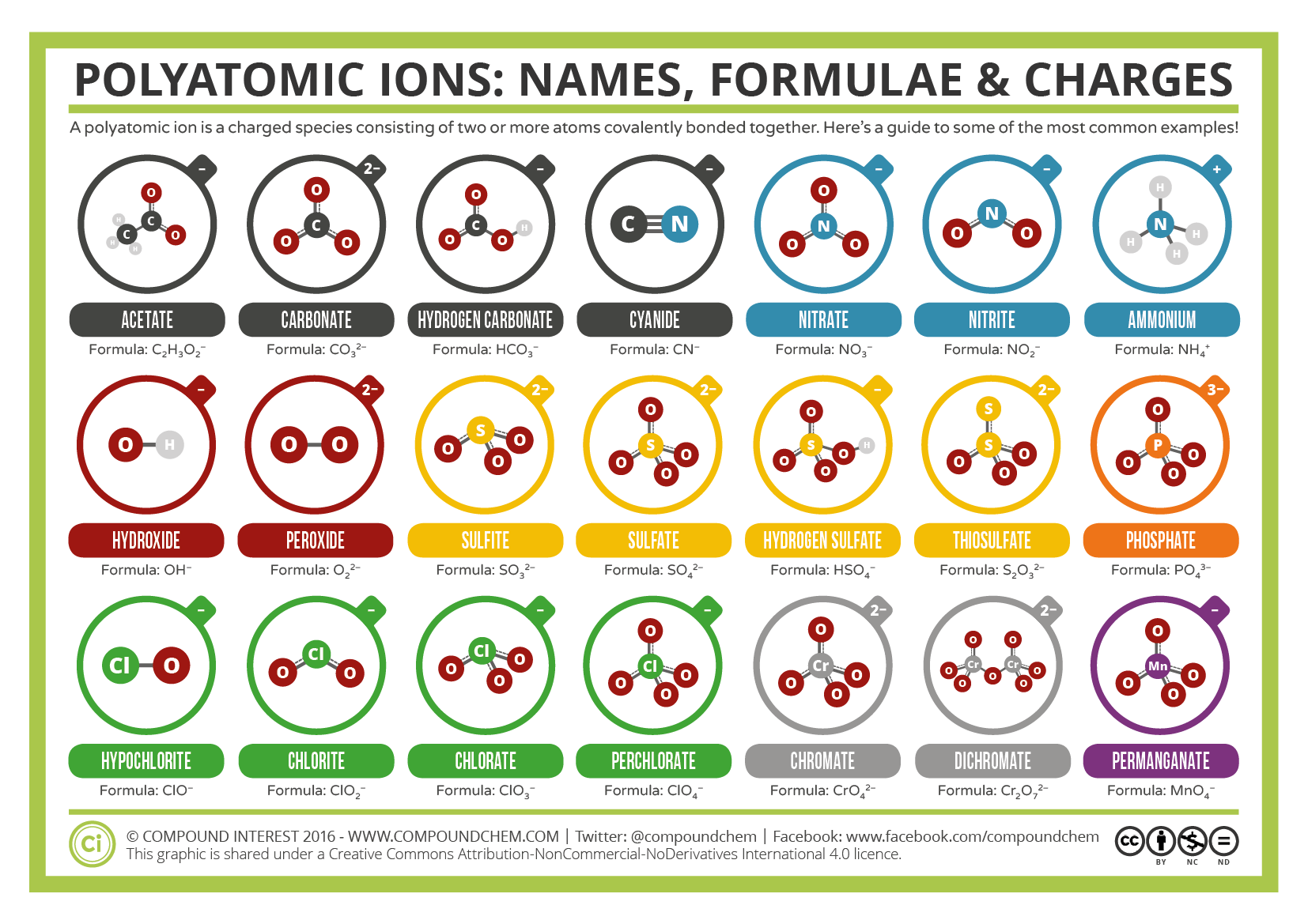
Tabella \(\PageIndex{1}\): Alcuni ioni poliatomici
hanno definito formule, nomi e cariche che non possono essere modificate in alcun modo. Tabella \(\PageIndex{2}\) elenca i nomi di ioni e le formule di ioni degli ioni poliatomici più comuni. Ad esempio, \(\ce{NO3^{−}}\) è lo ion nitrato; ha un atomo di azoto e tre atomi di ossigeno e una carica complessiva di 1. La figura \(\PageIndex{2}\) elenca gli ioni poliatomici più comuni.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Gli ioni poliatomici rimanenti sono tutti caricati negativamente e, quindi, sono classificati come anioni. Tuttavia, solo due di questi, lo hydroxide idrossido e lo cyan cianuro, sono chiamati usando il suffisso “-ide” che è tipicamente indicativo di particelle caricate negativamente. I restanti anioni poliatomici, che contengono tutti ossigeno, in combinazione con un altro non metallo, esistono come parte di una serie in cui il numero di ossigeni all’interno dell’unità poliatomica può variare. Come è stato ripetutamente sottolineato in diverse sezioni di questo testo, non ci sono due formule chimiche dovrebbero condividere un nome chimico comune. Un singolo suffisso,” – ide”, è insufficiente per distinguere i nomi degli anioni in una serie poliatomica correlata. Pertanto, i suffissi”- ate “e”- ite ” sono impiegati, per indicare che i corrispondenti ioni poliatomici fanno parte di una serie. Inoltre, questi suffissi indicano anche il numero relativo di ossigeni che sono contenuti all’interno degli ioni poliatomici. Si noti che tutti gli ioni poliatomici i cui nomi terminano in” – ate ” contengono un ossigeno in più di quegli anioni poliatomici i cui nomi terminano in “-ite.”Sfortunatamente, proprio come il sistema comune per la denominazione dei metalli di transizione, questi suffissi indicano solo il numero relativo di ossigeni contenuti negli ioni poliatomici. Ad esempio, lo nitrate nitrato, che è simboleggiato come NO3−1, ha un altro ossigeno rispetto allo nit nitrito, che è simboleggiato come NO2−1. Tuttavia, lo sulfate solfato è simboleggiato come SO4-2. Mentre sia lo nitrate nitrato che lo sulfate solfato condividono un suffisso” – ate”, il primo contiene tre ossigeni, ma il secondo ne contiene quattro. Inoltre, sia lo nitrate nitrato che lo sulf solfito contengono tre ossigeni, ma questi ioni poliatomici non condividono un suffisso comune. Sfortunatamente, la natura relativa di questi suffissi impone che le combinazioni di formula ion/nome ionico degli ioni poliatomici debbano semplicemente essere memorizzate.
La regola per la costruzione di formule per composti ionici contenenti ioni poliatomici è la stessa delle formule contenenti ioni monatomici (singolo atomo): le cariche positive e negative devono bilanciarsi. Se è necessario più di uno di un particolare ion poliatomico per bilanciare la carica, l’intera formula per lo poly poliatomico deve essere racchiusa tra parentesi e il pedice numerico è posto al di fuori delle parentesi. Questo per mostrare che il pedice si applica all’intero ion poliatomico. Di seguito sono riportati due esempi:

Esempio \(\PageIndex{2}\)
Scrivi la formula chimica per un composto ionico composto da ciascuna coppia di ioni.
- lo potassium potassio e lo sulfate solfato
- lo ion calcio e lo ion nitrato
Soluzione
- Gli ioni potassio hanno una carica di 1+, mentre gli ioni solfato hanno una carica di 2−. Avremo bisogno di due ioni di potassio per bilanciare la carica sullo sulfate solfato, quindi la formula chimica corretta è \(\ce {K_2SO_4}\).
- Gli ioni calcio hanno una carica di 2+, mentre gli ioni nitrati hanno una carica di 1 -. Avremo bisogno di due ioni nitrati per bilanciare la carica su ogni ion calcio. La formula per il nitrato deve essere racchiusa tra parentesi. Quindi, scriviamo \(\ce {Ca(NO3)2}\) come formula per questo composto ionico.
Esercizio \(\PageIndex{2}\)
Scrivi la formula chimica per un composto ionico composto da ciascuna coppia di ioni.
- lo ione magnesio e carbonato di ioni
- l’alluminio ione e lo ione acetato
Risposta:
Mg2+ e CO32- = MgCO3
Risposta b:
Al3+ e C2H3O2- = Al(C2H3O2)3
Riconoscere Composti Ionici
Ci sono due modi per riconoscere i composti ionici. Innanzitutto, i composti tra elementi metallici e non metallici sono solitamente ionici. Ad esempio, CaBr2 contiene un elemento metallico (calcio, un metallo del gruppo 2A) e un elemento non metallico (bromo, un metalloide del gruppo 7A). Pertanto, è molto probabilmente un composto ionico. (In realtà, è ionico.) Al contrario, il composto NO2 contiene due elementi che sono entrambi non metallici (azoto, dal gruppo 5A, e ossigeno, dal gruppo 6A). Non è un composto ionico; appartiene alla categoria dei composti covalenti discutere altrove. Si noti inoltre che questa combinazione di azoto e ossigeno non ha alcuna carica elettrica specificata, quindi non è lo nit nitrito.
In secondo luogo, se si riconosce la formula di uno poly poliatomico in un composto, il composto è ionico. Ad esempio, se vedi la formula \(\ce{Ba(NO3)2}\), puoi riconoscere la parte “NO3” come ion nitrato, \(\rm{NO_3^−}\). (Ricorda che la convenzione per scrivere formule per composti ionici non deve includere la carica ionica.) Questo è un indizio che l’altra parte della formula, \(\ce{Ba}\), è in realtà lo ion \(\ce{Ba^{2+}}\), con la carica 2+ che bilancia la carica 2 complessiva dai due ioni nitrati. Quindi, questo composto è anche ionico.
Esempio \(\PageIndex{3}\)
Identifica ogni composto come ionico o non ionico.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{2}\)
Soluzione
- Sodio è un metallo e l’ossigeno è un metalloide; quindi \(\ce{Na2O}\) è previsto per essere ionica.
- Sia il fosforo che il cloro sono non metalli. Pertanto, \(\ce {PCl3}\) non è ionico.
- Il \(\ce {NH4}\) nella formula rappresenta lo ammonium ammonio, \(\ce {NH4 ^ {+}}\), che indica che questo composto è ionico.
- Sia l’ossigeno che il fluoro sono non metalli. Pertanto, \(\ce {OF2}\) non è ionico.
Esercizio \(\PageIndex{3}\)
Identifica ogni composto come ionico o non ionico.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3PO4}\)
- \(\ce{SOCl2}\)
Rispondere:
non ionici
Risposta b:
ionico
Risposta c:
ionico
Risposta d:
non ionico
Guardando più da vicino: Sangue e acqua di mare
La scienza ha da tempo riconosciuto che il sangue e l’acqua di mare hanno composizioni simili. Dopo tutto, entrambi i liquidi hanno composti ionici disciolti in essi. La somiglianza potrebbe essere più di una semplice coincidenza; molti scienziati pensano che le prime forme di vita sulla Terra siano sorte negli oceani. Uno sguardo più attento, tuttavia, mostra che il sangue e l’acqua di mare sono molto diversi. Una soluzione allo 0,9% di cloruro di sodio si avvicina alla concentrazione di sale trovata nel sangue. Al contrario, l’acqua di mare è principalmente una soluzione di cloruro di sodio al 3%, oltre tre volte la concentrazione nel sangue. Ecco un confronto tra la quantità di ioni nel sangue e l’acqua di mare:
| Ione | Percentuale nell’acqua di mare | per Cento nel Sangue |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Questa differenza è significativa perché lo hydrogen idrogeno carbonato e alcuni ioni correlati hanno un ruolo cruciale nel controllo delle proprietà acido-base del sangue. La quantità di ioni idrogeno fosfato−\(\ce{HPO4^{2−}}\) e \(\ce{H2PO4^{—}}\) – nell’acqua di mare è molto bassa, ma sono presenti in quantità maggiori nel sangue, dove influenzano anche le proprietà acido-base. Un’altra differenza notevole è che il sangue non ha quantità significative dello sulfate solfato (\(\ce {SO4^{2−}}\)), ma questo ion è presente nell’acqua di mare.
Key Takeaways
- Le formule chimiche appropriate per i composti ionici bilanciano la carica positiva totale con la carica negativa totale.
- Esistono anche gruppi di atomi con una carica complessiva, chiamati ioni poliatomici.
ESERCIZI
-
Quali informazioni sono contenute nella formula di un composto ionico?
-
Perché le formule chimiche per alcuni composti ionici contengono pedici, mentre altri no?
3. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- Mg2 + e I –
- Na + e O2 –
4. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- Na+ e Br−
- Mg2+ e Br−
- Mg2+ e S2−
5. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- K+ e Cl−
- Mg2+ e Cl−
- Mg2+ e Se2−
6. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- Na+ e N3−
- Mg2+ e N3−
- Al3+ e S2−
7. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- Li+ e N3−
- Mg2+ e P3−
- Li + e P3−
8. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- Fe3+ e Br−
- Fe2+ e Br−
- Au3+ e S2−
- Au+ e S2−
9. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- Cr3+ e O2−
- Cr2+ e O2−
- Pb2+ e Cl−
- Pb4+ e Cl−
10. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- Cr3+ e NO3−
- Fe2+ e PO43−
- Ca2+ e CrO42−
- Al3+ e OH−
11. Scrivi la formula chimica per il composto ionico formato da ogni coppia di ioni.
- NH4+ e NO3−
- H+ e Cr2O72−
- Cu+ e CO32−
- Na+ e HCO3−
12. Per ogni coppia di elementi, determinare la carica per i loro ioni e scrivere la formula corretta per il composto ionico risultante tra di loro.
- Ba e S
- Cs e I
13. Per ogni coppia di elementi, determinare la carica per i loro ioni e scrivere la formula corretta per il composto ionico risultante tra di loro.
- K e S
- Sc e Br
14. Quali composti prevederesti di essere ionici?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Quali composti prevederesti di essere ionici?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
Risposte
1. il rapporto di ogni tipo di ion nel composto
2. A volte è necessario più di uno ion per bilanciare la carica sull’altro ion in un composto ionico.
- MgI2
- Na2O
- NaBr
- MgBr2
- MgS
- KCl
- MgCl2
- MgSe
- Na3N
- Mg3N2
- Al2S3
- Li3N
- Mg3P2
- Li3P
- FeBr3
- FeBr2
- Au2S3
- Au2S
- Cr2O3
- CrO
- PbCl2
- PbCl4
- Cr(NO3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- H2Cr2O7
- Cu2CO3
- NaHCO3
- Ba2+, S2−, BaS
- Cs+, I−, CsI
- K+, S2−, K2S
- Sc3+, Br−, ScBr3
- ionic
- ionic
- not ionic
- ionic
- not ionic
- not ionic
- ionico
non ionico non ionico - ionico
non ionico non ionico
