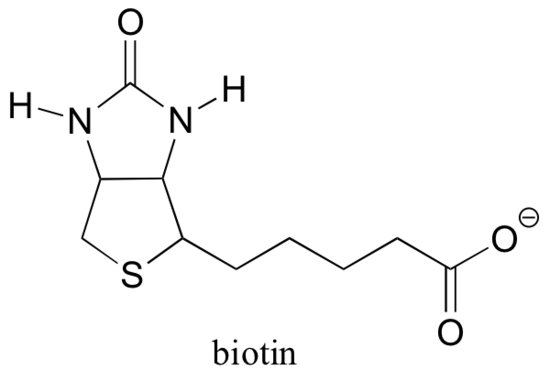
13.5 D: la Biotina è un di CO2 di trasporto di coenzima
Richiamare dalla sezione 6.5 B che molti enzimi sono dipendenti l’assistenza di coenzimi, che sono piccoli (relativa alla proteina) molecole organiche che si legano covalentemente o di non-legame covalente – in un sito attivo dell’enzima e l’aiutano a catalizzare la sua reazione. S-adenosilmetionina (SAM, sezione 9.1 A) e ATP (sezione 10.2) sono due esempi che abbiamo incontrato finora, e vedremo molti altri nei capitoli a venire. Sebbene Rubisco (descritto nella parte B di questa sezione) sia un’eccezione, la maggior parte degli enzimi che catalizzano le reazioni di carbossilazione dipendono da un coenzima chiamato biotina, che funge da vettore temporaneo di anidride carbonica.
La piruvato carbossilasi, l’enzima che catalizza il primo passo della via gluconeogensis, è un buon esempio di reazione di carbossilazione biotina-dipendente. Si noti che la CO2 in questa reazione è derivata dal bicarbonato, a differenza della reazione di Rubisco in cui la CO2 è “fissa” direttamente dall’atmosfera.

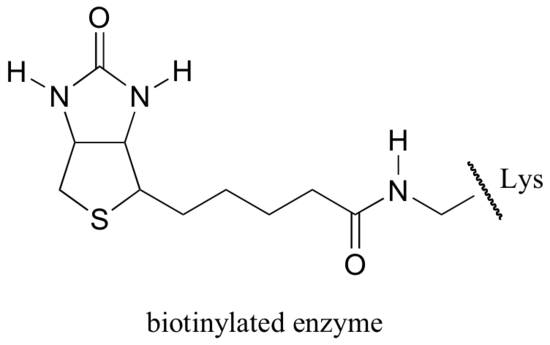
La biotina è legata covalentemente all’enzima attraverso un legame ammidico con una lisina in sito attivo.
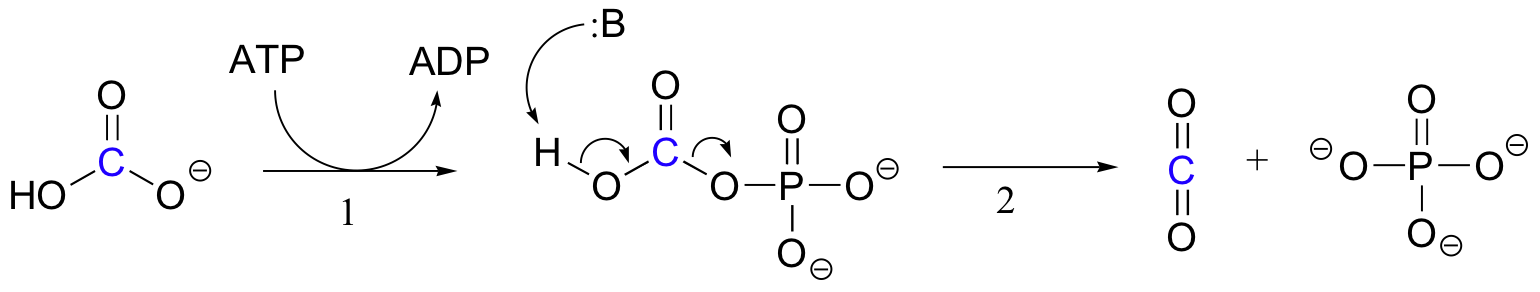
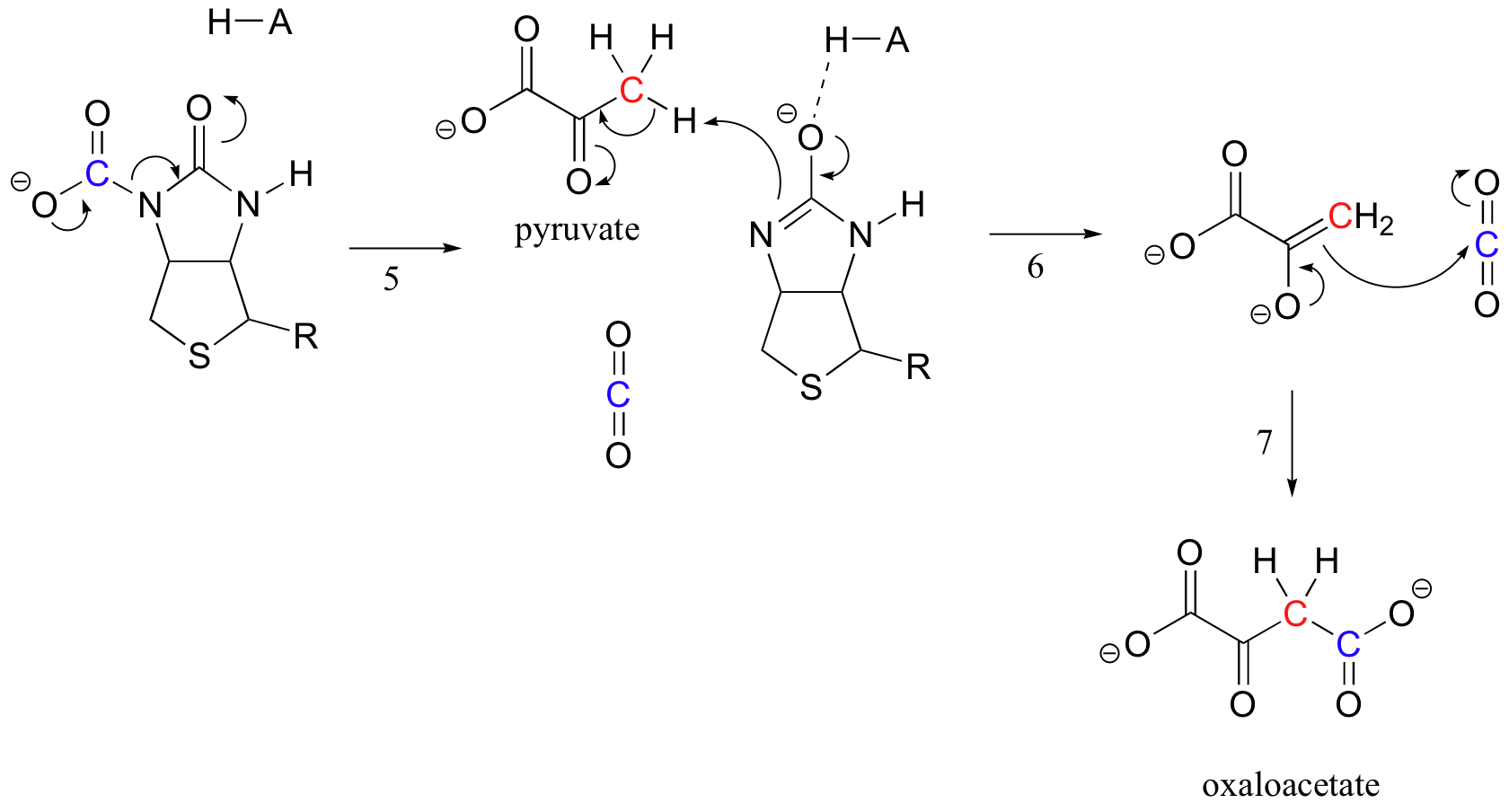
L’esatto meccanismo con cui operano le reazioni di carbossilazione dipendenti dalla biotina non è ancora completamente compreso, tuttavia il seguente è un quadro probabile. In primo luogo, lo bic bicarbonato viene fosforilato dall’ATP (fase 1, vedere sezione 10.2), e quindi viene attivato per la decarbossilazione, che genera CO2 libera (fase 2).
Il compito della biotina è quello di mantenere la molecola di anidride carbonica fino a quando il piruvato non entra nel sito attivo. La carbossilazione della biotina comporta la deprotonazione dell’azoto ammidico per formare un intermedio simile all’enolato (fase 3-le ammidi hanno un pKa di circa 17, e questo viene abbassato dalla presenza di un acido sito attivo vicino all’ossigeno). Questo passaggio è seguito dall’attacco dell’azoto nucleofilo sull’anidride carbonica per formare l’enzima carbossibiotinilato (fase 4).
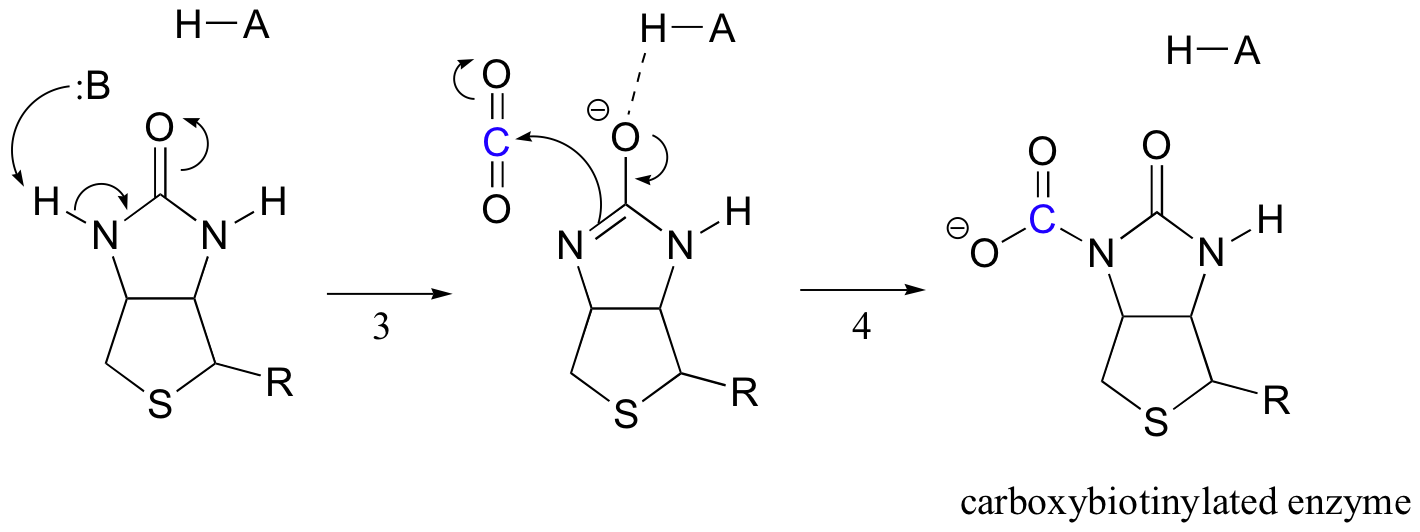
Quando una molecola di piruvato lega, riassetto dell’architettura del sito attivo provoca il passaggio precedente per andare in reverse (passaggio 5), liberando CO2 e di generare una base di biotina per deprotonate alfa-carbonio di piruvato in modo che si può condensare in un’dell’aldolo come la moda, con emissioni di CO2 per formare ossalacetato (punti 6-7).
Se hai studiato un po ‘di biochimica, potresti aver sentito parlare di biotina in un contesto un po’ diverso da quello discusso in questa sezione. Una proteina chiamata avidina, che si trova in abbondanza nel bianco d’uovo, si lega in modo non covalente ed estremamente stretto alla biotina (infatti, avidina-biotina è la coppia di legame proteina-ligando più stretta nota alla scienza). I biochimici spesso fanno uso di questa proprietà collegando covalentemente una biomolecola di interesse alla biotina. Le specie “biotinilate” possono quindi essere facilmente isolate da una miscela complessa facendo scorrere la miscela attraverso una “colonna di affinità” rivestita di avidina.
