Ci sono un certo numero di modi in cui una cellula può spostarsi da un punto nello spazio ad un altro. In un mezzo liquido, questo metodo può essere una sorta di nuoto, utilizzando il movimento ciliare o flagellare per spingere la cellula. Su superfici solide, questi meccanismi chiaramente non funzioneranno in modo efficiente e la cellula subisce un processo di scansione. In questa sezione, iniziamo con una discussione sul movimento ciliare / flagellare, e quindi consideriamo i requisiti più complicati della scansione cellulare.
Ciglia e flagelli, che differiscono principalmente per lunghezza piuttosto che per costruzione, sono organelli a base di microtubuli che si muovono con un movimento avanti e indietro. Questo si traduce in ” canottaggio” dalle ciglia relativamente corte, ma nei flagelli più lunghi, la flessibilità della struttura fa sì che il movimento avanti e indietro sia propagato come un’onda, quindi il movimento flagellare è più ondulato o simile a un colpo di frusta (considera cosa succede quando muovi rapidamente un tubo da giardino da un lato all’altro rispetto a un pezzo corto Il nucleo di entrambe le strutture è chiamato assonema, che è composto da 9 doppietti microtubuli collegati tra loro da proteine motorie della dineina ciliare e circonda un nucleo centrale di due microtubuli separati.
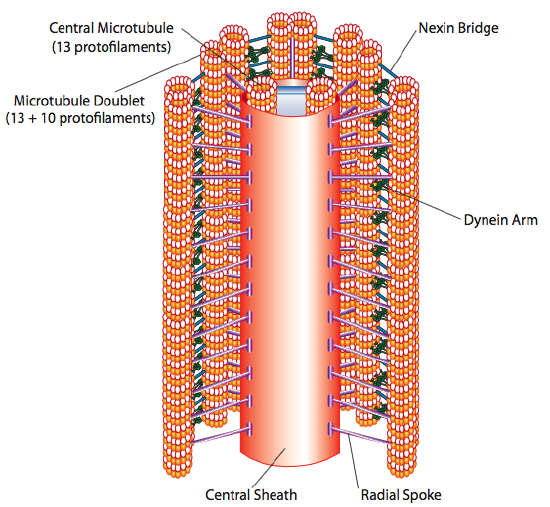
Questa è nota come formazione “9+2”, sebbene i nove doppietti non siano uguali ai due microtubuli centrali. Il tubulo A è un completo 13-protofilamenti, ma il tubulo B fuso ad esso contiene solo 10 protofilamenti. Ciascuno dei microtubuli centrali è un pieno 13 protofilamenti. L’assonema 9 + 2 estende la lunghezza del ciglio o flagello dalla punta fino a raggiungere la base e si collega al corpo cellulare attraverso un corpo basale, che è composto da 9 terzine di microtubuli disposte in una canna corta, proprio come i centrioli da cui sono derivati.
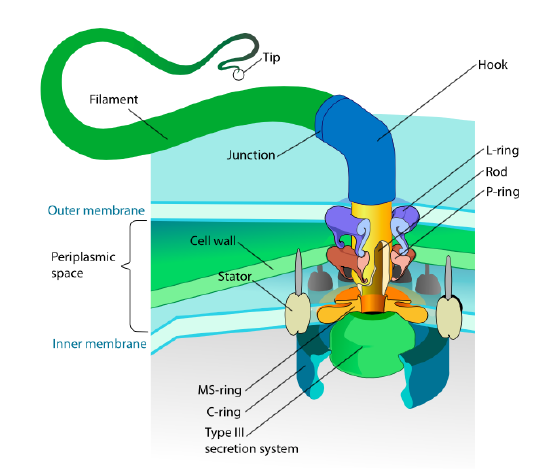
Questa sezione si riferisce solo agli eucarioti. Alcuni procarioti hanno anche appendici mobili chiamate flagelli, ma sono completamente diversi sia nella struttura che nel meccanismo. I flagelli stessi sono lunghi polimeri elicoidali della proteina flagellina e la base delle fibre flagelliniche è collegata a una proteina motoria rotazionale, non a un motore traslazionale. Questo motore (Figura \(\PageIndex{18}\)) utilizza ioni (H + o Na + a seconda della specie) lungo un gradiente elettrochimico per fornire l’energia per ruotare fino a 100000 giri al minuto. Si pensa che la rotazione sia guidata da cambiamenti conformazionali nell’anello dello statore, incastonato nella membrana cellulare.
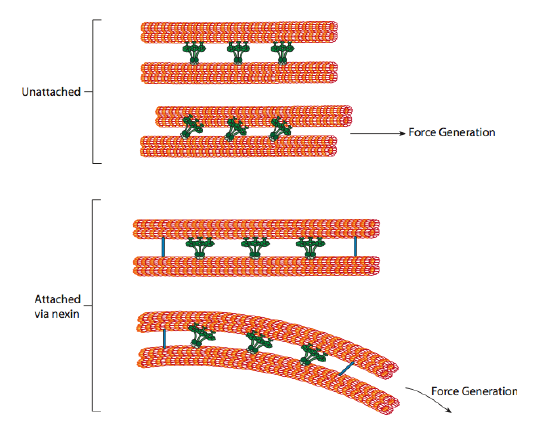
Le dyneine ciliari forniscono la capacità motoria, ma ci sono anche altre due proteine di legame nell’assonema. Ci sono nexins che uniscono l’A-tubulo di un doppietto al B-tubulo del suo doppietto adiacente, collegando così l’anello esterno. E, ci sono raggi radiali che si estendono dal tubulo di ogni doppietto alla coppia centrale di microtubuli al centro dell’assonema. Nessuno di questi ha alcuna attività motoria. Tuttavia, sono cruciali per il movimento di ciglia e flagelli perché aiutano a trasformare un movimento scorrevole in un movimento di flessione. Quando la dineina ciliare (molto simile alle dine citoplasmatiche ma ha tre teste invece di due) è impegnata, lega un microtubulo A su un lato, un microtubulo B dal doppietto adiacente e si muove uno rispetto all’altro. Una linea di queste dynein che si muovono in concerto farebbe quindi scorrere un doppietto rispetto all’altro, se (ed è un grande “se”) i due doppietti avessero completa libertà di movimento. Tuttavia, poiché i doppietti sono interconnessi dalle proteine nexin, ciò che accade quando un doppietto tenta di scivolare è che piega invece la struttura connessa (Figura \(\PageIndex{17}\)). Questa curva rappresenta il movimento di voga delle ciglia, che sono relativamente brevi, così come il movimento di frustata dei flagelli lunghi, che propagano il movimento di flessione lungo l’assonema.
Sebbene pensiamo al movimento ciliare e flagellare come metodi per la propulsione di una cellula, come il nuoto flagellare dello sperma verso un uovo, ci sono anche un certo numero di punti importanti in cui la cellula è stazionaria e le ciglia sono usate per spostare il fluido oltre la cellula. In realtà, ci sono cellule con ciglia nella maggior parte dei principali organi del corpo. Sono state riportate diverse discinesie ciliari, di cui la discinesia ciliare primaria più prominente (PCD), che include la sindrome di Kartagener (KS), è dovuta alla mutazione del gene DNAI1, che codifica una subunità (catena intermedia 1) della dineina assonemica (ciliare). La PCD è caratterizzata da distress respiratorio dovuto l’infezione ricorrente e la diagnosi di KS è fatta se c’è anche situs inversus, una circostanza in cui l’asimmetria sinistra-destra normale del corpo (per esempio stomaco a sinistra, fegato a destra) è invertita. Il primo sintomo è dovuto all’inattività delle numerose ciglia delle cellule epiteliali nei polmoni. La loro normale funzione è quella di mantenere il muco nella traccia respiratoria costantemente in movimento. Normalmente il muco aiuta a mantenere i polmoni umidi per facilitare la funzione, ma se il muco diventa stazionario, diventa un terreno fertile per i batteri, oltre a diventare un irritante e un ostacolo al corretto scambio di gas.
Situs inversus è una malformazione interessante perché si presenta nello sviluppo embrionale e colpisce solo il 50% dei pazienti con PCD perché la funzione ciliare compromessa causa la randomizzazione dell’asimmetria sinistra-destra, non l’inversione. In termini molto semplici, durante lo sviluppo embrionale iniziale, l’asimmetria sinistra-destra è dovuta in parte al movimento di segnali molecolari in un usso verso sinistra attraverso il nodo embrionale. Questo flusso è causato dal battito coordinato delle ciglia, quindi quando non funzionano, il flusso viene interrotto e si verifica la randomizzazione.
Altri sintomi dei pazienti con PCD sottolineano anche il lavoro delle ciglia e dei flagelli nel corpo. L’infertilità maschile è comune a causa dello sperma immotile. L’infertilità femminile, anche se meno comune, può anche verificarsi, a causa della disfunzione delle ciglia dell’ovidotto e delle tube di Falloppio che normalmente spostano l’uovo dall’ovaio all’utero. È interessante notare che c’è anche una bassa associazione di idrocefalo internus (riempimento eccessivo dei ventricoli del cervello con liquido cerebrospinale, causando il loro allargamento che comprime il tessuto cerebrale intorno a loro) con PCD. Ciò è probabilmente dovuto alla disfunzione delle ciglia nelle cellule ependimali che rivestono i ventricoli e che aiutano a far circolare il liquido cerebrospinale, ma apparentemente non sono completamente necessarie. Poiché il flusso di massa del CSF è pensato per essere guidato principalmente dal cambiamento di sistole / diastole nella pressione sanguigna nel cervello, alcuni ipotizzano che le ciglia possano essere coinvolte principalmente nel usso attraverso alcuni dei canali più stretti nel cervello.
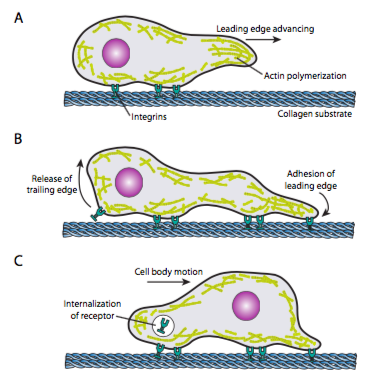
Cell crawling (Figura \(\PageIndex{19}\)) richiede il riarrangiamento coordinato della rete di microfilamenti del bordo d’attacco, estendendo (sia mediante polimerizzazione che filamenti scorrevoli) e formando quindi aderenze nel nuovo punto più avanti. Questo può assumere la forma di filopodia o lamellipodia, e spesso entrambi contemporaneamente. I filopodi sono proiezioni lunghe e molto sottili con fasci di nucleo di microfilamenti paralleli e alte concentrazioni di recettori superficiali cellulari. Il loro scopo è principalmente quello di percepire l’ambiente. Lamellipodia spesso si estendono tra due lopodia ed è più di un ampio volant di un dito. Internamente l’actina si forma più in maglie che in fasci e il bordo più ampio consente di effettuare più aderenze al substrato. La rete di microfilamenti si riorganizza nuovamente, questa volta aprendo uno spazio nel citoplasma che funge da canale per il movimento dei microtubuli verso la parte anteriore della cellula. Ciò mette in atto la rete di trasporto per aiutare a spostare in avanti il materiale sfuso intracellulare. Mentre ciò accade, le vecchie aderenze sull’estremità posteriore della cellula vengono rilasciate. Questo rilascio può avvenire attraverso due meccanismi primari: endocitosi del recettore o disattivazione del recettore per segnalazione/cambiamento conformazionale. Naturalmente, questa semplificazione eccessiva smentisce la complessità nel coordinare e controllare tutte queste azioni per realizzare il movimento diretto di una cellula.
Un modello di generazione della forza del microfilamento, il modello a cricchetto elastico Browniano (Mogilner e Oster, 1996), propone che a causa del moto browniano della membrana cellulare derivante da continue fluttuazioni termiche minute, i filamenti di actina che si spingono verso i bordi della membrana sono flessi a vari gradi. Se la flessione è abbastanza grande, un nuovo monomero di actina può inserirsi tra la membrana e la punta del filamento, e quando il filamento ora più lungo si flette indietro, può esercitare una maggiore spinta sulla membrana. Ovviamente un singolo filamento non genera molta forza, ma l’estensione coordinata di molti filamenti può spingere la membrana in avanti.
Una volta che una cellula riceve un segnale per muoversi, la risposta citoscheletrica iniziale è quella di polimerizzare l’actina, costruendo più microfilamenti da incorporare nel bordo d’attacco. A seconda del segnale (attraente o repulsivo), la polimerizzazione può avvenire sullo stesso lato o opposto della cellula dal punto di attivazione del recettore del segnale. Significativamente, la polimerizzazione della nuova f-actina da sola può generare una forza sufficiente per spostare la membrana in avanti, anche senza il coinvolgimento dei motori di miosina! I modelli di generazione di forza sono in discussione, ma generalmente iniziano con l’incorporazione di nuova g-actina in un filamento alla sua punta; cioè, all’interfaccia filamento-membrana. Anche se ciò potrebbe essere tecnicamente sufficiente, in una cellula viva, le miosine sono coinvolte e aiutano a spingere e organizzare i filamenti in modo direzionale per impostare il nuovo bordo d’attacco. Inoltre, alcuni filamenti e reti devono essere rapidamente recisi e nuove connessioni fatte, sia tra i filamenti che tra i filamenti e altre proteine come molecole di adesione o microtubuli.
Come viene controllata la polimerizzazione e il riarrangiamento dell’actina? I recettori che segnalano la locomozione cellulare possono avviare percorsi leggermente diversi, ma molti condividono alcuni punti in comune nell’attivazione di uno o più membri della famiglia Ras di piccole GTPASI. Queste molecole di segnalazione, come Rac, Rho e cdc42 possono essere attivate dalle tirosin chinasi del recettore (vedi RTK-Ras activation pathways, Cap. 14). Ognuno di questi ha un ruolo leggermente diverso nella motilità cellulare: l’attivazione di cdc42 conduce alla formazione di filopodia, Rac attiva una via che include Arp2 / 3 e cofilin alla formazione di lamellipodia e Rho attiva la miosina II per controllare l’adesione focale e la formazione di fibre di stress. Un diverso tipo di cascata del recettore, la cascata di segnalazione della proteina G (anche Capitolo 14), può portare all’attivazione del PLC e alla successiva scissione di PIP2 e all’aumento di Ca2+citosolico. Questi cambiamenti, come notato in precedenza, possono anche attivare la miosina II, così come gli enzimi rimodellanti gelsolin, cofilin e profilin. Ciò rompe le strutture attuali dell’actina per rendere la cellula più fluida, mentre inoltre contribuisce più g-actina per formare il nuovo citoscheletro del bordo d’attacco.
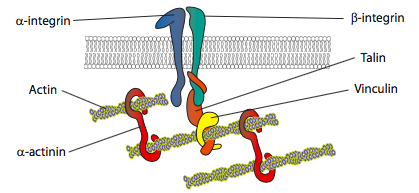
Gli esperimenti in vitro mostrano che mentre la membrana spinge in avanti, nuovi contatti adesivi sono fatti attraverso molecole di adesione o recettori che legano il substrato (spesso vetrini o piatti di coltura cellulare sono rivestiti con collagene, filaminina o altre proteine di matrice extracellulare). I contatti quindi reclutano elementi citoscheletrici per una maggiore stabilità per formare un’adesione focale (Figura \(\PageIndex{20}\)). Tuttavia, la formazione di aderenze focali sembra essere un artefatto della coltura cellulare e non è chiaro se i tipi di aderenze che si formano in vivo reclutino gli stessi tipi di componenti citoscheletrici.
Il terzo passo per locomozione cellulare è il movimento di massa del contenuto cellulare in avanti. I meccanismi per questa fase non sono chiari, ma ci sono alcune prove che usando i legami tra il citoscheletro di actina sul bordo d’attacco e le parti in avanti del citoscheletro dei microtubuli, i microtubuli vengono riorganizzati per formare un percorso di trasporto efficiente per il movimento di massa. Un altro aspetto di questo può essere un effetto “corralling” dalle reti di actina, che aprono direzionalmente lo spazio verso il bordo d’attacco. I microtubuli entrano quindi in quello spazio più facilmente che lavorare attraverso una maglia di actina stretta, forzando il flusso nella direzione corretta.
Gran parte del lavoro sulle interazioni microtubuli-actina nella motilità cellulare è stato fatto attraverso la ricerca sul cono di crescita neuronale, che a volte viene indicato come una cellula al guinzaglio, perché agisce quasi indipendentemente come una cellula strisciante, cercando il percorso corretto per condurre il suo assone dal corpo cellulare alla sua corretta connessione sinaptica (A. W. Schaefer et al, Dev. Cella 15: 146-62, 2008).
Infine, la cella deve annullare le sue vecchie aderenze sul bordo finale. Questo può accadere in diversi modi. In vitro, è stato osservato che le cellule striscianti si strappano dal substrato, lasciando piccoli frammenti di membrana e proteine di adesione associate nel processo. Si presume che la forza generata provenga dalle fibre di stress actina-miosina che portano dalle aderenze focali più in avanti. Tuttavia, ci sono meccanismi meno distruttivi disponibili per le cellule. In alcuni casi, l’adesività del recettore cellulare per il substrato extracellulare può essere regolata internamente, forse mediante fosforilazione o defosforilazione di un recettore. Un’altra possibilità è l’endocitosi del recettore, togliendolo dalla superficie cellulare. Potrebbe semplicemente riciclare fino al bordo d’attacco dove è necessario (cioè transcitosi), o se non è più necessario o danneggiato, può essere scomposto in un lisosoma.
