Az angiotenzin II a vérnyomás emelkedését okozza különböző helyeken:
- mellékvesék: az angiotenzin II fokozza az aldoszteron szteroid hormon felszabadulását, amely lokálisan fokozza a vese nátrium-visszatartását és kálium-szekrécióját. Ennek nettó hatása a vízvisszatartás, ezáltal helyreállítva a folyadék egyensúlyát.
- vesék: Az angiotenzin-II a renalis proximális tubulusokra kifejtett közvetlen hatása, valamint a glomeruláris filtrációs ráta és a renalis véráramlás befolyásolása révén növeli a nátrium retenciót is.
- cardiovascularis rendszer: az angiotenzin II egy erős endogén érösszehúzó, amely rezisztenciát okozó artériák és vénák összehúzódását okozza, emelve a vérnyomást. Továbbá az angiotenzin-II tartós emelkedése a vérerekben és a szívben egyaránt serkenti a sejtnövekedést és az ebből eredő hypertrophiát.
- központi idegrendszer: Az agyban az angiotenzin II a hátsó agyalapi mirigyre hat, stimulálva az antidiuretikus hormon (ADH, más néven arginin vazopresszin (AVP)) felszabadulását. Az ADH növeli a víz reabszorpcióját a vese gyűjtőcsatornáiban. Az angiotenzin II az agy szubfornikai szervére is hat, fokozott szomjúságot okozva, ösztönözve a vízbevitelt.
a RAAS rendszer krónikus aktiválása káros átalakulást és fokozott gyulladást okozhat a szívben, az érrendszerben és a vesékben, valamint a magas vérnyomásban és a krónikus vesebetegségben.
A kardiovaszkuláris rendszer idegi szabályozása
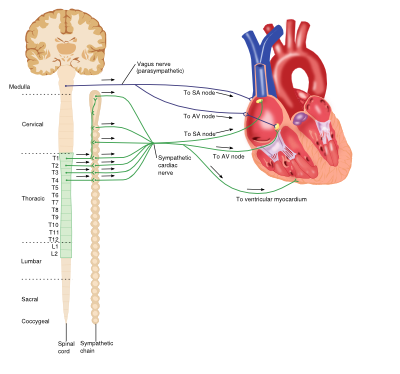
a szimpatikus és paraszimpatikus idegrendszer és a szív közötti kölcsönhatás
szimpatikus (adrenerg) idegrendszer
az adrenerg idegrendszer a test számos folyamatának létfontosságú eleme, beleértve a szív-érrendszert is. A keringő katekolaminok (pl. adrenalin és noradrenalin) a sejtmembránon lévő adrenerg receptorokhoz kötődnek és aktiválják őket. Az adrenerg receptorok a G-fehérjéhez kapcsolt receptorok egy csoportja, amelyek különféle szövetspecifikus hatásokat váltanak ki, és számos altípusban léteznek.
érrendszer
az erekben jelen lévő domináns receptor altípus az a1-adrenerg receptor, amelynek katekolamin kötéssel történő aktiválása a foszfolipáz-C (PLC), inozitol-trifoszfát (IP3), diacil-glicerin (DAG) intracelluláris jelátviteli út aktiválódását okozza. Ez végső soron myocyta összehúzódást, érszűkületet és ennek következtében a szisztémás vérnyomás emelkedését eredményezi.
szív
bár a szív myogén, vagyis a kontrakció lendülete önindított, a szív kimenetét a központi idegrendszer befolyásolja. A szimpatikus rendszer szívre gyakorolt nettó hatása a szívteljesítmény növelése. A szívben található adrenerg receptorok a CAC-receptor alcsaládba tartoznak, és magukban foglalják a CAC-1 és a CAC-3 receptorokat. A katekolamin kötődése a szívben lévő 61-receptorokhoz számos mechanizmuson keresztül növeli a szívteljesítményt: a pozitív kronotrop hatások, a pozitív inotrop hatások fokozták az automatizmust és a vezetőképességet mind a kamrai myocytákban, mind az atrioventricularis (AV) csomópontban. Azonban a 63-receptor aktiváció antagonizálja ezeket a hatásokat, negatív inotrop hatást vált ki, és beépített kontrollrendszert biztosít a szívben.
a keringés Katekolaminszintjének hosszan tartó emelkedése (pl. mellékvese tumorból vagy stresszhelyzetből történő kiválasztódás esetén) krónikus cardiovascularis problémákhoz, például hypertoniához és arrhythmiákhoz vezethet.
paraszimpatikus idegrendszer
a paraszimpatikus rendszer az acetilkolin (Ach) neurotranszmitter muszkarin receptorokhoz való kötődésén alapul, és különböző szerepet tölt be az egész testben.
érrendszer
bár a vérerek muszkarin receptorokat expresszálnak, nem kapnak kolinerg beidegzést; az exogén Ach alkalmazása azonban gyors és mély értágulatot eredményez.
szív
a muszkarin receptorok (M2-altípus) aktiválása a szívben a vagus idegből felszabaduló Ach által a szívteljesítmény csökkenését okozza az adrenerg stimulációval ellentétes hatások révén: negatív kronotrop hatások, az AV csomópont vezetőképességének csökkenése, valamint a pitvari összehúzódások erejének csökkenése.
thrombocyta/alvadási rendszer
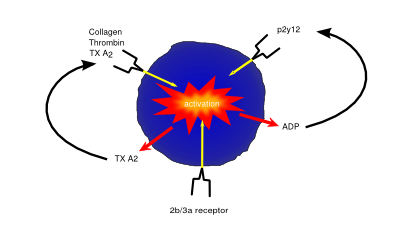
a vérlemezkék aktiválása és gátlása a vérlemezkék felszíni receptorain keresztül működik. A visszacsatolási hurkok fokozzák a vérlemezkék aktiválódását (pl. A vérlemezkék által felszabaduló ADP növeli a vérlemezke aktiválódását az ADP receptoron keresztül)
a vérlemezkék (más néven trombociták) olyan kis sejtek, amelyekben nincsenek magok, amelyek felelősek a hemosztázisért vagy a véralvadásért. A vérveszteséghez és az extracelluláris kollagén rostok expozíciójához vezető károsodást vagy sérülést észlelnek, aktiválva a vérlemezkéket. Aktiválás után a vérlemezkék tapadóvá válnak, mind a sérült érfalhoz, mind egymáshoz tapadva, sejtcsomót vagy vérrögöt képezve, segítve az ér szivárgásának gátolását. Ezután elkezdenek olyan citokineket szekretálni, amelyek ösztönzik a környező szövetekben jelen lévő fibroblasztok invázióját, amelyek állandóbb tapaszt képeznek, akár egészséges szövet létrehozásával, akár extracelluláris mátrix lerakásával heg képződéséhez.
számos olyan állapot van, amelyben a kóros véralvadás káros lehet a szervezetre; a túlzott véralvadás érrendszeri elzáródáshoz, ischaemiához vagy stroke-hoz vezethet; ritkábban a hiányos véralvadás túlzott vérveszteséghez vezethet, például hemofíliában. E betegségek leküzdésére vannak olyan gyógyszerek, amelyek modulálják az alvadási folyamatot.
antikoagulánsok
a véralvadást megakadályozó gyógyszerek (antikoagulánsok) fontosak azoknál, akiknél fokozott a véralvadás által közvetített károsodás, például stroke vagy ischaemia kockázata.
mint fájdalomcsillapító és anti-piretikus, az aszpirin egy anti-trombotikus szer, amelyet alacsony dózisban adnak azoknak, akiknek fennáll a veszélye a véralvadás károsodásának (pl. szívroham után). Az aszpirin antikoaguláns hatása a kulcsfontosságú pro-alvadási faktorok, például a prosztaglanding és a tromboxánok elnyomásából származik, a PTGS ciklooxigenáz enzim irreverzibilis inaktiválásával. Az olyan faktorok elnyomása, mint a tromboxán A2, csökkenti a thrombocyta aggregációt, és így megakadályozza a vérrögképződést.
a P2Y12 inhibitorok, mint például a klopidogrél, antikoaguláns hatásukat a thrombocyta ADP receptor P2Y12 altípusának gátlásán keresztül fejtik ki. A P2Y12 blokkolásával ezek a gyógyszerek megakadályozzák a vérlemezkék aktiválódását és a véralvadáshoz szükséges fibrinhálózat kialakulását.
az olyan gyógyszerek, mint az abciximab és a tirofibán, a glikoprotein IIb/IIIa receptor gátlása révén megakadályozzák a véralvadást, megakadályozva mind a thrombocyta aktiválódást, mind az aggregációt.
farmakokinetika
amikor gyógyszereket adnak be egy betegnek, elengedhetetlen, hogy több tényt ismerjünk a gyógyszerről a hatékonyság maximalizálása és a mellékhatások / toxicitás minimalizálása érdekében. Ezek közé tartozik az információ arról, hogy milyen adag hatásos, mennyi ideig marad a gyógyszer aktív a szervezetben, milyen gyorsan bomlik le/távolítják el a szervezetből, és milyen könnyen képes a szervezet felszívni/használni ezt a gyógyszert. Az alábbi táblázat részletezi ezeket a farmakokinetikai tulajdonságokat és azok kiszámításának módját:
| tulajdonság | leírás | Standard egységek (rövidítés) | képlet | |
|---|---|---|---|---|
| dózis | a betegnek adott aktív gyógyszer mennyisége | mg (d) | gyógyszerspecifikus (klinikai vizsgálatokból származó) | |
| koncentráció | a gyógyszer mennyisége egy adott plazmatérfogatban | GmbH/ml (C) | = d / vd | |
| EC50 | a gyógyszer koncentrációja szükséges a válasz kiváltásához félúton a nulla és a maximális válasz között. | ~ g/ml (EC50) | y = alsó + (felső-alsó)/(1+ Hill együttható) | |
| eloszlási térfogat | az elméleti térfogat, amelyet a gyógyszer elfoglalna, ha egyenletesen oszlik el a szövetekben az aktuális plazmakoncentráció kiváltása érdekében. | L (Vd) | D / C | |
| eliminációs állandó (sebesség) | a gyógyszer eltávolításának sebessége a szervezetből. | h-1 (Ke) | ln(2) / t1/2 vagy CL / Vd | |
| biohasznosulás | a beadott dózis mekkora része áll rendelkezésre a szervezet tényleges felhasználására. | nincs olyan egység, amely frakciót fejez ki (f) | 100 db (AUC (po) d (iv))/(AUC (iv) d (po))
AUC = görbe alatti terület po = orális alkalmazás iv = intravénás alkalmazás |
|
| Cmax vagy Cmin | a gyógyszer beadását követően elért maximális (Cmax) / minimális (Cmin) plazmakoncentráció | (Cmax vagy Cmin) | a plazma C közvetlen mérésével azonosítva | |
| Tmax | az az idő, amely alatt egy gyógyszer a beadást követően eléri a Cmax értéket | h (Tmax) | a plazma C közvetlen mérésével azonosítva | |
| felezési idő | az az idő, amely alatt egy gyógyszer eléri az eredeti koncentrációjának felét | h (t1/2) | ln(2) / Ke | |
| gyógyszer Clearance | a gyógyszerből egy meghatározott idő alatt kiürült plazma térfogata | l/h (CL) | vd x ke vagy D / görbe alatti terület |
gyakori gyógyszer-gyógyszer kölcsönhatások
fontos tisztában lenni az egyidejűleg alkalmazott gyógyszerek közötti kölcsönhatásokkal, mivel ezek hatással lehetnek a hatékonyságra és/vagy a toxicitásra, vagy káros mellékhatásokat okozhatnak hatások. Az ilyen kölcsönhatások befolyásolhatják például a gyógyszer felszívódását, a gyógyszer biohasznosulását vagy hatékonyságát, vagy kombinálhatják nemkívánatos metabolitok előállítását, valamint esetleg hatással lehetnek a klinikai elemzésekre. Ha két gyógyszer kombinációja csökkenti az egyik vagy mindkettő hatását, akkor az interakciót an antagonista hatás; ha azonban fordítva, két gyógyszer kombinációja fokozza az egyik vagy mindkettő hatását, akkor az interakciót szinergikus hatásnak nevezzük. A kardiovaszkuláris rendszerre ható gyógyszerek magas interaktivitással rendelkeznek, ami problémát jelent, mivel a kardiovaszkuláris betegek általában egynél több gyógyszert kapnak. Az alábbiakban felsoroljuk a kardiovaszkuláris gyógyszerekkel kapcsolatos néhány gyakori gyógyszer—gyógyszer kölcsönhatást:
| Drug | Drugs that drug action | Drugs that ↓ drug action |
|---|---|---|
| Digoxin |
|
|
| Warfarin |
|
|
| klopidogrél |
|
|
| Furosemide |
|
|
| ACE Inhibitors |
|
|
| ß-blockers |
|
|
| sztatinok |
|
számos mechanizmus létezik, amelyek révén a gyógyszereket a szervezet lebontja, általában enzimek általi lebomlás útján. A gyógyszer metabolizmusában részt vevő enzimek egyik gyakori családja a citokróm P450 (CYP) család; az enzimek nagy, változatos csoportja, amelyek ösztönzik a különféle szubsztrátok oxidációját, mindkettő endogén (pl. szteroid hormonok) és exogén (pl. toxinok és gyógyszerek). A CYP enzimek a gyógyszer metabolizmusának akár 75% – át teszik ki, segítve egyes gyógyszereket aktív vegyületeik kialakításában, de többnyire deaktiválják a gyógyszereket inaktív metabolitokká, hogy kiválasztódjanak. A CYP enzimek többféle módon befolyásolhatják a gyógyszer hatását; fokozhatják a gyógyszer anyagcseréjét (vagy fokozhatják a hatást az aktív melléktermék képződése révén, vagy csökkenthetik az aktív gyógyszer metabolizmusának hatását), vagy hatásukat gátolhatják azok a gyógyszerek, amelyek versenyeznek a CYP enzimek aktív helyéhez való hozzáférésért, megakadályozva a gyógyszer és az enzim normális kölcsönhatását. Számos gyógyszer kölcsönhatásba lép más gyógyszerekkelbeavatkozás a CYP rendszerbe. Például, ha az a gyógyszert a CYP metabolizálja, és a B gyógyszer gátolja a CYP aktivitást, az együttadás az a gyógyszer csökkent biohasznosulását eredményezi. emberben a CYP enzimcsoportnak 18 családja és 43 alcsaládja van, amelyek különböző szubsztrátokat céloznak meg. Néhány, a kardiovaszkuláris gyógyászatban fontos CYP enzim, azok kardiovaszkuláris-gyógyszer szubsztrátjai, valamint néhány kölcsönhatásuk az alábbi táblázatban látható:
| enzim | szubsztrátok (pl.) | inhibitorok (pl.) | induktorok (pl.) |
|---|---|---|---|
| C2 P2C19 |
|
|
|
| CP li > sztatinok (atorvasztatin)
|
|||
| CYP2C9 |
|
/li> |
|
| CYP2D6 |
|
|
a gyógyszer-gyógyszer kölcsönhatások mellett számos gyógyszer hatását is befolyásolja az étel vagy ital. Például ügyelni kell az alkoholfogyasztásra sokféle gyógyszer mellett, mivel ez stresszt okozhat a májban, amely már keményen dolgozik a gyógyszerek metabolizálásában a szervezetben. A grapefruitlé is problémákat okozhat, mivel ismert, hogy gátolja a CYP3a-t. a gyógyszerek és az ételek/italok közötti kölcsönhatásokról további információt ebben az útmutatóban talál: Az orvostudomány általános alkalmazása
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, B O, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T, K GmbH, Lip GY, Maggioni AP, Parkhomenko A, Pieske BM, Popescu BA, R O, N O, Schwitter J, Seferovic P, Stepinska j, Trindade PT, voors aa, Zannad F, zeiher A és az Esc gyakorlati iránymutatásokkal foglalkozó bizottsága.. Esc irányelvek az akut és krónikus szívelégtelenség diagnosztizálására és kezelésére 2012: Az Európai Kardiológiai Társaság 2012.évi akut és krónikus szívelégtelenség diagnózisával és kezelésével foglalkozó munkacsoportja. Az ESC szívelégtelenség egyesületével (HFA) együttműködve fejlesztették ki. Eur Szív J. 2012 Július; 33 (14): 1787-847. DOI: 10.1093 / eurheartj / ehs104 / PubMed azonosító:22611136
- Ryd Xhamsterl, Lindgren P, Qiao Q, Priori SG, Blanc JJ, Laakso M, Malmberg K, Ostergren J, Tuomilehto J, Thrainsdottir I, Vanhorebeek I, Stramba-Badiale M, Lindgren P, Qiao Q, Priori SG, Blanc JJ B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, B, schernthaner g, Volpe m, Wood d, munkacsoport Diabetes and cardiovascularis Diseases, az Európai Kardiológiai Társaság (ESC)., és az Európai Szövetség a cukorbetegség tanulmányozására (EASD).. Irányelvek a cukorbetegségről, a pre-diabetesről és a szív-és érrendszeri betegségekről: összefoglaló. Az Európai Kardiológiai Társaság (ESC) és az Európai Cukorbetegségkutató Szövetség (EASD) cukorbetegséggel és szív-és érrendszeri betegségekkel foglalkozó munkacsoportja. Eur Szív J. 2007 Január;28 (1): 88-136. DOI: 10.1093 / eurheartj / ehl260 / PubMed azonosító:17220161
- Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren M, Albus C, Benlian P, Boysen G, Cifkova R, Deaton C, Ebrahim S, Fisher M, Germano G, Hobbs R, Hoes A, Karadeniz S, Mezzani A, Prescott E, Ryden L, Scherer M, Syv Enterprises M, Scholte op Reimer WJ, Vrints C, wood d, zamorano jl, zannad F, európai kardiovaszkuláris megelőzési Szövetség & rehabilitáció (Eacpr). ESC Committee for Practice Guidelines (CPG).. Európai iránymutatások a szív-és érrendszeri betegségek megelőzéséről a klinikai gyakorlatban (2012-es verzió). Az Európai Kardiológiai Társaság és más társaságok ötödik közös munkacsoportja a szív-és érrendszeri betegségek megelőzésével a klinikai gyakorlatban (kilenc társaság képviselőiből és meghívott szakértőkből áll). Eur Szív J. 2012 Július; 33 (13): 1635-701. DOI: 10.1093 / eurheartj / ehs092 / PubMed ID: 22555213
- Az Európai Kardiológiai Társaság (ESC) ST-szegmens emelkedésű akut miokardiális infarktusának kezelésével foglalkozó munkacsoport., Steg PG, James SK, Gyártásának D, Badano LP, Blömstrom-Lundqvist, C, Borger ANYA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati Egy, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli M, a van ‘t Hof Egy, Widimsky P, s Zahger D. ESC-Irányelvek a menedzsment betegek akut miokardiális infarktus bemutatása, ST-szegmens emelkedést. Eur Szív J. 2012 Október; 33 (20): 2569-619. DOI: 10.1093 / eurheartj / ehs215 / PubMed azonosító:22922416
- Blomstra GmbH-Lundqvist C, Scheinman MM, Aliot EM, Alpert JS, Calkins H, Camm aj, Campbell WB, Haines DE, Kuck KH, Lerman BB, Miller DD, Shaeffer CW Jr, Stevenson WG, Tomaselli GF, Antman EM, Smith SC Jr, Alpert JS, faxon DP, Fuster V, Gibbons RJ, Gregoratos G, Hiratzka LF, Hunt sa, Jacobs ak, Russell ro Jr, priori SG, Blanc JJ, Budaj a, Burgos EF, Cowie m, Deckers JW, Garcia ma, Klein WW, Lekakis j, Lindahl B, Mazzotta G, Morais JC, Oto a, smiseth O, Trappe Hj, Amerikai Kardiológiai Főiskola., Az American Heart Association gyakorlati iránymutatásokkal foglalkozó munkacsoportja., valamint az Európai Kardiológiai Társaság gyakorlati irányelvekkel foglalkozó bizottsága. Író Bizottság a szupraventrikuláris aritmiában szenvedő betegek kezelésére vonatkozó iránymutatások kidolgozására.. ACC / AHA/ESC irányelvek a supraventricularis aritmiában szenvedő betegek kezelésére–összefoglaló: az American College of Cardiology / American Heart Association gyakorlati iránymutatásokkal foglalkozó munkacsoportjának és az Európai Kardiológiai Társaság gyakorlati iránymutatásokkal foglalkozó bizottságának jelentése (a supraventricularis aritmiában szenvedő betegek kezelésére vonatkozó iránymutatások kidolgozására szolgáló író Bizottság). Keringés. 2003. október 14;108(15): 1871-909. DOI:10.1161 / 01.CIR.0000091380.04100.84 / PubMed ID: 14557344
- Európai kardiovaszkuláris prevenciós Szövetség& rehabilitáció., Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen Úr, Wiklund O, Agewall S, Alegria E, Chapman MJ, Durrington P, Erdine S, Halcox J, Hobbs R, Kjekshus J, Filardi PP, Riccardi G, Storey RF, Wood D, és az ESC gyakorlati iránymutatásokkal foglalkozó bizottsága (CPG) 2008-2010 és 2010-2012 bizottságok.. Esc / EAS iránymutatások a dyslipidaemiák kezelésére: az Európai Kardiológiai Társaság (ESC) és az Európai Atherosclerosis Társaság (EAS) dyslipidaemiák kezelésével foglalkozó munkacsoportja. Eur Szív J. 2011 Július; 32 (14): 1769-818. DOI: 10.1093 / eurheartj / ehr158 / PubMed azonosító: 21712404
az összes Medline kivonat: PubMed
