A programozott sejthalál két típusának rövid leírása: apoptózis és autofágia
az apoptózis vagy az I. típusú programozott sejthalál a legszélesebb körben tanulmányozott a sejthalál formái közül. Morfológiai jellemzői fénymikroszkóppal azonosíthatók, beleértve a sejtek zsugorodását, a kromatin tömörítését, a citoplazmatikus membrán blabbálását, végül apoptotikus testek kialakulását (1.ábra). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
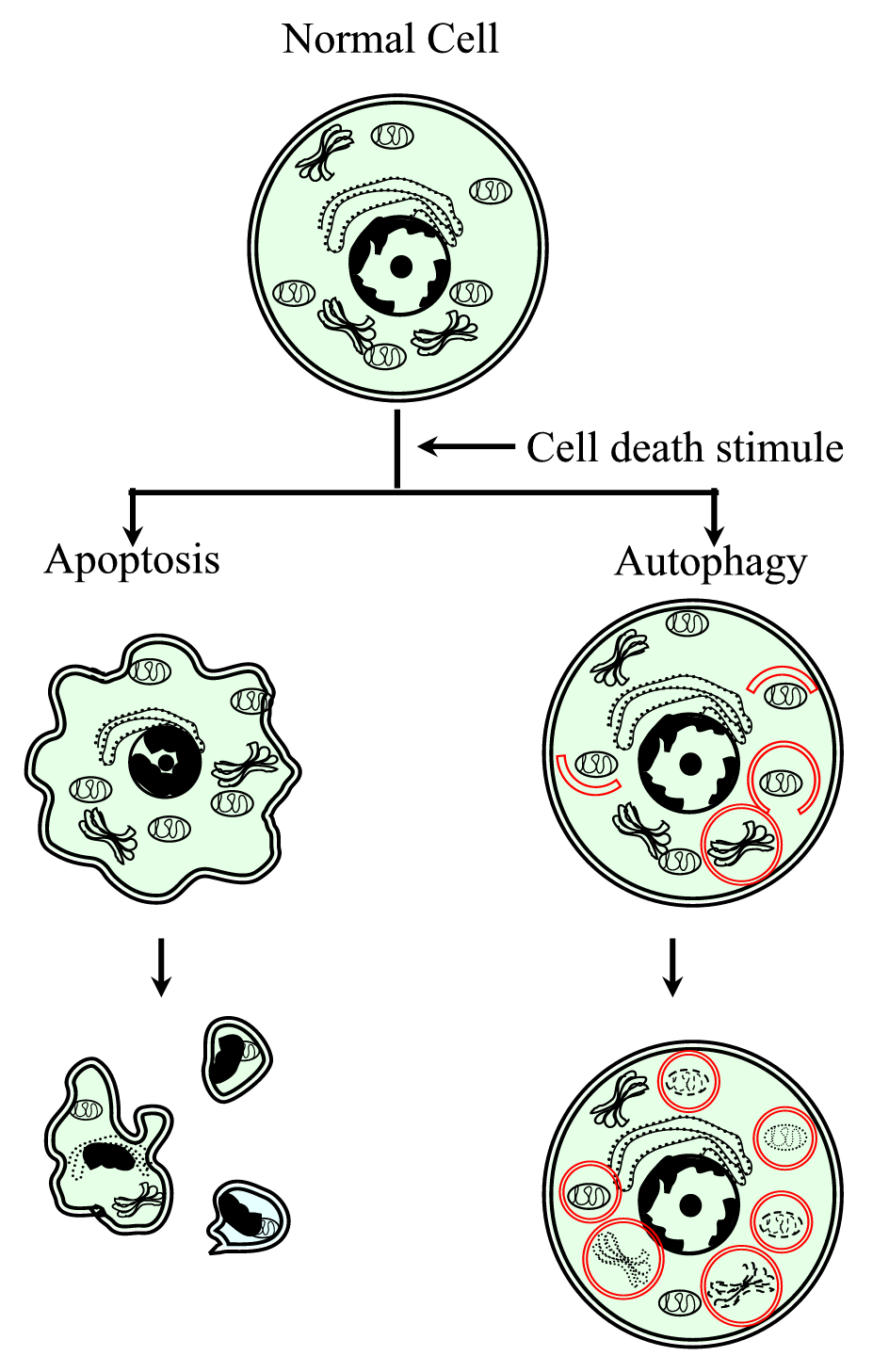
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi= “http://www.w3.org/2001/XMLSchema-instance az I. típusú (apoptózis) és a II.típusú (autofágia) programozott sejthalál folyamat vázlatos ábrázolása. Az apoptózist celluláris összehúzódás, kromatin tömörítés, membrán blebs, apoptotikus testek kialakulása jellemzi. Az autofágiát nagyszámú citoplazmatikus tartalmú autofagoszóma jelenléte jellemzi. A sejthalál mindkét típusa nem generál gyulladásos választ, mivel a citoplazmatikus membrán konzerválódik, amíg a sejttörmeléket a szomszédság vagy a specializáltak el nem távolítják.
a Kaszpázok ciszteinil-aszpartát-specifikus proteázok, amelyek inaktív formában szintetizálódnak, mint a pro-kaszpázoknak nevezett zimogének (2.ábra). Ez az inaktív forma teszi lehetővé a sejthalál folyamatának ellenőrzött végrehajtását. A kaszpázokat először a ceanorhabditis elegans fonálféregben azonosították, de az emlősökben homológ formák vannak jelen .
az apoptózis jellemzői, mint például a DNS fragmentáció és a tömörített kromatin, a kaszpáz aktivitásból származnak. Az apoptózis során a DNS fragmentálódik nukleoszóma méretre (200 bp) . Az apoptózis során a DNS fragmentációjáért felelős tényező egy specifikus DNáz (CAD, kaszpáz-aktivált DNáz), amelyet az aktív kaszpáz-3 aktivál . Az aktív kaszpáz-3 viszont részt vesz az apoptózis során bekövetkező morfológiai sejtváltozásokban, ahol az rho-asszociált kináz-1-et (ROCK-1) hasítja annak aktiválása érdekében, és ez végül befolyásolja a citoszkeletális elrendezést, ami az apoptotikus zsugorodási morfológiát okozza .

2.ábra.
xmlns: xlink= ” http://www.w3.org/1999/xlink ” xmlns:mml= “http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instance az apoptotikus folyamatban részt vevő Kaszpázok inaktív formában szintetizálódnak zimogénként, egy pro-doménből, egy nagy alegységből és egy kis alegységből állnak. A zimogének aktiválódnak, tetramereket képeznek.
az apoptotikus sejthalált a B-sejtes limfóma 2 (Bcl-2) család tagjai erősen szabályozzák . A Bcl-2 család tagjait anti-apoptotikus és pro-apoptotikus fehérjékként osztályozták Bcl-2 homológiájuk (BH) és doménszervezetük szerint (3.ábra). A BH1, BH2, BH3 és BH4 domének jelenléte megfelel annak a csoportnak, amely gátolja az apoptózist. A pro-apoptotikus csoport ezzel szemben két csoportra oszlik: a BH1, BH2 és BH3 doménekkel rendelkezőkre, valamint azokra, amelyek csak a BH3 doménekkel rendelkeznek (csak BH3-ként definiálva; lásd a felülvizsgálatot ). Ez a fehérjecsalád a mitokondriumok belsejében intracelluláris szinten látja el funkcióit, ami az apoptózis kulcsfontosságú eleme.

3.ábra.
xmlns: xlink= ” http://www.w3.org/1999/xlink” xmlns: mml= ” http://www.w3.org/1998/Math/MathML ” xmlns:xsi= “http://www.w3.org/2001/XMLSchema-instance B-sejtes limfóma 2 (Bcl-2) család fehérjék. A) A Bcl-2 fehérjék szerkezetének általános vázlata. B) az anti-apoptotikus tagok – rendelkeznek mind a négy BH doménnel. C) a pro-apoptotikus tagok, amelyek viszont két csoportra oszthatók: multidomain és BH3 csak.
az apoptózist két jól leírt út indíthatja el: a külső és a belső utak (4.ábra). A külső aktivációt a halál ligandumok (például a tumor nekrózis faktor – TNF – szupercsalád, valamint a TNF-hez kapcsolódó apoptózis által kiváltott ligandumok vagy TRAIL) részvételével hajtják végre rokon sejtfelszíni halálreceptorokkal (például TNF receptor 1, Fas, TRAIL receptor 1, vagy TRAIL receptor 2) (áttekintve ). Miután a ligandum felismeri és kötődik a receptorához, egy sor intracelluláris komplex képződik az iniciátor kaszpázok (például -8 és -10) aktiválására, amelyek ezután aktiválják a végrehajtó kaszpázokat (például -3, -6 és -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. A ligandum-receptor kölcsönhatás indukálja a halálos indukáló jelátviteli komplex (DISC) összeszerelését a kaszpáz-8 aktiválásának elősegítésére, amely viszont képes aktiválni a végrehajtó kaszpáz -3, -6 vagy -7, az apoptózis morfológiai változásaihoz vezetve. A belső utat a mitokondriális külső membrán permeabilizációja irányítja, amely lehetővé teszi a pro-apoptotikus elemek felszabadulását citokróm-C. a citokróm-C indukálja az apoptózis proteáz-aktiváló 1.faktort (Apaf-1), hogy elősegítse a kaszpáz-9 aktiválódását az apoptoszóma összeállításához. Az apoptoszóma képes aktiválni a végrehajtó kaszpázokat.
a belső apoptotikus útvonal ezzel szemben különböző ingerekkel aktiválható, beleértve a DNS károsodását, a növekedési faktor éhezését és az oxidatív stresszt . A sejtek ezen ingereknek való kitettsége során a mitokondriumok érintettek, mivel a Bcl-2 család több tagja aktiválódik és elősegíti a mitokondriumok külső membrán permeabilizációját (MOMP). A behatolt külső mitokondrium membrán lehetővé teszi a citokróm c (cyt c) felszabadulását, amely az Apaf-1 fehérjéhez kapcsolódik. A cyt c és az Apaf-1 Unió ezután kötődik az iniciátor kaszpáz-9-hez, hogy kialakítsa az apoptoszómát alkotó komplexet, amely képes aktiválni a funkcióikat ellátó iniciátor kaszpázokat specifikus sejtszubsztrátok hasításával.
a sejthalál második folyamata, az autofágia egy genetikailag programozott és evolúciósan konzervált folyamat, amely az elavult organellák és fehérjék lebomlását eredményezi. Olyan extracelluláris ingerek aktiválják, mint a tápanyag-éhezés, a hipoxia, a magas hőmérséklet, a megváltozott intracelluláris állapotok, beleértve a sérült vagy felesleges organellák felhalmozódását (áttekintve ).
az eukarióta organizmusokban az autofágia három típusát írták le: mikroautofágia, makroautofágia (általában egyszerűen autofágiának nevezik) és chaperone által közvetített autofágia (5.ábra). A mikroautofágia magában foglalja a citoplazmatikus komponensek közvetlenül a lizoszóma szintjén történő elnyelését invaginációs folyamat útján, míg a makroautofágia kettős membrán vezikulák képződését vonja maga után, amelyek sejtkomponenseket tartalmaznak, amelyek összeolvadnak a lizoszómákkal, hogy autofagolizoszómát képezzenek. Az autofagolizoszóma belsejében az intra-vezikuláris komponensek lebomlanak, és ha lehetséges, a sejt újrahasznosítja (áttekintve ). A Chaperon által közvetített autofágia végül magában foglalja a chaperonok részvételét a lizoszómák által eliminációra kijelölt fehérjék felismerésében .

5.ábra.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instance az autofágia különböző mechanizmusainak vázlatos ábrázolása. A makroautofágia-autofágia-egy kettős membrán vezikulum kialakulását jelenti, amely elnyeli a citoplazmatikus tartalmat, amelyet a lebontandó lizoszómához vezetnek. A mikroautofágiát a citoplazmatikus komponensek lizoszóma általi közvetlen elnyelése jellemzi. Ez a folyamat magában foglalja az organelle membránjának átalakítását lizoszomális membrán invagináció kialakításával. A chaperone által közvetített autofágia során a lebomlandó fehérjéket egy Hsp70-re célozzák meg, amelyek viszont a cél rakományt a lizoszómába szállítják.
az Autofágiát Atg(Autofágiával kapcsolatos) gének irányítják, amelyek szükségesek az autofágoszómák képződését kiváltó jelátviteli komplex aktiválásához . Az atggeneket élesztőben fedezték fel, de sokuknak ortológusa van a magasabb eukariótákban (6.ábra). Az autofagoszóma kialakulása magában foglalja az lc3 (Atg8) citoplazmatikus fehérje részvételét, amely foszfatidil-etanol-aminnal lipidálódik, majd a kialakuló autofagoszóma membránba kerül (7.ábra). A lipidált lc3 fehérje (LC3-II néven ismert) felhalmozódását az autofágia markereként használják .

6.ábra.
xmlns: xlink= ” http://www.w3.org/1999/xlink” xmlns: mml= ” http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. Az LC3 fehérjét a foszfatidil-etanol-amin lipidálja.
az autofág sejthalált, vagy a II.típusú programozott sejthalált a citoplazma autofág vezikulák általi hatalmas elnyelése jellemzi. Ez az intenzív autofágikus aktivitás lényegesen különbözik a bazális szinten folyamatosan előforduló autofágiától. A Drosophila ultrastrukturális tanulmányai feltárták az autophagikus vacuolák felhalmozódását a legtöbb lárva szövetben. Ez a fajta programozott sejthalál a citoplazmatikus organellák autofágia általi lebomlásával kezdődik, bár a citoszkeletális elemek a folyamat késői szakaszáig konzerválódnak (áttekintve ).
