tanulási célok
- írja le az aminosav alapvető szerkezetét
- írja le a fehérjék kémiai szerkezetét
- összefoglalja a fehérjék egyedi jellemzőit
e fejezet elején egy híres kísérletet írtak le, amelyben a tudósok olyan körülmények között szintetizálták az aminosavakat, amelyek szimulálják a földön jelen lévőket jóval az általunk ismert élet evolúciója előtt. Ezek a vegyületek lényegében bármilyen számban képesek egymáshoz kapcsolódni, lényegében bármilyen méretű molekulákat eredményezve, amelyek sokféle fizikai és kémiai tulajdonsággal rendelkeznek, és számos olyan funkciót látnak el, amelyek minden szervezet számára létfontosságúak. Az aminosavakból származó molekulák a sejtek és a szubcelluláris entitások szerkezeti összetevőiként, tápanyagforrásokként, atom – és energiatároló tartályokként, valamint funkcionális fajokként, például hormonokként, enzimekként, receptorokként és transzportmolekulákként működhetnek.
aminosavak és peptidkötések

1. ábra.
az aminosav olyan szerves molekula, amelyben egy hidrogénatom, egy karboxilcsoport (–COOH) és egy aminocsoport (–NH2) mind ugyanahhoz a szénatomhoz, az ún. A negyedik csoport, amely a különböző aminosavakhoz kötődik, a különböző aminosavak között változik, és maradéknak vagy oldalláncnak nevezik, amelyet szerkezeti képletekben R betűvel ábrázolnak.a maradék egy monomer, amely akkor keletkezik, amikor két vagy több aminosav kombinálódik és eltávolítja a vízmolekulákat. A fehérje, a peptidlánc elsődleges szerkezete aminosavmaradékokból áll. A funkciós csoportok és az R csoportok egyedi jellemzői lehetővé teszik az aminosavak ezen komponenseinek hidrogén -, ionos és diszulfidkötéseket, valamint a szekunder, tercier és kvaterner fehérjeszerkezetek kialakításához szükséges poláris/nempoláris kölcsönhatásokat. Ezek a csoportok elsősorban szénből, hidrogénből, oxigénből, nitrogénből és kénből állnak, szénhidrogének, savak, amidok, alkoholok és aminok formájában. Néhány példa szemlélteti ezeket a lehetőségeket az 1.ábrán.
az aminosavak kémiailag összekapcsolódhatnak az egyik molekula karbonsavcsoportjának a másik amincsoportjával való reakciójával. Ez a reakció peptidkötést és vízmolekulát képez, és egy másik példa a dehidratációs szintézisre (2.ábra). A viszonylag szerény számú (körülbelül 50 vagy annál kevesebb) aminosav kémiai összekapcsolásával képződő molekulákat peptideknek nevezzük, és az előtagokat gyakran használják ezeknek a számoknak a meghatározására: dipeptidek (két aminosav), tripeptidek (három aminosav) stb. Általánosabban, az aminosavak hozzávetőleges számát jelöljük: az oligopeptidek legfeljebb körülbelül 20 aminosav összekapcsolásával képződnek, míg a polipeptidek legfeljebb körülbelül 50 aminosavból szintetizálódnak. Amikor az egymással összekapcsolt aminosavak száma nagyon nagy lesz, vagy ha több polipeptidet használnak épület alegységként, az eredményül kapott makromolekulákat fehérjéknek nevezzük. Ezeknek a biopolimereknek a folyamatosan változó hossza (a monomerek száma), valamint az egyes aminosavakon található lehetséges R-csoportok sokfélesége lehetővé teszi a képződő fehérjék típusainak szinte korlátlan sokféleségét.

2. ábra. A peptidkötés kialakulása dehidrációs szintézis reakció. Az első aminosav (alanin) karboxilcsoportja kapcsolódik a bejövő második aminosav (alanin) aminocsoportjához. A folyamat során egy vízmolekula szabadul fel.
Gondolj bele
- hány aminosav van a polipeptidekben?
fehérje szerkezete
a fehérje mérete (hossza) és specifikus aminosav-szekvenciája a fehérje alakjának fő meghatározója, és a fehérje alakja kritikus a funkciója szempontjából. Például a biológiai nitrogénkötés folyamatában (lásd biogeokémiai ciklusok), a talaj mikroorganizmusai, amelyeket együttesen rhizobia néven ismerünk, szimbiotikusan kölcsönhatásba lépnek a hüvelyes növények gyökereivel, például szójababbal, földimogyoróval vagy babgal, hogy új struktúrát képezzenek, amelyet csomónak neveznek a növény gyökerein. A növény ezután egy leghemoglobin nevű hordozófehérjét termel, amely nitrogént vagy oxigént hordoz. A Leghemoglobin nagyon nagy affinitással kötődik a szubsztrát oxigénjéhez a fehérje egy meghatározott régiójában, ahol a forma és az aminosav-szekvencia megfelelő (az aktív hely). Ha az aktív hely alakja vagy kémiai környezete megváltozik, akár kissé is, akkor a szubsztrát nem képes olyan erősen megkötni, vagy egyáltalán nem kötődik. Így ahhoz, hogy a fehérje teljes mértékben aktív legyen, a funkciójának megfelelő alakúnak kell lennie.
a fehérje szerkezetét négy szint szerint osztályozzák: elsődleges, másodlagos, harmadlagos és kvaterner. Az elsődleges szerkezet egyszerűen a polipeptidláncot alkotó aminosavak szekvenciája. A 3. ábra egy fehérje elsődleges szerkezetét ábrázolja.
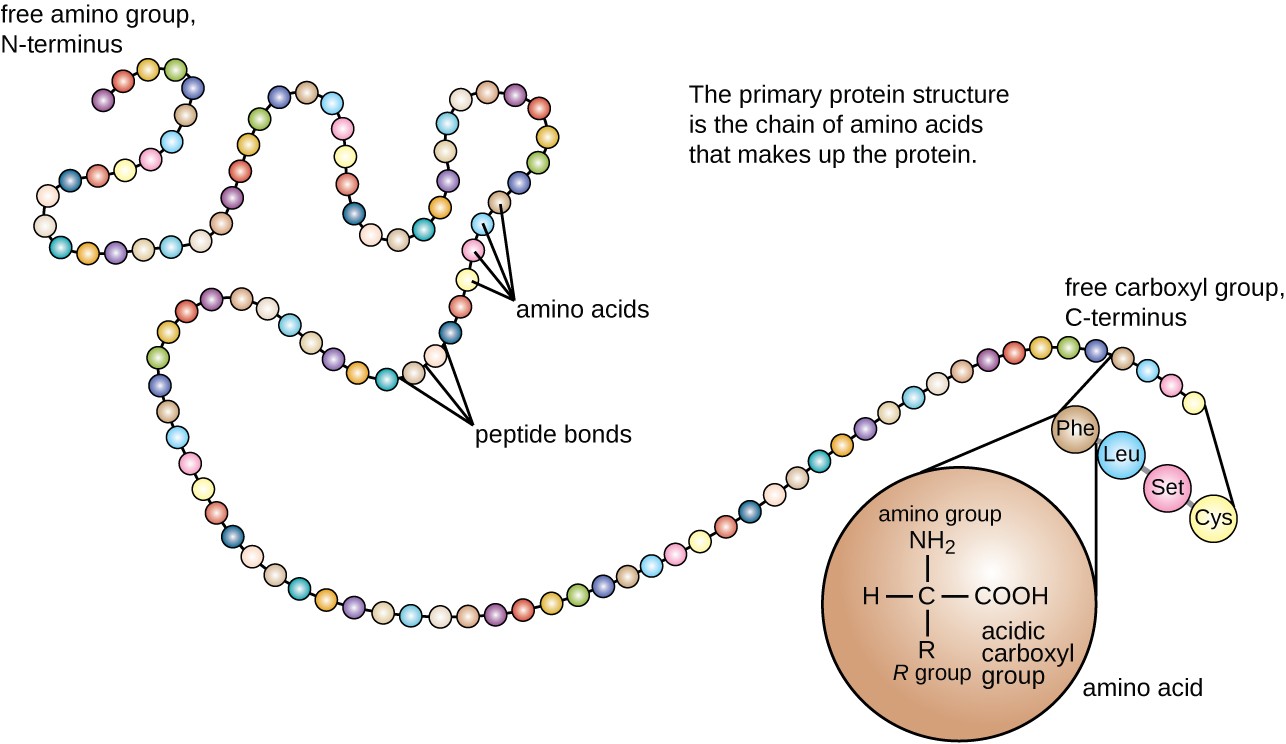
3. ábra. Kattintson a nagyobb kép megtekintéséhez. A fehérje elsődleges szerkezete az aminosavak szekvenciája. (hitel: a National Human Genome Research Institute munkájának módosítása)
az aminosavak lánca, amely meghatározza a fehérje elsődleges szerkezetét, nem merev, hanem rugalmas az aminosavakat összetartó kötések jellege miatt. Ha a lánc elég hosszú, hidrogénkötés léphet fel a peptid gerincén belüli amin és karbonil funkciós csoportok között (kivéve az R oldalcsoportot), ami a polipeptidlánc lokalizált összehajtását eredményezi hélixekké és lemezekké. Ezek a formák alkotják a fehérje másodlagos szerkezetét. A leggyakoribb másodlagos szerkezetek a (hélix) és (hélix) (hélix) lapok. A hélix szerkezetben a hélixet hidrogénkötések tartják az egyik aminosav karbonilcsoportjában lévő oxigénatom és az aminocsoport hidrogénatomja között, amely csak négy aminosav egység távolabb van a lánc mentén. A polipeptidlánc gerincén tovább elválasztott karbonil-és aminocsoportok folytonos szekvenciái közötti hasonló hidrogénkötések révén képződnek (4.ábra).

4. ábra. A fehérje másodlagos szerkezete lehet egy a-hélix vagy egy a-ra-rakott lap, vagy mindkettő.
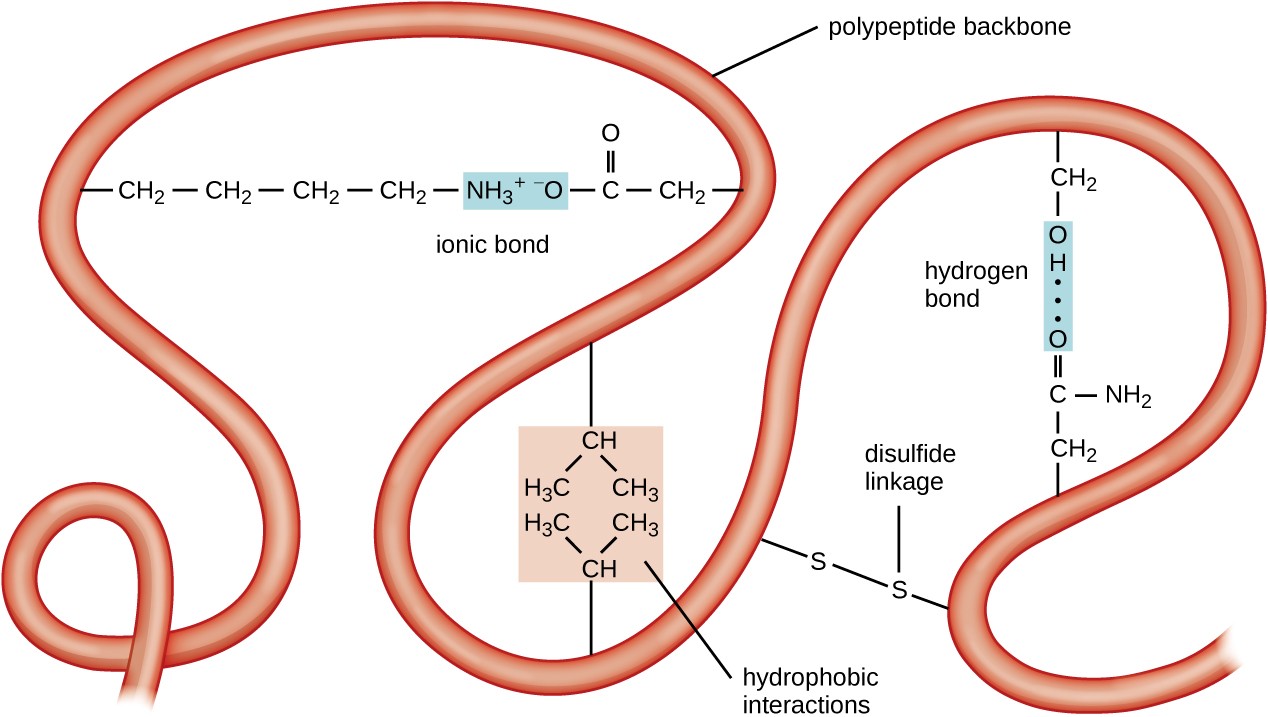
5. ábra. Kattintson a nagyobb kép megtekintéséhez. A fehérjék harmadlagos szerkezetét számos vonzó erő határozza meg, beleértve a hidrofób kölcsönhatásokat, az ionos kötést, a hidrogénkötést és a diszulfidkötéseket.
a fehérje szerveződésének következő szintje a harmadlagos szerkezet, amely egyetlen polipeptidlánc nagyszabású háromdimenziós alakja. A tercier szerkezetet a láncban távol eső aminosavmaradékok közötti kölcsönhatások határozzák meg. A különböző kölcsönhatások fehérje tercier struktúrát eredményeznek, mint például a diszulfid hidak, amelyek kötések a szulfhidril (–SH) funkcionális csoportok között az aminosav oldalcsoportokon; hidrogénkötések; ionos kötések; valamint a nem poláros oldalláncok közötti hidrofób kölcsönhatások. Mindezek a kölcsönhatások, gyengék és erősek, együttesen határozzák meg a fehérje végső háromdimenziós alakját és funkcióját (5.ábra).
az a folyamat, amelynek során a polipeptidlánc nagyméretű, háromdimenziós alakot vesz fel, fehérje hajtogatásnak nevezzük. A normál biológiai szerepükben teljesen működőképes hajtogatott fehérjékről azt mondják, hogy natív szerkezettel rendelkeznek. Amikor egy fehérje elveszíti háromdimenziós alakját, lehet, hogy már nem működik. Ezeket a kibontott fehérjéket denaturáljuk. A denaturáció magában foglalja a másodlagos és a harmadlagos szerkezet (és ha jelen van, a kvaterner szerkezet) elvesztését az elsődleges szerkezet elvesztése nélkül.
egyes fehérjék több különálló polipeptid, más néven fehérje alegység összeállítása. Ezek a fehérjék csak akkor működnek megfelelően, ha Minden alegység jelen van és megfelelően van konfigurálva. Az ezeket az alegységeket összetartó kölcsönhatások alkotják a fehérje kvaterner szerkezetét. A teljes kvaterner struktúrát viszonylag gyenge kölcsönhatások stabilizálják. A Hemoglobin például négy globuláris protein alegységből álló kvaterner szerkezettel rendelkezik: két fő és két fő polipeptid, amelyek mindegyike vasalapú Hemet tartalmaz (6.ábra).

6. ábra. Egy hemoglobin molekulának két fő polipeptidje és két fő polipeptidje van négy hem csoporttal együtt.
a fehérjék másik fontos osztálya a konjugált fehérjék, amelyek nem protein részűek. Ha a konjugált fehérje szénhidráthoz kapcsolódik, akkor glikoproteinnek nevezik. Ha van egy lipid, akkor lipoproteinnek nevezik. Ezek a fehérjék a membránok fontos összetevői. A 7. ábra a fehérje szerkezetének négy szintjét foglalja össze.

7. ábra. A fehérje szerkezetének négy szervezeti szintje van. (hitel: a National Human Genome Research Institute munkájának módosítása)
Gondolj bele
- mi történhet, ha egy fehérje elsődleges, másodlagos, harmadlagos vagy kvaterner szerkezete megváltozik?
elsődleges szerkezet, diszfunkcionális fehérjék és cisztás fibrózis

8. ábra. Kattintson a nagyobb kép megtekintéséhez. A normál CFTR fehérje egy csatornafehérje, amely segíti a só (nátrium-klorid) sejtekbe történő be-és kilépését.
a biológiai membránokhoz kapcsolódó fehérjéket külső vagy belső kategóriába sorolják. A külső fehérjék, más néven perifériás fehérjék, lazán kapcsolódnak a membrán egyik oldalához. Az Intrinsic fehérjék vagy integrál fehérjék a membránba ágyazódnak, és gyakran transzmembrán fehérjékként működnek a transzportrendszerek részeként. A cisztás fibrózis (CF) egy emberi genetikai rendellenesség, amelyet a transzmembrán fehérje változása okoz. Leginkább a tüdőt érinti, de hatással lehet a hasnyálmirigyre, a májra, a vesére és a belekre is. A CF-et az aminosav elvesztése okozza fenilalanin cisztás fibrózisban transzmembrán fehérje (CFTR). Egy aminosav elvesztése megváltoztatja a fehérje elsődleges szerkezetét, amely általában segíti a só és a víz szállítását a sejtekbe és a sejtekből (8.ábra).
az elsődleges szerkezet változása megakadályozza a fehérje megfelelő működését, ami a szervezetben szokatlanul vastag nyálkát termel, amely eltömíti a tüdőt, és ragacsos nyálka felhalmozódásához vezet. A nyálka elzárja a hasnyálmirigyet, és megakadályozza a természetes enzimeket abban, hogy segítsék a szervezetet az élelmiszer lebontásában és a létfontosságú tápanyagok felszívásában.
a cisztás fibrózisban szenvedő egyének tüdejében a megváltozott nyálka olyan környezetet biztosít, ahol a baktériumok boldogulhatnak. Ez a kolonizáció biofilmek kialakulásához vezet a tüdő kis légutakban. A cisztás fibrózisban szenvedő betegek tüdejében leggyakrabban előforduló kórokozók a Pseudomonas aeruginosa (9a Ábra) és a Burkholderia cepacia. A Pseudomonas a tüdőben lévő biofilmben differenciálódik, és nagy kolóniákat képez, az úgynevezett “mucoid” Pseudomonas. A kolóniák egyedülálló pigmentációval rendelkeznek, amely a laboratóriumi vizsgálatok során megjelenik (9b Ábra), és az orvosok számára az első nyom, hogy a beteg CF-ben szenved (ilyen kolóniák ritkák az egészséges egyénekben).

9. ábra. (a) pásztázó elektronmikrográf mutatja az opportunista baktérium Pseudomonas aeruginosa. B) Pigmenttermelő P. a cetrimid-agar aeruginosa a pyocyanin nevű zöld pigmentet mutatja. (credit a: A Centers for Disease Control and Prevention munkájának módosítása)
kulcsfogalmak és összefoglalás
- az aminosavak kis molekulák, amelyek nélkülözhetetlenek minden élethez. Mindegyikben van egy-egy szénatom, amelyhez hidrogénatom, karboxilcsoport és amincsoport kapcsolódik. A negyedik kötött csoport, amelyet R képvisel, változik a kémiai összetételben, a méretben, a polaritásban és a töltésben a különböző aminosavak között, változó tulajdonságokat biztosítva.a
- peptidek olyan polimerek, amelyeket az aminosavak dehidratációs szintézis útján történő összekapcsolása képez. A kapcsolt aminosavak közötti kötéseket peptidkötéseknek nevezzük. Az egymással összekapcsolt aminosavak száma néhánytól sokig változhat.
- a fehérjék olyan polimerek, amelyeket nagyon sok aminosav kötése képez. Számos fontos funkciót látnak el egy sejtben, tápanyagként és enzimként szolgálnak; tároló molekulák szén, nitrogén és energia számára; és szerkezeti összetevők.
- a fehérje szerkezete kritikus meghatározója a funkciójának, és egy fokozatos osztályozással írja le: elsődleges, másodlagos, harmadlagos és kvaterner. A fehérje natív szerkezetét a denaturáció megzavarhatja, ami magasabb rendű szerkezetének és biológiai funkciójának elvesztését eredményezheti.
- egyes fehérjéket több különálló fehérje alegység alkot, ezeknek az alegységeknek a kölcsönhatása alkotja a fehérje komplex kvaterner szerkezetét.
- a konjugált fehérjéknek van egy nempolipeptid része, amely lehet szénhidrát (glikoproteint képezve) vagy lipidfrakció (lipoproteint képezve). Ezek a fehérjék a membránok fontos összetevői.
feleletválasztós
az alábbi csoportok közül melyik változik a különböző aminosavak között?
- hidrogénatom
- karboxilcsoport
- R csoport
- aminocsoport
a fehérjékben jelen lévő aminosavak az alábbiak közül melyikben különböznek?
- méret
- alak
- Oldalcsoportok
- a fentiek mindegyike
az alábbi kötések közül melyik nem vesz részt a harmadlagos struktúrában?
- peptidkötések
- ionos kötések
- hidrofób kölcsönhatások
- hidrogénkötések
töltse ki az üres
a fehérje aminosavainak szekvenciáját nevezzük __________.
a denaturáció a __________ és __________ struktúrák elvesztése nélkül __________ szerkezet.
igaz/hamis
egy fehérje szekvencia egyik aminosavának változása mindig funkcióvesztést eredményez.
Gondolj bele
- egy fehérje megfelelő melegítése denaturálódást okozhat. Figyelembe véve a denaturáció meghatározását, mit mond ez az állítás a peptidkötések erősségeiről a hidrogénkötésekhez képest?
- a bemutatott kép egy tetrapeptidet ábrázol.

- hány peptidkötés van ebben a molekulában?
- azonosítsa a peptidet alkotó négy aminosav oldalcsoportjait.
